ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
13. ОСНОВЫ БИОЭНЕРГЕТИКИ. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
13.4. Окислительно-восстановительные реакции в биологических системах
Главное в метаболизме — перенос фосфорильных групп. Однако важен ведь и другой вид переноса — перенос электронов в окислительновосстановительных реакциях. В этих реакциях происходит потеря электронов одной молекулой, которая при этом окисляется, и получение электронов другой молекулой, которая восстанавливается. За работу, которая совершается живыми организмами, прямо или косвенно отвечают потоки электронов в окислительно-восстановительных реакциях. У нефотосинтезирующих организмов источниками электронов служат восстановленные соединения (пища); у фотосинтезирующих организмов в роли первоначального донора электронов выступает молекула, способная переходить в возбужденное состояние при поглощении света. Пути переноса электронов при метаболизме сложные. В катализируемых ферментами реакциях электроны движутся от различных промежуточных продуктов метаболизма к специализированным переносчикам электронов. Переносчики в свою очередь отдают электроны акцепторам, имеющим более высокое сродство к электронам, и это приводит к выделению энергии. В клетках содержатся разнообразные молекулы — преобразователи энергии, которые превращают энергию электронного потока в полезную работу.
Мы начинаем наше обсуждение с того, как электродвижущая сила (эдс) может совершать работу, затем коснемся теоретических основ и экспериментальных принципов измерений энергии в окислительных реакциях в терминах эдс и обсудим соотношение между этой силой, выражаемой в вольтах, и изменением свободной энергии — в джоулях. В заключение мы опишем химические основы процессов окисления- восстановления, а также строение наиболее распространенных специализированных переносчиков электронов, которые неоднократно встречаются в следующих главах.
Поток электронов может выполнять биологическую работу
Всякий раз, когда мы используем электродвигатель, включаем электрический свет или электронагреватель или же в двигателе нашего автомобиля проскакивает искра, воспламеняющая бензин, на самом деле это совершает работу поток электронов. Источником электронов в электрической цепи может быть батарейка (аккумулятор, электрохимический элемент) с двумя электродами, которые изготовлены из двух разных химических элементов. Электрические провода обеспечивают протекание потока электронов от химического элемента на одном полюсе батарейки через двигатель (внешнюю цепь) к другому химическому элементу на другом полюсе батарейки. Благодаря тому, что материал противоположно заряженных электродов имеет разное сродство к электрону, во внешней цепи самопроизвольно течет электрический ток (поток электроны) под действием силы, пропорциональной разности сродства к электронам материалов электродов, т. е. под действием электродвижущей силы (эдс). Электродвижущая сила (как правило, в несколько вольтов) способна совершать работу, если в цепь включен преобразователь энергии, в данном случае электродвигатель. Для совершения полезной работы двигатель можно соединить с несколькими механизмами.
В живых клетках также есть внутренняя биологическая «электроцепь», в которой электроны поставляет такое соединение, как, например, глюкоза. При ферментативном окислении глюкозы освобожденные электроны спонтанно движутся через целый ряд промежуточных соединений — переносчиков эектронов (интермедиатов) к другому химическому соединению, например, O2. Такой транспорт электронов — экзергонический процесс, поскольку O2 обладает более высоким сродством к электрону по сравнению с интермедиатами, переносящими электроны. Результирующая эдс снабжает энергией множество молекулярных преобразователей энергии (ферменты и другие белки), которые совершают биологическую работу. Например, в митохондриях связанные с мембраной ферменты сопрягают поток электронов с образованием трансмембранной разности pH, выполняющей осмотическую и электрическую работу. Созданный таким образом протонный градиент обладает потенциальной энергией, которая иногда называется протон-движущей силой по аналогии с электродвижущей силой. Другой фермент ATP-синтаза на внутренней мембране митохондрий использует протондвижущую силу для совершения химической работы: синтеза АТР из ADP и Pi (по мере самопроизвольного транспорта протонов через мембрану). Сходным образом у Е. coli локализованные в мембране ферменты преобразуют эдс в протондвижущую силу, которая затем используется для движения жгутиков. Электрохимические принципы, которые регулируют изменение энергии в макроскопической цепи с электродвигателем и батарейкой (аккумулятором), с одинаковым успехом применимы и к молекулярным процессам, сопровождающимся электронными потоками в живых клетках.
Окислительно-восстановительные процессы можно представить в виде полуреакций
Хотя окисление и восстановление не происходят поодиночке (друг без друга), при описании переноса электронов удобно рассматривать окислительно-восстановительную реакцию как две полуреакции. Например, окисление иона железа Fe2+ ионом меди Сu2+
Fe2+ + Cu2+ ⇄ Fe3+ + Cu+
можно записать в виде двух полуреакций, где Fe2+ — восстановитель, а Сu2+ — окислитель:
Окисление: Fe2+ ⇄ Fe3+ + e- (1)
Восстановление: Cu2+ + е- ⇄ Cu+ (2)
В окислительно-восстановительной реакции вещество, отдающее электроны (донор электронов), называется восстановителем; а акцептор электронов (принимает электроны) называется окислителем. В данном случае двухзарядные катионы железа Fe2+ и трехзарядные катионы Fe3+ образуют сопряженную окислительно-восстановительную пару (редокс-пару). Аналогично, кислота и соответствующее основание — тоже сопряженная пара, но это кислотно-основная пара. Напомним (см. гл. 2, т. 1), что кислотно-основные реакции в общем виде записывают следующим образом:
донор протонов ⇄ Н+ + акцептор протонов
Для окислительно-восстановительных реакций можно написать похожее общее уравнение:
донор электронов ⇄ е- + акцептор электронов
В полуреакции (1) Fe2+ — донор электронов, a Fe3+ — акцептором электронов. Ионы Fe2+ и Fe3+ — сопряженная редокс-пара.
Переносы электронов в окислительно-восстановительных реакциях между органическими и неорганическими соединениями принципиально ничем не отличаются. В гл. 7 мы рассматривали окисление восстанавливающего сахара (альдегида или кетона) ионом меди Сu2+ (см. рис. 7-10):
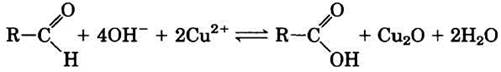
Эту реакцию можно представить в виде двух полуреакций:
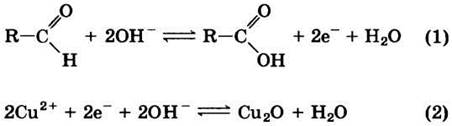
Поскольку от углерода альдегидной группы отщепляются два электрона, вторую полуреакцию (одноэлектронное восстановление двухвалентного иона меди до одновалентного) надо умножить на коэффициент 2, чтобы привести к балансу заряды в суммарной окислительно-восстановительной реакции.
Биологические процессы окисления часто включают и дегидрирование
В живых клетках углерод существует в нескольких состояниях окисления (рис. 13-22). Когда общая электронная пара находится между атомом углерода и другим, отличным от углерода атомом (обычно Н, С, S, N или О), эта электронная пара оказывается смещенной к более электроотрицательному атому. Электроотрицательность увеличивается в ряду H<C<S<N<O. Например, в метане СН4 углерод более электроотрицательный, чем любой из четырех связанных с ним атомов водорода, и поэтому в четырех связях С—Н атом С «притягивает» поближе к себе все восемь электронов (рис. 13-22). В этане электроны, образующие связь С—С, находятся на одинаковом расстоянии от каждого углерода и принадлежат им поровну, т. е. можно считать, что у одного атома углерода находятся только семь, а не восемь электронов. В этаноле атом С-1 менее электроотрицательный, чем связанный с ним кислород, и поэтому атом О «перетягивает к себе» оба электрона, образующих связь С—О, а вокруг атома С-1 остается только пять электронов. При каждой формальной потере электрона атом углерода подвергается окислению; это происходит даже без участия кислорода, например, когда алкан (—СН2-СН2—) превращается в алкен (—СН=СН—), происходит окисление — формальная потеря электронов, т. е. отрицательных зарядов, на самом деле происходит потеря атомов водорода. В биологических системах при окислении часто происходит дегидрирование, а многие ферменты, которые катализируют реакции окисления, называются дегидрогеназами. Заметим, что более восстановленные соединения на рис. 13-22 (вверху) богаче водородом, чем кислородом, в то время как в более окисленных соединениях (внизу) число атомов кислорода увеличивается, а число атомов водорода уменьшается.
Рис. 13-22. Состояния окисления углерода в биосфере. Обратите внимание на атомы углерода, которые отмечены красным, и их электроны связи. Если атом углерода связан с менее электроотрицательным атомом Н, оба электрона связи (красные) смещены к углероду. Если углерод связан с другим углеродом, электронная пара находится ровно посередение между ними, хотя только один из двух электронов в этой паре поступил от «красного» углерода. Если «красный» углерод связан с более электроотрицательным атомом О, электроны связи смещены к кислороду. Цифры в правой колонке указывают число электронов, смещенных к «красному» углероду, что можно использовать при грубой оценке степени окисления углерода в соединении (функциональной группе): в данном ряду соединений степень окисления углерода увеличивается сверху вниз.
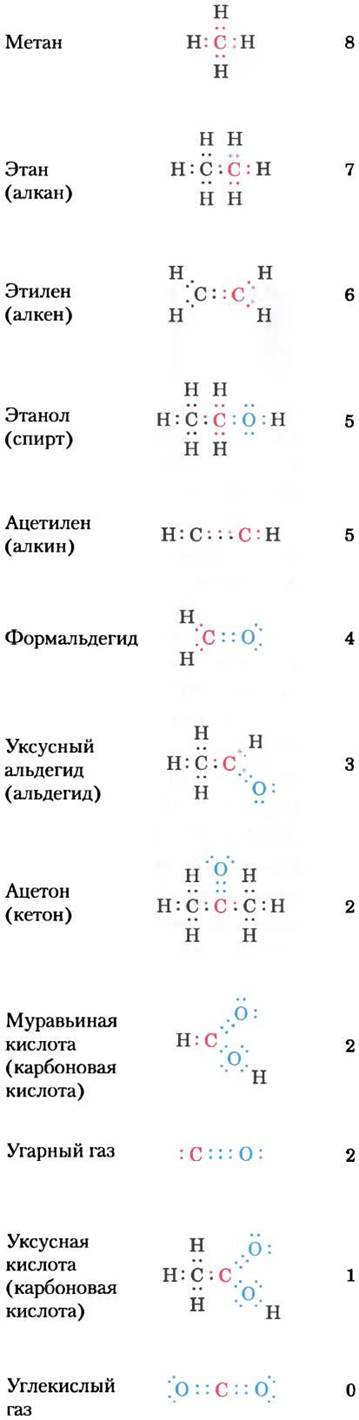
Не во всех биологических окислительновосстановительных реакциях участвует углерод. Например, при превращении молекулярного азота в аммиак происходит восстановление атомов азота.
6Н+ + 6е- + N2 —> 2NH3
Передача электронов от одной молекулы (донора электронов) к другой (акцептору электронов) осуществляется четырьмя различными способами.
1. Прямой перенос электронов. Например, окислительно-восстановительная пара Fe2+/Fe3+
может передавать электроны паре Cu+/Cu2+:
Fe2+ + Cu2+ Fe3+ + Cu+
2. Перенос атомов водорода (Н+ + е-), ведь формально атом водорода состоит из протона Н+ и одного электрона е-. В этом случае можно записать общее уравнение
АН2 ⇄ А + 2е- + 2Н+
где АН2 — донор водорода (или электронов). (Не путайте с реакцией диссоциации кислоты, в которой участвуют ионы Н+, но не электроны.) АН2 и А — это сопряженная окислительно-восстановительная пара (А/АН2), которая может участвовать в реакции с другой редокс-парой В/ВН2):
АН2 + В ⇄ А + ВН2
3. Перенос электронов от донора к акцептору в форме гидрид-иона (:Н)-, несущего два электрона, как в случае NAD-зависимых дегидрогеназ, о которых речь пойдет ниже.
4. Прямое присоединение кислорода. Здесь кислород взаимодействует с органическим восстановителем и ковалентно встраивается в продукт реакции. Примером такой реакции служит окисление углеводорода до спирта:
R—СН3 + 1/2O2 —> R-CH2-OH
В этой реакции углеводород — донор электронов, а кислород — акцептор электронов.
В клетках встречаются все четыре способа переноса электронов. В окислительновосстановительных реакциях для обозначения переноса заряда, эквивалентного 1 е-, используется термин восстановительный эквивалент; при этом не имеет значения, переносится ли сам электрон как таковой, атом водорода, гидрид- ион или же происходит реакция с кислородом, в результате которой образуется окисленный продукт. Поскольку молекулы питательных веществ обычно ферментативно дегидрируются с одновременной потерей двух восстановительных эквивалентов и поскольку каждый атом кислорода способен получить два восстановительных эквивалента, биохимики условились считать единицей биологического окисления два восстановительных эквивалента, переходящих с субстрата на кислород.
Восстановительный потенциал — мера сродства к электронам
Если в растворе присутствуют две сопряженные редокс-пары, перенос электрона от донора электрона одной пары к акцептору электрона другой может произойти спонтанно. Направление такой реакции зависит от сродства к электрону акцепторов электронов в каждой редокс-паре. Мерой этого сродства служит стандартный восстановительный потенциал Е° (измеряется в вольтах), его можно измерить экспериментально (рис. 13-23). Электрохимики выбрали в качестве стандарта, по отношению к которому проводится измерение, полуреакцию
Н+ + е- —> 1/2 Н2
Рис. 13-23. Измерение стандартного восстановительного потенциала Е'° редокс-пары. Направление потока электронов — от рабочего электрода к электроду сравнения. Самый известный электрод сравнения — водородный электрод (pH 0). Электродвижущая сила (эдс) водородного электрода принята равной 0,00 В. При pH 7 рабочего электрода Е'° водородного электрода составляет -0,414 В. Направление потока электронов зависит от относительного потенциала обоих электродов (так называемое «давление» электронов). Солевой мостик, содержащий насыщенный раствор КСl обеспечивает канал движения противоионов между рабочим электродом и электродом сравнения. Из наблюдаемого значения эдс и эдс ячейки сравнения экспериментатор может найти эдс рабочей ячейки, содержащей редокс-пару. По договоренности, у электрода, который «приобретает» электроны, более высокое положительное значение восстановительного потенциала.
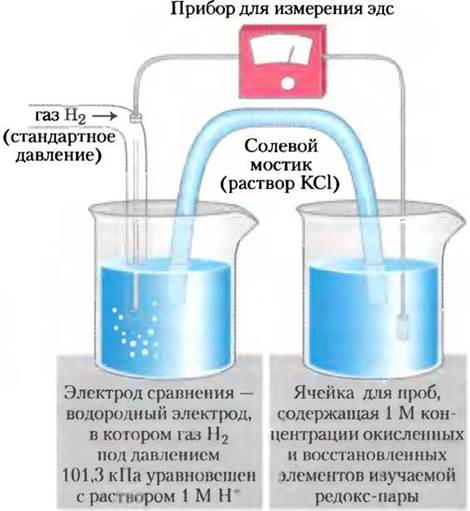
Этому водородному электроду (он называется полуячейкой), на котором данная полуреакция происходит, произвольно присвоен нулевой восстановительный потенциал Е'° = 0,00 В. Когда водородный электрод (электрод сравнения) соединен через внешнюю цепь с рабочим электродом (другой полуячейкой), находящимся в растворе со стандартными концентрациями окисленной и восстановленной форм (при стандартных условиях: 25 °С, концентрации растворов 1 М, давление газов 101,3 кПа), поток электронов во внешней цепи направлен от полуячейки с меньшим стандартным восстановительным потенциалом к полуячейке с большим потенциалом. По договоренности, у электрода (полуячейки) с наибольшим «стремлением» получить электроны Е° — положительное число (со знаком «плюс»), а у той, что передает электроны водородной ячейке, Е° — отрицательное число (со знаком «минус»). Когда два электрода соединены через внешнюю цепь, электрод, который имеет более высокое (более положительное) значение Е° (восстановительный потенциал выше), будет восстанавливаться.
Восстановительный потенциал полуячейки зависит не только от природы химического элемента, но и от его активности, которая связана с концентрацией в растворе. Более 100 лет назад Вальтер Нернст вывел уравнение, связывающее стандартный восстановительный потенциал Е° с восстановительным потенциалом Е для произвольной концентрации окисленных и восстановленных элементов в ячейке.
Уравнение Нернста
![]() (13-5)
(13-5)
где R — универсальная газовая постоянная, Т — абсолютная температура (в кельвинах), n — число перенесенных электронов на одну молекулу, F — постоянная Фарадея (табл. 13-1). При 298 К (25 °С) и после подстановки численных значений постоянных получим
![]() (13-6)
(13-6)
Ключевые договоренности.
В случае окислительно-восстановительных реакций биохимики определяют стандартные условия, как для ∆G'°: pH 7 и 25 °С; стандартный восстановительный потенциал обозначен Е'°. По договоренности, для любой окислительно-восстановительной реакции разность потенциалов Е'° равна разности восстановительных потенциалов Е'° акцептора и донора электронов. ■
В табл. 13-7 приведены стандартные восстановительные потенциалы Е'°, которыми мы и будем пользоваться — они применимы только для систем при нейтральном pH (pH 7). Любое значение Е'° в табл. 13-7 получено как разность потенциалов между стандартным водородным электродом (pH 0) и сопряженной редокс-пары с концентрацией 1 М и pH 7. Обратите внимание, что, согласно приведенным в табл. 13-7 данным, в цепи из сопряженной пары 2Н+/Н2 при pH 7 и стандартного водородного электрода (pH 0) электроны переходят из ячейки с pH 7 в стандартную ячейку (pH 0); таким образом, для пары 2Н+/Н3 измеряемое значение Е'° = -0,414 В.
Стандартные восстановительные потенциалы можно использовать для расчета изменений свободной энергии
Зачем биохимикам нужны восстановительные потенциалы? Их удобно использовать, ведь если для любых двух ячеек известны Е, измеренные относительно стандартного водородного электрода, можно найти их восстановительные потенциалы относительно друг друга. После этого можно предсказать направление потока электронов при соединении двух полуячеек внешней цепью или в том случае, если компоненты обеих ячеек окажутся в одном растворе. Электроны стремятся в полуячейку с более положительным значением Е, и сила тока пропорциональна разности восстановительных потенциалов ∆Е. Энергия самопроизвольной окислительно-восстановительной реакции характеризуется изменением свободной энергии и пропорциональна ∆Е:
∆AG = -nF∆E или ∆G'° = -nFE'°
где n означает число электронов, перенесенных в реакции. Зная Е'° (можно взять из таблицы восстановительных потенциалов (табл. 13-7)) и концентрации реагирующих веществ, с помощью этого уравнения можно рассчитать изменение свободной энергии окислительно-восстановительной реакции.
Таблица 13-7. Стандартные восстановительные потенциалы некоторых биологически важных полуреакций при pH 7,0 и 25 °С (298 К)
Полуреакция |
Е'°, В |
1/2О2 + 2Н+ + 2е —> Н2O |
0,816 |
Fe3+ + e- —> Fe2+ |
0,771 |
NO-3+ 2Н+ + 2е- —> NO-2 + Н2O |
0,421 |
Цитохром f (Fe3+) + е- —> цитохром / (Fe2+) |
0,365 |
Fe(CN)63-(феррицианид) + е- —> Fe(CN)64- |
0,36 |
Цитохром а3(Fe3+) + е- —> цитохром а3(Fe2+) |
0,35 |
O2 + 2Н+ + 2е- —> Н2O2 |
0,295 |
Цитохром a (Fe3+) + е- —> цитохром a (Fe2+) |
0.29 |
Цитохром с (Fe3+) + е- —> цитохром с (Fe2+) |
0,254 |
Цитохром c1 (Fe3+) + е- —> цитохром c1 (Fe2+) |
0,22 |
Цитохром b (Fe3+) + е- —> цитохром b (Fe2+) |
0,077 |
Убихинон + 2Н+ + 2е- —> убихинол + Н2 |
0,045 |
Фумарат2- + 2Н+ + 2е- —> сукцинат2- |
0,031 |
2Н+ +2е- —> Н2 (при стандартных условиях, pH 0) |
0,000 |
Кротонил-СоА + 2Н+ + 2е- —> бутирил-СоА |
0,015 |
Оксалоацетат2- + 2H++ 2е- —> малат2- |
0,166 |
Пируват + 2Н+ + 2е- —> лактат- |
-0,185 |
Ацетальдегид + 2Н+ + 2е- —> этанол |
0,197 |
FAD + 2Н+ + 2е- —> FADH2 |
-0,219а |
Глутатион + 2Н+ + 2е- —> 2 восстановленных глутатиона |
-0.23 |
S + 2Н+ + 2е- = H2S |
-0,243 |
Липоевая кислота + 2Н+ + 2е- —> дигидролипоевая кислота |
-0,29 |
NAD++ Н+ + 2е- —> NADH |
0,320 |
NADP++ Н+ + 2е- —> NADPH |
0,324 |
Ацетоацетат + 2Н+ + 2е- —> β-гидроксибутират |
-0,346 |
α-Кетоглутарат + СO2 + 2Н + 2е- —> изоцитрат |
-0,38 |
2Н+ + 2е- —> Н2 (при pH 7) |
0,414 |
Ферредоксин (Fe3+) + е- —> ферредоксин (Fe2+) |
-0,432 |
a Для свободного FAD; FAD, связанный со специфическим флавопротеином (например, сукцинатдегидрогеназой), имеет другое значение Е'°, которое зависит от белкового окружения.
Пример 13-3. Расчет ∆G'° и ∆G окислительно-восстановительной реакции
Найти изменение стандартной свободной энергии ∆G'° для реакции, в которой ацетальдегид восстанавливается биологическим переносчиком электронов NADH:
Ацетальдегид + NADH + Н+ —> этанол + NAD+
Далее рассчитать реальное изменение свободной энергии ∆G, если концентрация ацетальдегида и NАDН составляет 1,00 М, а концентрация этанола и NАD+ 0,100 М.
(1) Ацетальдегид + 2Н+ + 2е —> этанол
Е'° = -0,197 В
(2) NАD+ + 2Н+ + 2е-~ —> NАDН + Н+
Е'° = -0,320 В
Вспомните, что по договоренности ∆Е'° — это разность между ∆Е'° акцептора электронов и ∆Е'° донора.
Решение. В данном примере ацетальдегид — акцептор электронов (n = 2), которые он отдает NАDН.
∆Е’° = -0,197 В - (-0,320 В) = 0,123 В.
∆G'° = -nF∆Е'° = -2 • 96,5 кДж/(В • моль) • 0,123 В = -23,7 кДж/моль
Это изменение свободной энергии окислительновосстановительной реакции при pH 7, когда ацетальдегид, этанол, NАD+ и NАDН присутствуют в концентрациях 1,00 М.
Чтобы вычислить ∆G, когда концентрации ацетальдегида и NАDН 1,00 М, а этанола и NАD+ 0,100 М, сначала определим Е обоих восстановителей (уравнение 13-5):

Отсюда мы можем найти ∆Е, а затем по уравнению 13-6 рассчитать ∆G:
∆Е = -0,167 В - (-0,350) В = 0,183 В
∆G = -nF∆Е = -2 • 96,5 кДж/(В • моль) • 0,183 В = -35,3 кДж/моль
Таким образом можно рассчитать изменение свободной энергии любой окислительно-восстановительной реакции при любых концентрациях редокс-пар.
Для окисления глюкозы до углекислого газа в клетках необходимы специальные переносчики электронов
Основы энергетики окислительно-восстановительных реакций, о которых речь шла выше, применимы ко многим метаболическим реакциям с участием переносчиков электронов. Например, у многих организмов окисление глюкозы обеспечивает энергией синтез АТР. Для реакции полного окисления глюкозы
С6Н12O6 + 6O2 —> 6СO2 + 6Н2O
∆С'° = -2840 кДж/моль. Эта энергия намного больше той, что необходима для синтеза АТР (от 50 до 60 кДж/моль; см. доп. 13-1). В клетках глюкоза превращается в СO2 не по одной реакции с большим выделением энергии, а в серии контролируемых реакций, часть из которых окислительные. Свободная энергия, выделяемая при реакциях окисления, того же порядка по величине, что и энергия, необходимая для синтеза АТР из ADP, поэтому часть ее запасается. Электроны, высвобождаемые в реакциях окисления, переносятся на коферменты, такие как NAD+ и FAD (речь о них пойдет ниже), специализирующиеся на переносе электронов.
Некоторые коферменты и белки служат универсальными переносчиками электронов
Множествоферментов, катализирующихреакции окисления в клетке, направляют электроны с сотен своих различных субстратов на универсальные электронные переносчики всего лишь нескольких видов. Восстановление этих переносчиков в процессах катаболизма приводит к сохранению свободной энергии, которая выделяется при окислении субстрата. NAD+, NADP+, FMN и FAD — водорастворимые коферменты, которые подвергаются обратимому окислению и восстановлению во многих метаболических реакциях с переносом электронов. Нуклеотиды NAD+ и NADP+ без затруднений переходят от одного фермента к другому; флавиннуклеотиды FMN и FAD обычно очень прочно связаны с ферментами флавопротеинами, для которых они служат простетическими группами. Жирорастворимые хиноны, например, убихинон и пластохинон, действуют в качестве переносчиков электронов и доноров протонов в безводной среде — в мембранах. Железосерные белки и цитохромы с прочно связанными простетическими группами, которые подвержены обратимому окислению и восстановлению, также служат переносчиками электронов во многих окислительно-восстановительных реакциях. Некоторые из этих белков растворимы в воде, остальные являются периферическими или интегральными мембранными белками (см. рис. 11-6).
В завершение этой главы рассмотрим химические свойства нуклеотидных коферментов, а также некоторых ферментов (дегидрогеназ и флавопротеинов), использующие эти коферменты. Окислительно-восстановительные свойства хинонов, железосерных белков и цитохромов обсуждаются в гл. 19.
NADН и NADPН действуют совместно с дегидрогеназами — растворимыми переносчиками электронов
Никотинамидадениндинуклеотид (NАD+ в окисленной форме) и его фосфорилированный аналог никотинамидадениндинуклеотидфосфат (NАDР+) состоят из двух нуклеотидов, соединенных фосфоангидридной связью фосфатных групп (рис. 13-24, а). Поскольку никотинамидное кольцо напоминает пиридин, эти соединения иногда называют пиридиннуклеотидами. Источником никотинамидной функциональной группы в никотинамиднуклеотидах служит витамин ниацин.
Оба кофермента подвержены обратимому восстановлению никотинамидного кольца (рис. 13-24). Как только молекула субстрата окисляется (дегидрируется) с образованием двух атомов водорода, окисленная форма нуклеотида (NАD+ или NАDР+) присоединяет гидридный ион (:Н~, эквивалент протона и двух электронов) и восстанавливается (до NАDН или NАDРН). Второй выделившийся протон попадает в водную среду. Для каждого кофактора-нуклеотида можно написать полуреакцию:
NАD+ + 2е- + 2Н+ —> NADH + Н+
NАDР+ + 2е- + 2Н+ —> NАDРН + Н+
Рис. 13-24. NAD и NADP. а — никотинамидадениндинуклеотид NAD+ и его фосфорилированный аналог NADP подвергаются восстановлению до NADH и NADPH, присоединяя гидридный ион (т. е. два электрона и один протон) от окисляемого субстрата. Гидридный ион присоединяется либо спереди (сторона А), либо сзади (сторона Б) плоского никотинамидного кольца (см. табл. 13-8). б — УФ-спектр поглощения NAD+ и NADH. Восстановление никотинамидного кольца приводит к появлению новой широкой полосы поглощения с максимумом при 340 нм. Образование NADH в ферментативной реакции можно легко проследить, наблюдая за появлением поглощения при 340 нм (коэффициент молярной экстинкции ε340 = 6200 М-1см-1).
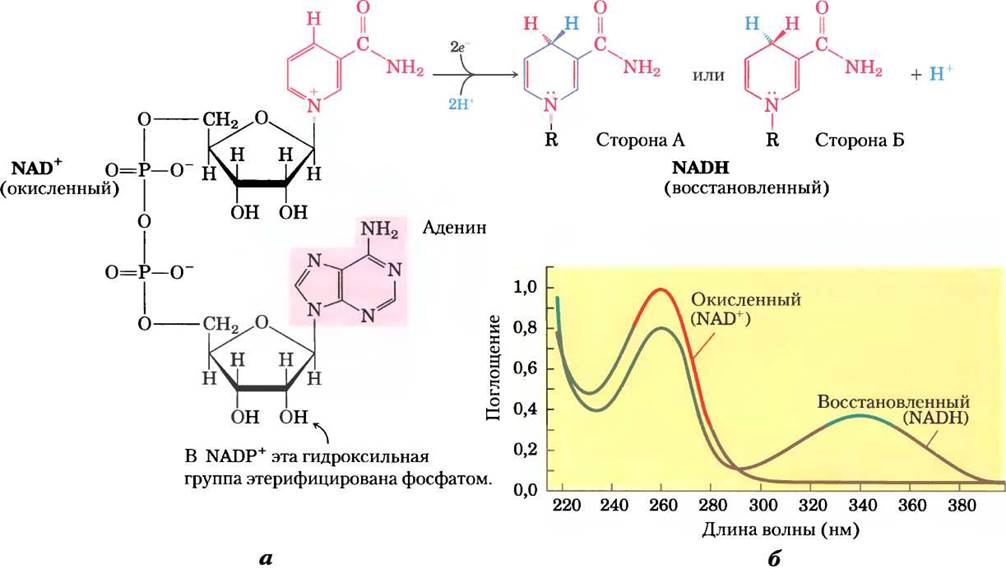
Восстановление NАD+ или NАDР+ превращает бензоидное кольцо никотинамидной функциональной группы (с положительным зарядом на азоте кольца) в хиноидную форму (отсутствует заряд на азоте). Обратите внимание, что восстановленные нуклеотиды поглощают свет при 340 нм, а окисленные формы нет (рис. 13-24, б). Знак плюс в аббревиатурах NАDП+ и NАDР+ не означает суммарный заряд на этих молекулах (обе они отрицательно заряжены); он указывает на то, что никотинамидное кольцо находится в окисленной форме с положительным зарядом на атоме азота. В аббревиатурах NАDН и NАDРН символ Н означает добавленный гидридный ион. Для этих нуклеотидов без уточнения их окислительного состояния используются обозначения NАD и NАDР.
В большинстве тканей общая концентрация [NАD+ + NАDН] ≈ 10-5 М, [NАDР+ + NАDРН] ≈ 10-6 М. Во многих клетках и тканях отношение NАD+(окисл.)/NАDН(восст.) — большая величина, что благоприятствует переносу гидрид- иона с субстрата на NАD+ с образованием NАDН. Напротив, NАDРН(восст.) обычно присутствует в больших количествах, чем окисленная форма NАDР+, что благоприятствует переносу водорода с NАDИРН на субстрат. Все это отражает специфическую роль в метаболизме этих двух коферментов: NАD+, как правило, действует при окислении, обычно в катаболических реакциях; а NАDРН — чаще при восстановлении, практически всегда в анаболических реакциях. Некоторые ферменты могут использовать любой кофермент, однако для большинства наблюдается значительное предпочтение одного кофермента перед остальными. Кроме того, процессы, в которых эти два кофактора принимают участие, изолированы друг от друга в разных органеллах эукариотических клеток: окисление энергоемких веществ, таких как пируват, жирные кислоты и α-кетокислоты, которые образуются из аминокислот, происходят в матриксе митохондрий, тогда как процессы восстановительного биосинтеза, например, синтез жирных кислот, — в цитоплазме. Эта функциональная и пространственная специализация позволяет клетке содержать два индивидуальных хранилища переносчиков электронов с своими особыми функциями.
Известно более 200 ферментов, катализирующих реакции, в которых NАD+ (или NАDР+) получает гидридный ион с восстановленного субстрата или NАDРН (или NADH), отдают гидридный ион окисленному субстрату. Напишем эти реакции в общем виде:
АН2 + NАD+ —> А + NАDН + Н+
А + NАDРН + Н+ —> АН2 + NАПDР+
где АН2 восстановленный субстрат, а А — окисленный. Общее название этого класса ферментов — оксидоредуктазы, обычно же их называют дегидрогеназами. Например, алкогольдегидрогеназа катализирует первичный катаболизм этанола — окисление до уксусного альдегида:
![]()
Обратите внимание, что один из атомов углерода в этаноле потерял водород; спирт при этом окислился до альдегида (чтобы оценить состояния окисления углерода, вернитесь к рис. 13-22).
В восстановленном NАD+ или NАDР+ гидридный ион, вообще говоря, может быть перенесен на любую сторону никотинамидного кольца: переднюю (А) или заднюю (Б), как показано на рис. 13-24, а. Исследования субстратов с изотопными метками показали, что данный фермент катализирует либо перенос типа А, либо типа Б, но не оба одновременно. Например, алкогольдегидрогеназа дрожжей и лактатдегидрогеназа сердца позвоночных переносит гидридный ион на сторону А никотинамидного кольца или удаляет гидридный ион с этой стороны кольца; поэтому они выделены в дегидрогеназы типа А, чтобы отличить их от другой группы ферментов, переносящих гидридный ион на (или удаляющих гидридный ион со) сторону(ы) Б никотинамидного кольца (табл. 13-8). Специфичность фермента по той или другой стороне может быть очень значительной; например, у лактатдегидрогеназы предпочтение стороны А над стороной Б больше, чем в 5 • 107 раз! Причина такого предпочтения заключается в специфическом расположении функциональных групп в молекуле фермента, участвующих в образовании водородной связи, относительно группы —CONH2 никотинамида.
Таблица 13-8. Стереоспецифичность дегидрогеназ, использующих NAD+ или NADP+ в качестве коферментов
Фермент |
Кофермент |
Стереохимическая специфичность к никотинамидному кольцу (А или Б) |
Страница (ы) в книге |
Изоцитратдегидрогеназа |
NAD+ |
А |
193 |
α-Кетоглутаратдегидрогеназа |
NAD+ |
Б |
194 |
Глюкозо-6-фосфатдегидрогеназа |
NADP+ |
Б |
109 |
Малатдегидрогеназа |
NAD+ |
А |
199 |
Глутаматдегидрогеназа |
NAD+ или NADP+ |
Б |
269 |
Глицеральдегид-3-фосфатдегидрогеназа |
NAD+ |
Б |
76 |
Лактатдегидрогеназа |
NAD+ |
А |
91 |
Алкогольдегидрогеназа |
NAD+ |
А |
93 |
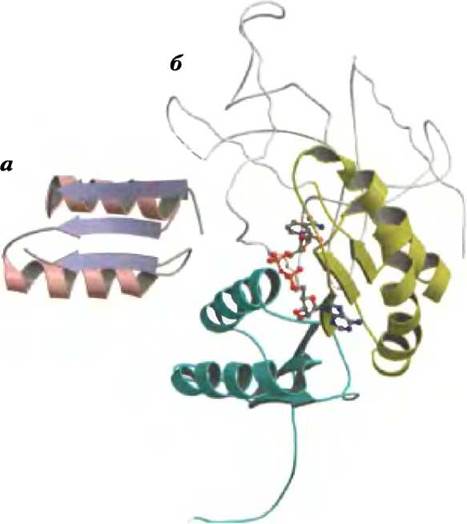
Большинство дегидрогеназ, которые используют NAD или NADP, связывают кофактор в консервативной области белка, которая называется укладка Россмана (Майкл Россман впервые установил структуру лактатдегидрогеназы и описал этот структурный фрагмент). Укладка Россмана, как правило, это шесть параллельных β-складок, объединенных с четырьмя α-спиралями (рис. 13-25).
Рис. 13-25. Укладка Россмана. Этот структурный мотив обнаружен в связывающем NAD участке многих дегидрогеназ. а — два близких по структуре мотива, у каждого по три параллельные β-складки и по две α-спирали (β-α-β-α-β). б — нуклеотидсвязывающий домен фермента лактатдегидрогеназы (PDB ID 3LDH) с NAD в развернутой конформации (шаростержневая модель) и с β-α-β-α-β-мотивом укладки Россмана (зеленый цвет разных оттенков); NAD связан посредством водородных связей и солевых мостиков.
Связь между дегидрогеназой и NAD или NADP относительно непрочная; кофермент спокойно диффундирует между ферментами, действуя в качестве водорастворимого переносчика электронов от одного метаболита к другому. Например, при образовании спирта в процессе брожения глюкозы в клетках дрожжей гидрид- ный ион отщепляется от глицеральдегид-3- фосфата одним ферментом (глицеральдегид-3- фосфатдегидрогеназой типа Б) и переносится на NAD+. Затем образованный NADH покидает поверхность фермента и диффундирует к другому ферменту (алкогольдегидрогеназе типа А), который переносит гидридный ион на ацетальдегид с образованием этанола:
(1) Глицеральдегид-3-фосфат + NAD+ —> 3-фосфоглицерат + NADH + Н+
(2) Ацетальдегид + NADH + Н+ —> этанол + NAD+
Итого: глицеральдегид-3-фосфат + ацетальдегид —> 3-фосфоглицерат + этанол
Обратите внимание, что в суммарной реакции не происходит образования или расходования NAD+ или NADH; коферменты действуют как катализаторы — они повторно высвобождаются и итоговая концентрация NAD+ + NADH не изменяется.
Дефицит в пище ниацина, витаминной формы NAD и NADP, вызывает пеллагру
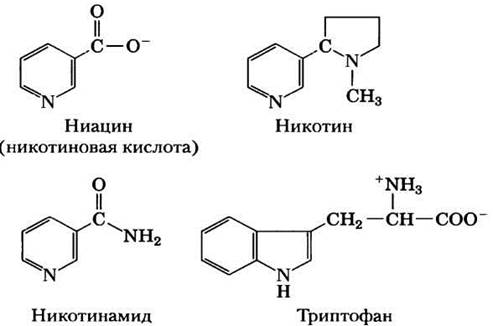
Как мы уже отмечали в гл. 6 и увидим в последующих главах, большинство коферментов — это производные витаминов. Пиридиноподобные кольца NAD и NADP образуются из витамина ниацина (никотиновой кислоты; рис. 13-26), который образуется из триптофана. У человека ниацин в необходимых количествах обычно не синтезируется; это главным образом относится к тем людям, кто потребляет пищу, содержащую мало триптофана (например, кукурузу — очень низкое содержание триптофана). Нехватка у человека ниацина сказывается на всех NAD(P)-зaвиcимыx дегидрогеназах и приводит к серьезной болезни пеллагре (итал. — «грубая кожа»; у собак болезнь называется «черным языком»). Болезнь характеризуется тремя симптомами: дерматит, диарея и дименция, причем во многих случаях приводит к летальному исходу. Столетие назад пеллагра была распространенной болезнью; в южных штатах США, где кукуруза служила основным продуктом питания населения, в период с 1912 по 1916 гг. было порядка 100 000 больных пеллагрой и умерло около 10 000. Джозеф Голдбергер в 1920 г. показал, что пеллагра вызывается недостатками рациона питания, а в 1937 г. Фрэнк Стронг, Д. Уэйн Вули и Конрад Эльвейем обнаружили, что эффективным средством от «черного языка» служит ниацин. Добавление в пищу этого недорогого соединения позволило справиться с пеллагрой в развитых странах. Однако важно отметить, что эта победа оказалась неабсолютной — пеллагра все еще встречается среди алкоголиков, у которых всасывание ниацина в кишечнике сильно ослаблено и чьи потребности в калориях зачастую удовлетворяются спиртными напитками, лишенными в сущности витаминов, включая и ниацин. В некоторых местностях, например, на Деканском плоскогорье в Индии, пеллагра все еще встречается, особенно среди бедных. ■
Рис. 13-26. Структуры ниацина (никотиновой кислоты) и его производного никотинамида. В природных биосистемах предшественником этих соединений является триптофан. В лаборатории никотиновая кислота впервые была получена окислением природного никотина — отсюда и название. Как никотиновая кислота, так и нико- тинамид лечат пеллагру, однако никотин (из сигарет) не обладает исцеляющей силой.

Флавиннуклеотиды прочно связываются с флавопротеинами
Флавопротеины (табл. 13-9) — это ферменты, которые катализируют окислительновосстановительные реакции, используя в качестве кофермента флавинмононуклеотид (FМN) или флавинадениндинуклеотид (FАD) (рис. 13-27). Коферменты флавиннуклеотиды образуются из витамина рибофлавина. Конденсированная многоядерная структура флавин-нуклеотидов (изоаллоксазиновое кольцо) подвергается обратимому восстановлению, получая от восстановленного субстрата либо один, либо два электрона в виде одного или двух атомов водорода (у атома водорода один электрон и один протон). Полностью восстановленные формы обозначаются FADH2 и FMNH2. Когда полностью окисленный флавиннуклеотид получает всего один электрон (один атом водорода), образуется семихинонная форма изоаллоксазинового кольца, обозначаемая FADH• и FMNH•. Поскольку функция флавиновых нуклеотидов несколько отличается от функции никотинамидных коферментов (участие в переносе одного или двух электронов), флавопротеины задействованы в более широком наборе реакций, чем NАD(Р)-связанные дегидрогеназы.
Таблица 13-9. Некоторые ферменты (флавопротеины), использующие флавиннуклеотидные коферменты
Фермент |
Флавин-нуклеотид |
Страница(ы) в книге |
Ацил-СоА- дегидрогеназа |
FAD |
рис. 17-8 |
Дигидролипоилдегидрогеназа |
FAD |
186 |
Сукцинатдегидрогеназа |
FAD |
198 |
Глицерол-3-фосфатдегидрогеназа |
FAD |
рис. 19-30 и текст |
Тиоредоксинредуктаза |
FAD |
рис. 22-39 и текст |
NADH-дегидрогеназа (комплекс I) |
FAD |
рис. 19-1 и текст |
Гликолатоксидаза |
FAD |
рис. 20-21 |
Рис. 13-27. Окисленные и восстановленные формы FAD и FMN. FMN включает ту часть структуры FAD (в окисленной форме), которая изображена выше пунктирной линии. Флавиннуклеотиды получают два атома водорода (два электрона и два протона), которые появляются во флавиновой кольцевой системе. Если FAD или FMN получают всего один атом водорода, образуется семихинон, стабильный радикал.
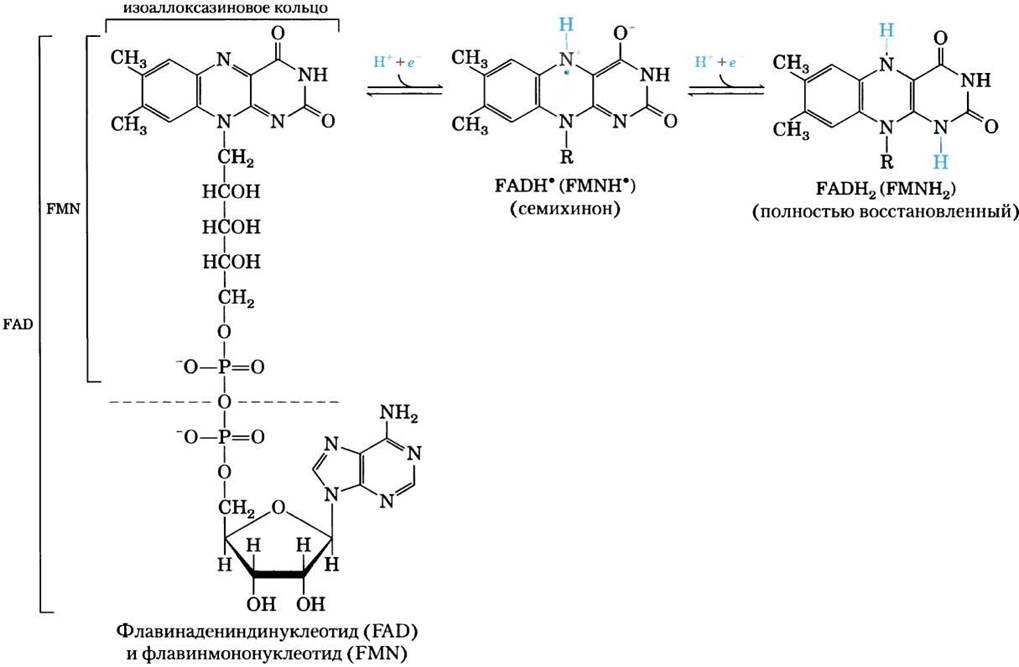
Как и у никотинамидных коферментов (рис. 13-24), у флавиннуклеотидов при восстановлении наблюдается сдвиг основной полосы поглощения. У полностью восстановленных флавопротеинов (получивших два электрона) максимум поглощения, как правило, лежит при 360 нм. У частично восстановленных флавопротеинов (получивших один электрон) появляется еще один максимум поглощения при 450 нм; полностью окисленная флавиновая система дает максимумы при 370 и 440 нм. Максимумы поглощения промежуточной радикальной формы, восстановленной одним электроном, лежат при 380, 480,580 и 625 нм. Эти спектральные особенности можно использовать при изучении реакций с участием флавопротеинов.
В большинстве флавопротеинов флавиннуклеотид довольно прочно связан с белком, а в некоторых ферментах, например, в сукцинатдегидрогеназе, он связан ковалентно. Такие прочно связанные коферменты называются простетическими группами. Они не переносят электроны, диффундируя от одного фермента к другому; напротив, они предоставляют средство, с помощью которого флавопротеин может временно удерживать электроны, пока он катализирует электронный перенос с восстановленного субстрата на акцептор электронов. Характерная особенность флавопротеинов состоит в том, что стандартный восстановительный потенциал (E′°) связанного флавин- нуклеотида может изменяться, что имеет очень важное значение. Из-за сильного взаимодействия между ферментом и простетической группой фла- виновое кольцо приобретает восстановительный потенциал, характерный для данного конкретного флавопротеина, который иногда значительно отличается от восстановительного потенциала свободного флавиннуклеотида. Например, у FAD, связанного с сукцинатдегидрогеназой, Е'° ≈ 0,0 В, а для свободного FAD Е’° = -0,219 В; для других флавопротеинов Е'° лежит в диапазоне от -0,40 В до +0,06 В. Флавопротеины — соединения очень сложного строения; некоторые из них наряду с флавиннуклеотидом несут еще прочно связанные неорганические ионы (например, содержат ионы железа или молибдена), способные участвовать в переносе электронов.
Некоторые флавопротеины выполняют совершенно неожиданные функции, действуя в качестве рецепторов света. Криптохромы представляют собой семейство флавопротеинов, широко распространенных в эукариотических организмах, которые опосредуют действие синего света на развитие растений и влияние света на циркадные ритмы млекопитающих (физиологические и биохимические колебания с 24-часовым периодом). Криптохромы являются гомологами другого семейства флавопротеинов — фотолиаз. Фотолиазы, обнаруженные как у прокариот, так и у эукариот, используют энергию поглощенного света для исправления химических дефектов в ДНК.
Действие флавопротеинов в качестве электронных переносчиков обсуждается в гл. 19 при рассмотрении их роли в окислительном фосфорилировании (в митохондриях) и в фотофосфорилировании (в хлоропластах), а в гл. 25 речь пойдет о фотолиазных реакциях.
Краткое содержание 13.4 Окислительно-восстановительные реакции в биологических системах
■ У многих организмов главный запасающий энергию процесс состоит в многостадийном окислении глюкозы до СO2, при котором часть энергии окисления сохраняется в виде АТР по мере того, как электроны переносятся на O2.
■ Биологические окислительно-восстановительные реакции можно представить в виде двух полуреакций, каждая из которых характеризуется стандартным восстановительным потенциалом Е’°.
■ При соединении двух электрохимических полуячеек, каждая из которых содержит компоненты полуреакции, электроны стремятся перейти в полуячейку с большим восстановительным потенциалом, что зависит от разности между двумя восстановительными потенциалами (∆Е) и является функцией концентраций окисленных и восстановленных форм.
■ Изменение стандартной свободной энергии окислительно-восстановительной реакции прямо пропорционально разности стандартных восстановительных потенциалов двух полуячеек: ∆G'° = -nFE'°.
■ Многие биологические реакции окисления — это реакции дегидрирования, в которых один или два атома водорода (Н+ + е-) переносятся с субстрата на акцептор водорода. Окислительно-восстановительные реакции в живых клетках происходят при участии специальных переносчиков электронов.
■ NAD и NADP — свободно диффундирующие коферменты многих дегидрогеназ. Как NAD+, так и NADP+ получают два электрона и один протон.
■ Флавиннуклеотиды FAD и FMN выступают в роли прочно связанных простетических групп флавопротеинов. Они способны получать либо один, либо два электрона и один или два протона. Флавопротеины служат также в качестве рецепторов света в криптохромах и фотолиазах.