ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
Время проходит быстро, когда нет причин для грусти. Увидев, что человек, который чуть не умер от болезни, при изменившихся обстоятельствах идет на поправку и явно хорошо себя чувствует, испытываешь радостный подъем настроения... и это состояние нельзя выразить словами. А Нобелевская премия - это только глазурь на торте.
Гертруда Элайон, Science, 2002
22. БИОСИНТЕЗ АМИНОКИСЛОТ, НУКЛЕОТИДОВ И РОДСТВЕННЫХ СОЕДИНЕНИЙ
В живой природе азот занимает четвертое место по массе после углерода, водорода и кислорода. Основные количества азота находятся в связанном виде и входят в состав аминокислот и нуклеотидов. В этой главе рассматриваются все аспекты метаболизма азотсодержащих соединений, кроме катаболизма аминокислот, которому посвящена гл. 18.
Пути биосинтеза аминокислот и нуклеотидов рассматривают, как правило, вместе, не только потому, что оба класса соединений содержат азот (поступающий из одного и того же биологического источника), но и потому, что два этих пути имеют много точек пересечения, включая несколько общих ключевых промежуточных стадий. Некоторые аминокислоты или части их молекул входят в состав пуринов и пиримидинов, а в одной аминокислоте — гистидине — имеется пуриновое кольцо. У этих двух синтетических путей много общего и с чисто химической точки зрения, в частности там преобладают реакции, включающие перенос азота и одноуглеродных групп.
Студенту, только приступающему к изучению биохимии, описываемые в этой главе, пути могут показаться сложными. Однако сложность обусловлена не столько химией как таковой — химизм реакций, как правило, понятен, удручающее действует большое число стадий и разнообразие интермедиатов. Изучать эти метаболические пути лучше всего с учетом уже рассмотренных нами ранее принципов метаболизма, ключевых интермедиатов и предшественников, общих типов реакций. Стоит бросить хотя бы беглый взгляд на эти пути и станет ясно, что именно в биологических системах происходят самые необычные химические превращения, например, редкие для живых существ реакции с участием металлов молибдена, селена и ванадия. Ваши усилия окупятся, в особенности если вы студент-медик или ветеринар, ведь многие наследственные болезни человека и животных обусловлены отсутствием одного или нескольких ферментов метаболизма аминокислот и/или нуклеотидов, а многие лекарства, применяемые в борьбе с инфекциями, являются ингибиторами ферментов этих путей, как и целый ряд противоопухолевых химиотерапевтических препаратов.
Регуляция биосинтеза азотсодержащих соединений жизненно важна. Но так как нуклеотиды и аминокислоты требуются в относительно небольших количествах, производительность большинства этих реакций далеко не так высока, как реакций синтеза жиров и углеводов в тканях животныхВ то же время для синтеза белков и нуклеиновых кислот разные аминокислоты и нуклеотиды необходимы в правильном соотношении и в определенный момент, поэтому точная и координированная регуляция всех процессов их биосинтеза имеет важное значение. А так, как и белки, и аминокислоты обычно ионизованы, т. е. могут нести заряд, при регуляции их уровня (содержания) в клетке должен поддерживаться также электрохимический баланс. Как обсуждалось в предыдущих главах, контроль метаболических путей может осуществляться либо через изменение ферментативной активности, либо через количества специфических ферментов. Метаболические пути, обсуждаемые в этой главе, предоставляют нам самые нетрудные для понимания примеры регуляции ферментативной активности. Количественный контроль разных ферментов в клетке (т. е. соотношения между продуктивностью реакций синтеза и распада) описан в гл. 28 (т. 3).
22.1. Общий обзор метаболизма азота
Азот необходим для синтеза и аминокислот, и нуклеотидов. В окружающей среде растворимые соединения, содержащие азот в биологически доступной форме, присутствуют в очень ограниченном количестве, поэтому большинство организмов существуют в режиме строгой экономии аммиака, аминокислот и нуклеотидов. Действительно, как мы увидим далее, свободные аминокислоты, пурины и пиримидины, образующиеся в результате химических превращений белков и нуклеиновых кислот, часто используются вновь и вновь, т. е. клетки функционируют, усваивая и высвобождая необходимые им вещества циклически. Сначала мы рассмотрим пути, по которым азот из окружающей среды включается в биологические системы.
В круговороте азота поддерживается пул биологически доступного азота
Воздух, наиболее важный источник азота, на 4/5 состоит из молекулярного азота (N2). Тем не менее число биологических видов, способных превращать атмосферный азот в соединения, доступные для живых организмов, крайне мало. В биосфере метаболические процессы разных видов взаимосвязаны, что позволяет получать и повторно использовать азот в природном цикле (круговороте) азота (рис. 22-1). Первый стадия этого цикла — фиксация (восстановление) атмосферного азота азотфиксирующими бактериями с образованием аммиака или ионов аммония (ТН3 или NН+4). Аммиак может использоваться многими живыми организмами, однако установлено, что почвенные бактерии, получающие энергию при окислении аммиака до нитритов (NO2-) и далее до нитратов (NO3-), так широко распространены и так активны, что почти весь попадающий в почву аммиак окисляется до нитратов. Этот процесс называется нитрификацией. Растения и многие бактерии могут захватывать и быстро восстанавливать нитриты и нитраты под действием нитрит- и нитратредуктаз. Полученный таким образом аммиак включается в состав аминокислот в растениях. Затем животные используют растения в пищу как источник аминокислот, заменимых и незаменимых, для синтеза собственных белков. Когда организм погибает, белки разрушаются до аммиака под действием микроорганизмов почвы, где нитрифицирующие бактерии снова превращают его в нитриты и нитраты. Баланс между фиксированным и атмосферным азотом поддерживается бактериями, которые в анаэробных условиях превращают нитрат в N2; этот процесс называется денитрификацией (рис. 22-1). Почвенные бактерии используют в качестве конечного акцептора электронов NO3- вместо O2 в целом ряде реакций (таких как окислительное фосфорилирование), создающих трансмембранный градиент протонов, который используется для синтеза АТР.
Рис 22-1. Цикл азота. Общее количество азота, ежегодно фиксируемое в биосфере, превышает 1011 кг. Реакции, выделенные красными стрелками, происходят почти исключительно в анаэробных условиях. Степень окисления соединений азота показана на шкале в нижней части рисунка.
Недавно были открыты бактерии, способные осуществлять окисление аммиака в анаэробных условиях (рис. 22-1); этот процесс получил название анаммокс (англ. аnаmmох, anaerobic ammonia oxidation) — происходит превращение аммиака и нитрита в N2. В биосфере превращение NH3 в N2 на 50-70% происходит именно по этому метаболическому пути, открытому лишь в 1980-х гг. Облигатные анаэробы, осуществляющие анаммокс, интересны сами по себе и, кроме того, позволяют решить некоторые проблемы, связанные с очисткой сточных вод (доп. 22-1).
А теперь давайте рассмотрим первую стадию в цикле азота — фиксацию атмосферного азота.
Дополнение 22-1. Необычный стиль жизни многочисленных, но загадочных существ
Мы дышим воздухом и легко можем не заметить бактерий и архей в анаэробных средах обитания. В учебниках биохимии, излагающих начальный курс (введение), эти организмы обсуждаются редко, однако они составляют значительную долю биомассы нашей планеты и вносят существенный вклад в баланс углерода и азота в биосфере, важный для всех других живых форм.
Как подробно обсуждалось в предыдущих главах, энергия, необходимая для существования живых организмов, связана с созданием градиента ионов водорода на мембранах. Электроны от восстановленного субстрата доставляются к переносчикам электронов в мембранах и после серии переходов попадают к конечному акцептору электронов. В результате этого на одной стороне мембраны накапливаются протоны — возникает протонный градиент. Этот градиент используется для синтеза АТР или для осуществления других энергозатратных процессов в клетке. У всех эукариот восстановленным субстратом обычно являются углеводы (глюкоза или пируват), а в роли акцептора электронов выступает кислород.
Метаболизм бактерий и архей гораздо более гибкий. В анаэробных условиях, например, в донных отложениях морей и пресноводных водоемов, разнообразие жизненных стратегий весьма велико. Практически любая окислительно-восстановительная пара может служить источником энергии для специализированного организма или группы организмов. У многих литотрофных бактерий (у хемотрофов, использующих в качестве источника энергии неорганические вещества; см. рис. 1-5, т. 1) имеется фермент гидрогеназа, который использует молекулярный водород для восстановления NAD:
![]()
NADH служит источником электронов для многих связанных с мембраной акцепторов электронов; при переносе электронов создается градиент протонов, необходимый для синтеза АТР. Другие литотрофы способны окислять соединения серы (H2S, элементную серу или тиосульфаты) или соединения двухвалентного железа. В широко распространенную группу архей, называемых метаногенами, входят строгие анаэробы, способные получать энергию в результате восстановления СO2 до метана. И это лишь некоторые примеры того, как анаэробные организмы умеют приспосабливаться к условиям окружающей среды. Их метаболические процессы включают множество интереснейших реакций и протекают с участием специализированных кофакторов, не встречающихся в мире облигатных аэробных организмов. Использование некоторых анаэробных бактерий может принести ощутимую практическую пользу. Кроме того, изучение таких организмов помогает отыскать ответы на вопросы о происхождении жизни на Земле в тех условиях, когда молекулярного кислорода еще не было.
Цикл азота связан с деятельностью целого ряда специализированных бактерий. Выделяют две группы нитрифицирующих бактерий: бактерии, которые окисляют аммиак до нитритов, и бактерии, которые окисляют образующиеся нитриты до нитратов (рис. 22-1). Нитрат — второй после кислорода биологический акцептор электронов; многие бактерии и археи могут катализировать денитрификацию нитратов до азота, который азотфиксирующие бактерии затем вновь превращают в аммиак. Аммиак — главное загрязняющее вещество в составе сточных вод и отходов животноводческих ферм; он также является побочным продуктом при производстве удобрений и при переработке нефти. На водоочистных предприятиях для превращения аммиака сточных вод в атмосферный азот «работают» сообщества нитрифицирующих и денитрифицирующих бактерий. В этом процессе расходуются кислород и органические соединения.
В 1960-1970-х гг. в научных журналах появилось несколько публикаций, где выдвигалась версия, что аммоний может окисляться до азота в анаэробных условиях при использовании нитрита в качестве акцептора электронов; этот процесс получил название анаммокс. Данные сообщения не привлекали внимания до тех пор, пока в середине 1980-х гг. на водоочистном сооружении в Делфте (Нидерланды) не были обнаружены бактерии, осуществляющие этот процесс. Группа голландских микробиологов под руководством Гижса Куенена и Майка Жеттена взялась исследовать эти бактерии. Вскоре оказалось, что это редкий тип бактерий планктомицетов. Далее ученых ждало еще несколько сюрпризов.
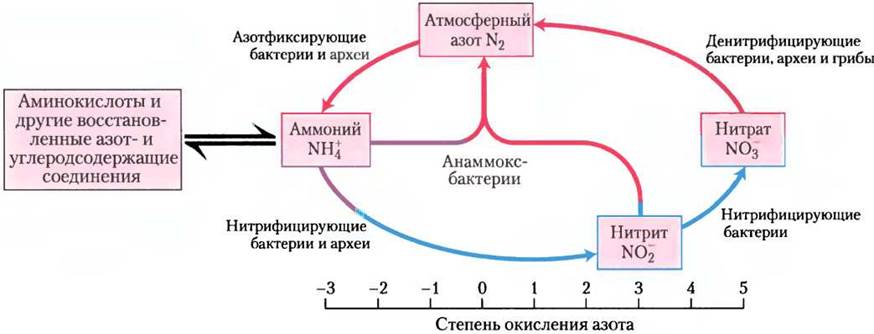
Постепенно прояснялись биохимические механизмы, лежащие в основе процесса анаммокс (рис. 1). Неожиданно выяснилось, что промежуточным продуктом реакций является гидразин (N2Н4) — активное химическое соединение, которое используют даже в составе ракетного топлива. Молекулы этого вещества, имеющие небольшой размер, очень токсичны и легко проникают через фосфолипидные мембраны. Бактерии, осуществляющие анаммокс, решают эту проблему, заключая гидразин в специализированные органеллы анаммоксосомы. Мембраны этих органелл образованы особыми липидами ладдеранами (рис. 2), которые ранее не были обнаружены в биологических системах. Соединенные между собой циклобутановые кольца, формирующие структуру ладдеранов, прижаты друг к другу, образуя очень плотный барьер, значительно замедляющий диффузию гидразина. Кольца циклобутана имеют напряженную структуру, и их достаточно сложно синтезировать. До сих пор механизмы синтеза этих липидов в бактериях остаются загадкой.
Рис. 1. Реакции процесса анаммокс. Аммиак и гидроксид аммония превращаются в гидразин и Н2O под действием гидразингидролазы, а затем гидразин окисляется гидразиноксидоредуктазой с образованием N2 и протонов. Возникает градиент протонов для синтеза АТР. На внешней стороне анаммоксосомы протоны используются нитритредуктазой, образующей оксид азота и завершающей весь цикл. Все участвующие в этом процессе ферменты окружены мембраной анаммоксосомы.
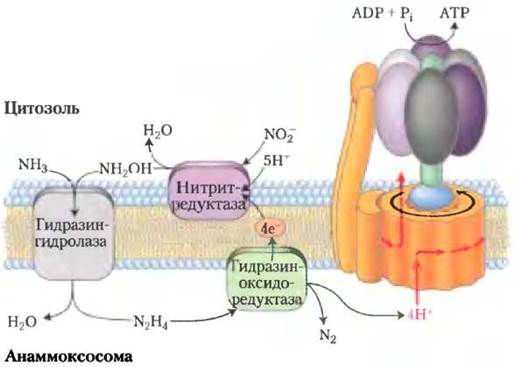
Рис. 2. а — ладдераны в мембране анаммоксосомы. Механизм синтеза нестабильной структуры, состоящей из конденсированных колец циклобутана, пока остается неизвестным. б — ладдераны укладываются в очень плотную, непроницаемую гидрофобную мембранную структуру, что позволяет ограничивать диффузию гидразина, образующегося в процессе анаммокса.
Открытие анаммоксосом было неожиданным. Обычно в бактериальных клетках нет особых отделов, а наличие заключенного в оболочку ядра часто называют первым отличием эукариот от бактерий. Уже само открытие таких органелл представляло большой научный интерес, однако планктомицеты, кроме того, имеют и ядро: их хромосомная ДНК заключена в оболочку (рис. 3). Обнаружение подобной субклеточной организации стимулировало дальнейшие исследования с целью выяснения происхождения планктомицетов и эволюции эукариотического ядра. Планктомицеты — древняя бактериальная ветвь, содержащая множество родов; известно, что бактерии трех родов планктомицетов осуществляют анаммокс. Более детальное изучение этих бактерий, возможно, позволит нам ближе подойти к разгадке основного вопроса эволюционной биологии, а именно, к обнаружению организма, последнего универсального предшественника всех живых организмов на нашей планете (его сокращенно называют LUCA — lastuniversal common ancestor).
Рис. 3. Изображение поперечного среза клеток Gemmata obscuriglobus, полученное с помощью трансмиссионного электронного микроскопа (ТЭМ), позволяет увидеть ДНК в ядре (Я), заключенном в ядерную оболочку (ЯO). Бактерии рода Gemmata (планктомицеты) не способны осуществлять анаммокс.
В настоящий момент бактерии, осуществляющие анаммокс, активно применяются при очистке сточных вод. Это позволяет на 90% снизить расходы на удаление аммиака (обычная стадия денитрификации полностью исключается, а расходы на аэрацию и нитрификацию снижаются) и уменьшить выход побочных продуктов. Понятно, что подробно узнать о населяющих биосферу бактериях очень полезно человеку XXI в.
Азот фиксируется ферментным комплексом нитрогеназой
Только некоторые бактерии и археи могут фиксировать атмосферный азот. К ним относятся почвенные, пресноводные и морские цианобактерии и другие виды свободноживущих почвенных бактерий, такие как р. Azotobacter, и азотофиксирующие бактерии-симбионты бобовых растений, которые обитают в клубеньках на их корнях. Первый важный продукт в цепи фиксации азота — аммиак, который может быть использован всеми организмами либо непосредственно, либо после его превращения в другие растворимые соединения, такие как нитриты, нитраты или аминокислоты. Восстановление азота до аммиака сопровождается выделением энергии:
N2+3 Н2 —> 2 NH3 ∆G'° = -33,5 кДж/моль
Но тройная связь N=N очень прочная, энергия этой связи 930 кДж/моль. Таким образом, фиксация азота — процесс, требующий очень высокой энергии активации, и в обычных условиях атмосферный азот — инертное вещество. В промышленности аммиак получают по методу Габера (названного в честь его изобретателя Фрица Габера) из смеси азота и водорода при нагревании до 400-500 °С и высоком давлении до десятков тысяч килопаскалей (нескольких сот атмосфер), чтобы обеспечить необходимую энергию активации. Биологическая фиксация азота, однако, должна протекать при биологических температурах и 0,8 атм азота. Здесь высокий барьер активации преодолевается другими способами. Это достигается, по крайней мере частично, путем связывания и гидролиза АТР. В общем виде реакция может быть записана так:
N2+ 10 Н+ + 8 е- + 16 АТР —> 2 NH4+ 16 ADP + 16 Pi + Н2
Биологическая фиксация азота обеспечивается высококонсервативным комплексом белков, называемым нитрогеназным комплексом (или просто нитрогеназой) (рис. 22-2), наиболее важные компоненты которого — редуктаза динитрогеназы и динитрогеназа (рис. 22-3). Редуктаза динитрогеназы (Мr = 60 000) представляет собой димер из двух одинаковых субъединиц. В нем один находящийся между субъединицами активный окислительно-восстановительный центр 4Fe-4S (см. рис. 19-5), который может быть окислен или восстановлен одним электроном. Комплекс также имеет два центра связывания (один в каждой субъединице) ATP/ADP. Динитрогеназа (Мr = 240 000) — тетрамер, состоящий из субъединиц двух типов, по две субъединице каждого типа, и содержащий железо, и молибден.
Рис. 22-2. Фиксация азота нитрогеназным комплексом. Электроны с пирувата переносятся на динитрогеназу через ферредоксин (или флаводоксин) и редуктазу динитрогеназы. Редуктаза динитрогеназы восстанавливает динитрогеназу путем переноса одного электрона за один реакционный акт, в то время как для фиксации одной молекулы N2требуются по крайней мере шесть электронов. Кроме того, два электрона необходимы для восстановления двух протонов Н+ до Н2 в процессе, который обязательно сопровождает фиксацию азота анаэробами. Таким образом, на фиксацию одной молекулы N2тратится восемь электронов. Строение субъединиц и металлсодержащих кофакторов редуктазы динитрогеназы и белков динитрогеназы описаны в тексте и на рис. 22-3.
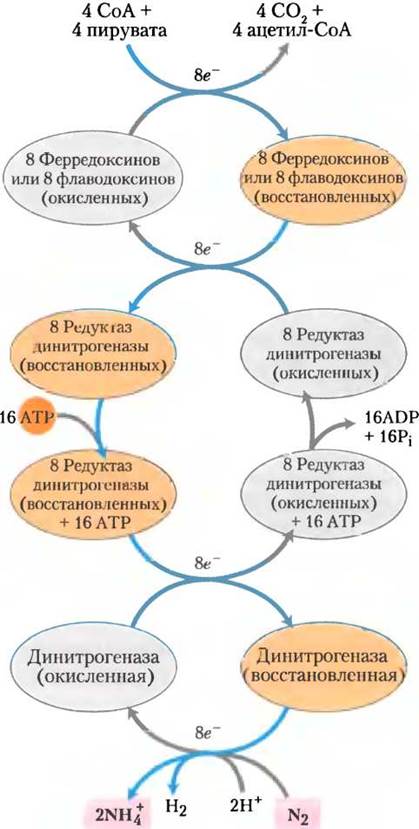
Рис. 22-3. Ферменты и кофакторы нитрогеназного комплекса (PDB ID 1N2C). а — субъединицы динитрогеназы показаны серым и розовым, а редуктазы динитрогеназы — синим и зеленым. Связанная молекула ADP окрашена красным. Обратите внимание на комплекс 4Fe-4S (атомы Fe выделены оранжевым цветом, S — желтым) и железо-молибденовый кофактор (Мо — черный, гомоцитрат — светло-серый). Показаны также P-кластеры (близкорасположенные пары комплексов 4Fe-4S). б — кофакторы комплекса динитрогеназы без белка (цвета такие же, как в а), в — железо-молибденовый кофактор содержит один атом Мо (черный), семь атомов Fe (оранжевые), девять атомов S(желтые) и молекулу гомоцитрата (серая).
Активный центр тетрамера в сумме несет два атома Мо, 32 атома Fe и 30 атомов S. Около половины атомов железа и серы находятся в составе P-кластеров, в каждом из которых два близкорасположенных 4Fe-4S-центpa; оставшиеся атомы Mo, Fe и S входят в состав не совсем обычного железо-молибденового кофактора. Была открыта форма нитрогеназы, содержащая вместо молибдена ванадий, а некоторые виды бактерий могут использовать оба типа нитрогеназ. При определенных условиях ванадийсодержащие формы могут выступать главными первичными азотфиксирующими системами, но они еще не так хорошо изучены, как молибденсодержащие.
Фиксация азота производится полностью восстановленной формой динитрогеназы и требует восемь электронов: шесть на восстановление N2, два на получение одной молекулы Н2 — обязательного компонента в механизме этой реакции. Восстановление динитрогеназы происходит путем переноса электронов с редуктазы динитрогеназы (рис. 22-2). В тетрамере динитрогеназы имеются два центра связывания редуктазы. Необходимые для реакции электроны переносятся с редуктазы на динитрогеназу по одному: восстановленная молекула редуктазы связывается с динитрогеназой и переносит один электрон, затем окисленная редуктаза диссоциирует с молекулы динитрогеназы, и цикл повторяется. Прохождение каждого цикла требует гидролиза двух молекул АТР на димер редуктазы. Источник электронов для восстановления редуктазы динитрогеназы может варьировать и представлять собой восстановленный ферредоксин (с. 371, см. также рис. 19-5), восстановленный флаводоксин и, возможно, другие источники. По крайней мере у одного вида конечным источником электронов для восстановления ферредоксина служит пируват (рис. 22-2).
Роль АТР в этом процессе несколько необычна. Как будет видно далее, АТР может быть источником химической энергии не только за счет гидролиза одной или более фосфодиэфирных связей, но и за счет энергии связи (с. 227, 425, т. 1) при нековалентных взаимодействиях, которые понижают энергию активации. В реакции, протекающей под действием редуктазы динитрогеназы, и связывание, и гидролиз АТР вызывают конформационные изменения, помогающие преодолеть высокую энергию активации реакции фиксации азота. Связывание двух молекул АТР редуктазой изменяет восстановительной потенциал (Е°′) этого белка с -300 до -420 мВ, что вызывает повышение восстановительной способности, достаточное для переноса электронов на динитрогеназу. Затем непосредственно перед переносом одного электрона на динитрогеназу происходит гидролиз молекул АТР.
Другим важным свойством нитрогеназного комплекса является его исключительная неустойчивость в присутствии кислорода. Редуктаза инактивируется на воздухе, ее время полужизни 30 с, время полужизни динитрогеназы на воздухе 10 мин. Свободноживущие бактерии, фиксирующие азот, справляются с этой проблемой разными способами. Одни живут только в анаэробных условиях или выключают синтез нитрогеназы в присутствии кислорода. Некоторые аэробы, такие как Azotobacter vinelandii, частично разобщают транспорт электронов и синтез АТР, так что кислород «сжигается» сразу же, как поступает в клетку (см. доп. 19-1). Чтобы защитить себя от кислорода, в культурах таких бактерий во время фиксации азота температура действительно повышается.
Симбиоз между бобовыми растениями и клубеньковыми азотфиксирующими бактериями (рис. 22-4) учитывает и потребность в энергии, и кислородную уязвимость нитрогеназно- го комплекса. Затраты энергии на фиксацию азота, возможно, были движущей силой в эволюции этой связи бактерий с растением. Живущие в корневых клубеньках бактерии получили доступ к обширному резервуару энергии в виде изобилия углеводов и промежуточных продуктов цикла лимонной кислоты, производимых растением. Это позволяет бактериям фиксировать в сотни раз больше азота, чем их свободноживущие сородичи могут позволить себе в условиях жизни в почве. Чтобы решить проблему токсичности кислорода, клубеньковые бактерии «купаются» в растворе связывающего кислород гемсодержащего белка леггемоглобина, производимого растением (хотя в ряде случаев гем могут синтезировать бактерии). Леггемоглобин связывает весь кислород, поэтому он не может повлиять на фиксацию азота, и эффективно доставляет кислород к бактериальной системе переноса электронов. Выгода для растения — обеспечение его восстановленным легкоусвояемым азотом. Полезный результат симбиоза между растениями и бактериями, очевидно, состоит в обогащении почвы азотом, которое осуществляют бобовые растения. Это и положено в основу методов севооборота, когда после небобовых культур (например, кукурузы), которые забирают восстановленный азот из почвы, через несколько лет поля засевают бобовыми — люцерной, горохом или клевером.
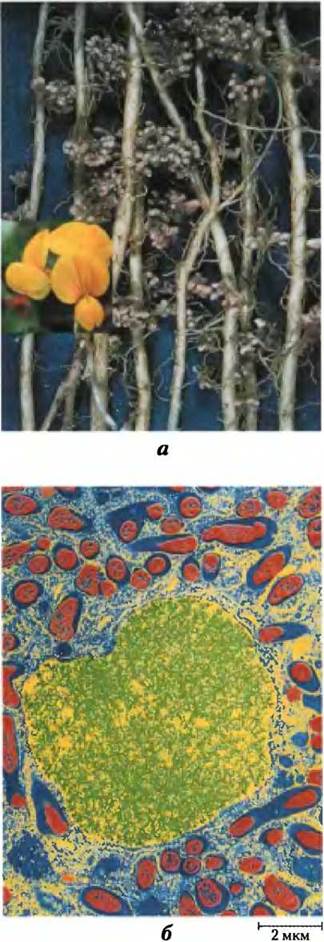
Рис. 22-4. Азотфиксирующие клубеньки, а — корневые клубеньки лядвенца рогатого, семейство бобовые. Цветки этого растения показаны на врезке. б — проявленная (раскрашенная) электронная микрофотография тонкого среза клубенька гороха. Симбиотические азотфиксирующие бактерии, или бактероиды (показаны красным), живут внутри клеток клубенька, окруженные перибактероидной мембраной (синий цвет). Бактероиды синтезируют нитрогеназный комплекс, который превращает атмосферный азот (N2) в аммоний (NH4+); без бактероидов растения не способны фиксировать N2. Клетки корня, содержащие бактерии, обладают некоторыми важными свойствами, необходимыми для фиксации азота, в частности они образуют леггемоглобин; этот гемсодержащий белок обладает высоким сродством к кислороду, который ингибирует нитрогеназу. (Ядра клеток показаны желтым/зеленым. Другие органеллы клеток корня, обычно присутствующие в клетках растений, не видны.)
Из-за огромного практического значения фиксация азота интенсивно изучается. Промышленное производство аммиака (аммония) с целью использования его в качестве удобрения — очень энергозатратный процесс, а поэтому дорогой. В настоящее время очень много усилий направлено на создание рекомбинантных или трансгенных организмов, способных фиксировать азот. Технологии рекомбинантных ДНК (см. гл. 9, т. 1) используются для переноса генов, которые кодируют ферменты, обеспечивающие фиксацию азота, в неазотфик- сирующие бактерии и растения. Успех в этом направлении зависит от решения проблемы токсичности кислорода для любой клетки, производящей нитрогеназу.
Аммоний включается в биомолекулы через глутаминовую кислоту (глутамат) и глутамин
Восстановленный азот в виде NH+4 включается в аминокислоты, а затем в другие азотсодержащие биомолекулы. Эту ключевую точку фиксации азота обеспечивают две аминокислоты — глутаминовая кислота и глутамин. Вспомним, что эти две аминокислоты играют центральную роль в катаболизме аммиака и аминогрупп при окислении аминокислот (см. гл. 18). Глутаминовая кислота служит донором аминогруппы для большинства других аминокислот посредством реакций трансаминирования (обратную реакцию см. на рис. 18-4). Азот амидной группы в составе молекулы глутаминовой кислоты служит источником аминогруппы в целом ряде процессов биосинтеза. У высших организмов во многих клетках и во внеклеточной жидкости одна-две эти аминокислоты присутствуют в большей концентрации, чем остальные аминокислоты, иногда на порядок и более. Клеткам Escherichia coli требуется так много глутаминовой кислоты, что она является одним из основных веществ, растворенных в цитозоле. Ее концентрация регулируется не только в соответствии с потребностью клетки в азоте, но и для поддержания осмотического равновесия между цитозолем и окружающей средой.
Пути биосинтеза глутаминовой кислоты и глутамина простые, все или хотя бы некоторые их стадии обнаружены у всех организмов. Наиболее важный путь включения аммиака в глутаминовую кислоту требует протекания двух реакций. Во- первых, глутаминсинтетаза катализирует реакцию между глутаматом и NH4+ с образованием глутамина. Эта реакция протекает в две стадии с образованием промежуточной связанной с ферментом формы y-глутамилфосфата (см. рис. 18-8):
(1) Глутамат + АТР —> y-глутамилфосфат + ADP
(2) y-Глутамилфосфат + NH4+ —> глутамин + Pi + H+
Суммарное уравнение:
глутамат + NH4+ + АТР —> глутамин + Pi +Н+ (22-1)
Глутаминсинтетаза обнаружена у всех организмов. Помимо важной роли для ассимиляции NH4+ у бактерий, этот фермент играет центральную роль в метаболизме аминокислот у млекопитающих, превращая токсичный аммиак в глутамин, который поступает в кровоток (гл. 18).
У бактерий и растений глутамат получается из глутамина в реакции, катализируемой глутаматсинтазой. α-Кетоглутарат, промежуточный продукт цикла лимонной кислоты, подвергается восстановительному аминированию с глутамином в качестве донора азота:
α-Кетоглутарат + глутамин + NАDРН + Н+ —> 2 глутамат + NАDР+ (22-2)
Суммарная реакция, осуществляемая глутаминсинтетазой и глутаматсинтазой (уравнения 22-1 и 22-2):
α-Кетоглутарат + NH4+ NADPH + АТР —> L-глутамат + NADP+ + ADP + Pi
Глутаматсинтаза отсутствует у животных, которые поддерживают высокий уровень глутамата за счет таких процессов, как трансаминирование α-кетоглутарата при катаболизме аминокислот.
Глутамат может быть получен и в результате другого, не так часто используемого пути: по реакции между α-кетоглутаратом и NH4+, протекающей в одну стадию. Она катализируется L-глутаматдегидрогеназой — ферментом, который есть у всех организмов. Восстановительный потенциал обеспечивает NADPH:
α-Кетоглутарат + NH4+ + NADPH —> L-глутамат + NADP++ Н2O
Мы рассматривали эту реакцию в разделе, посвященном катаболизму аминокислот (см. рис. 18-7). В эукариотических клетках L-глутаматдегидрогеназа локализована в митохондриальном матриксе. Равновесие реакции сдвинуто в сторону реагентов, а для NН+4] константа Михаэлиса Км такая высокая (~1 мМ), что, вероятно, эта реакция вносит очень скромный вклад во включение NН+4] в аминокислоты и другие метаболиты. (Вспомним (см. рис. 18-10), что реакция, протекающая под действием глутаматдегидрогеназы, напротив, обеспечивает аммонием цикл мочевины.) Достаточно высокие концентрации NН+4] с тем, чтобы реакция глутаматдегидрогеназы вносила существенный вклад в уровень глутамата, обычно наблюдаются, когда в почву добавлен NН3 или организмы растут в лаборатории в присутствии высоких концентраций аммиака. В общем, у почвенных бактерий и растений преобладает двухферментный путь, рассмотренный выше (уравнения 22-1,22-2).
Глутаминсинтетаза — основной регуляторный пункт в метаболизме азота
Активность глутаминсинтетазы регулируется практически у всех организмов, что неудивительно, учитывая ключевую метаболическую роль катализа первой реакции в пути включения азота в биологические соединения. У кишечных бактерий, таких как Е. соli, регуляция необычайно сложная. Фермент состоит из 12 одинаковых
субъединиц с Мr = 50 000 (рис. 22-5) и регулируется как аллостерически, так и путем ковалентных модификаций. Аланин, глицин и, по крайней мере, еще шесть конечных продуктов метаболизма глутамина являются аллостерическими ингибиторами этого фермента (рис. 22-6). Каждый ингибитор в отдельности способен только к частичному ингибированию, зато несколько ингибиторов оказывают на активность фермента больше, чем просто суммарный эффект, а все восемь вместе они практически полностью выключают синтетазу. Этот контрольный механизм обеспечивает постоянную регулировку уровня глутамина для того, чтобы он соответствовал актуальным требованиям метаболизма.
Рис. 22-5. Структура субъединиц глутаминсинтетазы по данным рентгеноструктурного анализа (РDВ Ю1D GLS). a — вид сбоку; все 12 субъединиц идентичны; они окрашены в разные цвета для того, чтобы продемонстрировать упаковку и расположение, б — вид сверху; активные центры показаны зеленым.
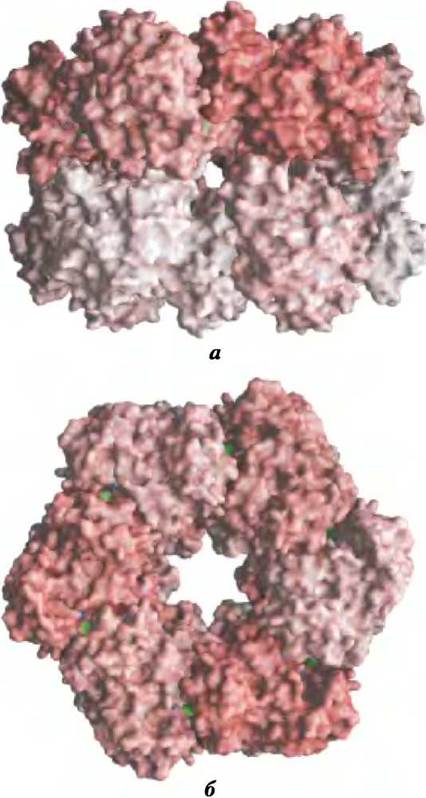
Рис. 22-6. Аллостерическая регуляция глутаминсинтетазы. Фермент кумулятивно регулируется шестью конечными продуктами метаболизма глутамина. Аланин и глицин, возможно, служат индикаторами общего статуса метаболизма аминокислот в клетке.
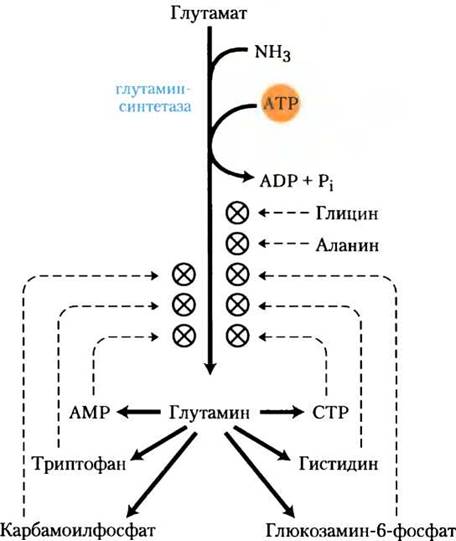
На аллостерическую регуляцию накладывается ингибирование аденилированием (присоединением АМР) по Туr397, расположенному рядом с активным центром фермента (рис. 22-7). Эта ковалентная модификация повышает чувствительность к аллостерическим ингибиторам, и ферментативная активность снижается пропорционально количеству аденилированных субъединиц. И аденилирование, и деаденилирование осуществляются аденилилтрансферазой (АТ на рис. 22-7), которая является частью сложного ферментного каскада, ответственного за уровень глутамина, α-кетоглутарата, АТР и Pi. Активность аденилилтрансферазы модулируется связыванием регуляторного белка РII, а его активность в свою очередь регулируется путем ковалентной модификации (уридилирования) тоже по тирозиновому остатку. Комплекс аденилилтрансферазы с уридинилированным РII (РII-UMР) стимулирует деаденилирование, тогда как тот же комплекс с деуридинилированным РII стимулирует аденилирование глутаминсинтетазы. И уридилирование, и деуридилирование РII осуществляется одним ферментом — уридилилтрансферазой. Уридилирование ингибируется связыванием глутамина и Pi с уридилилтрансферазой, а стимулируется присоединением α-кетоглутарата и АТР к РII.
Рис. 22-7. Второй уровень регуляции глутаминсинтетазы: ковалентные модификации. а — аденилированный остаток тирозина, б — каскад, ведущий к аденилированию (инактивации) глутаминсинтетазы. АТ — аденилилтрансфераза; UT — уридилилтрансфераза. Детали каскада описаны в тексте.
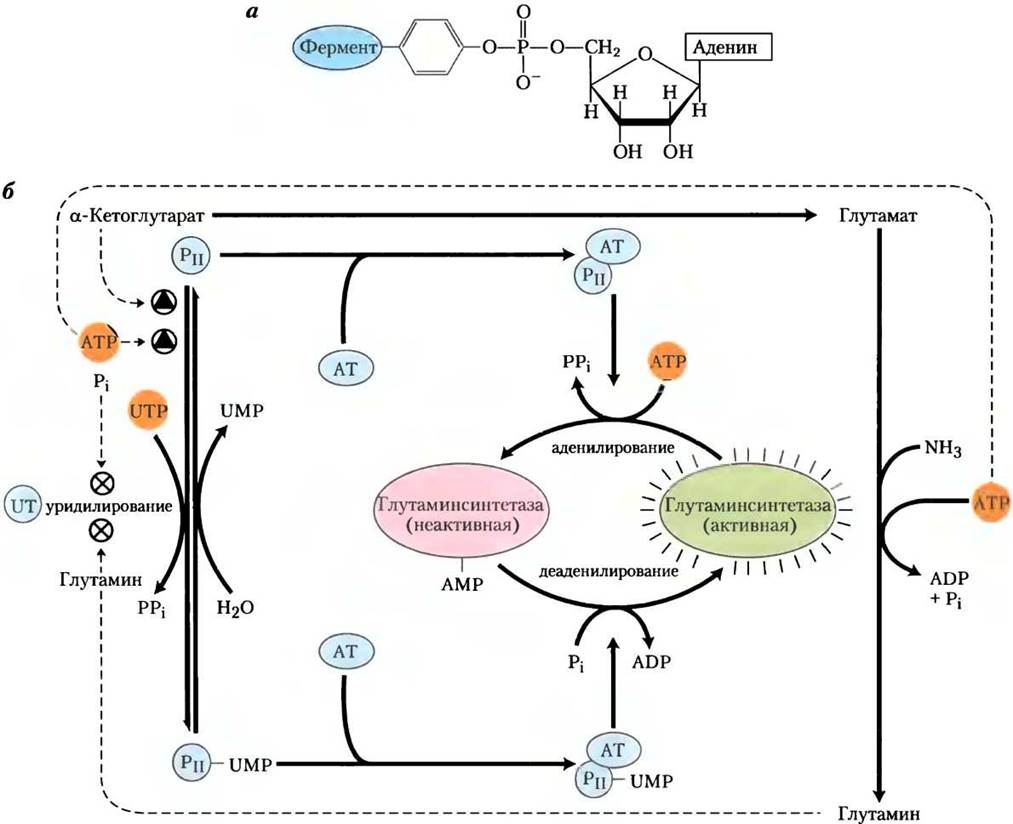
Но регуляция этим не ограничивается. Уридилированный РII также опосредует активацию транскрипции гена глутаминсинтетазы, увеличивая таким образом концентрацию фермента. Деуридилированный РII вызывает снижение транскрипции того же гена. Этот механизм включает взаимодействие РII с дополнительными белками, вовлеченными в регуляцию транскрипции; они описаны в гл. 28. Суммарный результат действия этой сложной системы контроля — снижение активности глутаминсинтетазы при высоком уровне глутамина и повышение ее активности, когда доступны α-кетоглутарат и АТР (субстраты фермента). Многоступенчатая регуляция обеспечивает чувствительность ответа, приспосабливая синтез глутамина к нуждам клетки.
Несколько типов реакций, играющих особую роль в биосинтезе аминокислот и нуклеотидов
Пути, описанные в этой главе, включают ряд интересных химических реакций с переносом функциональных групп. Некоторые из этих реакций неоднократно повторяются и поэтому заслуживают специального рассмотрения до того, как мы перейдем к самим путям. Вот эти реакции: (1) трансаминирование и другие «перестройки», осуществляемые ферментами, содержащими пиридоксальфосфат, (2) перенос одноуглеродных групп кофакторами: тетрагидрофолатом (обычно переносит группы, имеющие степень окисления углерода, как в -СНО и -СН2ОН) либо S-аде- нозилметионином (-СН3 — наиболее восстановленное состояние) и (3) перенос аминогрупп, образованных из амидного азота глутамина. Пиридоксальфосфат (PLP), тетрагидрофолат (Н4-фолат) и S-аденозилметионин (adoMet) детально описаны в гл. 18 (см. рис. 18-6, 18-17 и 18-18). А здесь мы сфокусируем внимание на переносе аминогрупп, в котором участвует амидный азот глутамина.
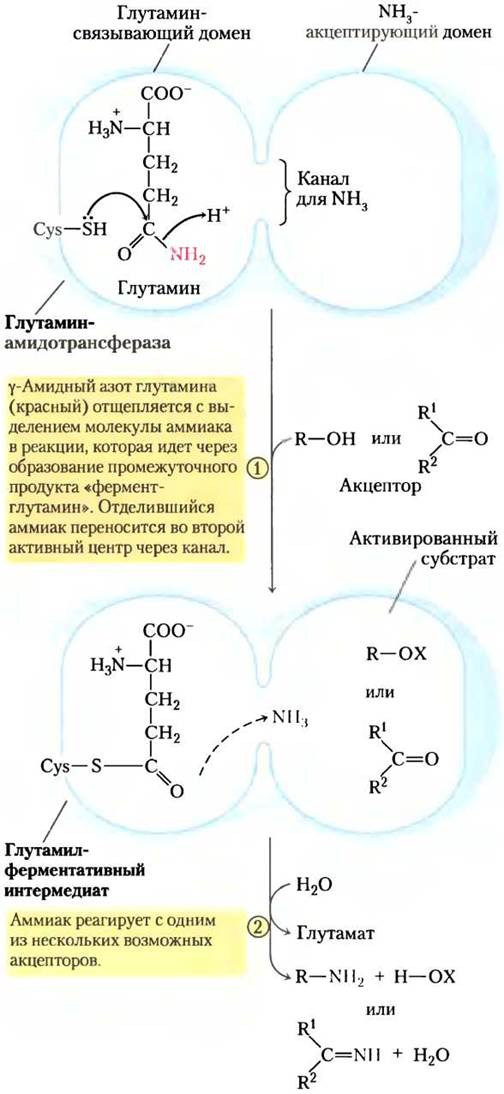
В более чем 10 известных реакциях биосинтеза глутамин выступает в качестве основного физиологического источника аминогрупп, большинство этих реакций происходит в путях, описанных в этой главе. Ферменты, катализирующие эти реакции, называются глутаминамидотрансферазами. Все они содержат два домена в своей структуре: один связывает глутамин, а другой — второй субстрат, который служит акцептором аминогрупп (рис. 22-8). Полагают, что консервативный остаток цистеина в глутаминсвязывающем домене действует как нуклеофил, разрывая амидную связь глутамина и формируя ковалентную связь интермедиата глутамил-фермента. Получающийся в этой реакции NH3 не высвобождается, а переносится по «аммонийному каналу» на второй активный центр, где реагирует со вторым субстратом с образованием аминированного продукта.
Рис. 22-8. Механизм реакции. Предполагаемый механизм реакции, осуществляемой глутаминамидотрансферазами. Каждый фермент имеет два домена. Глутамин- связывающий домен содержит структурные элементы, которые консервативны у всех этих ферментов, включая остаток цистеина, необходимый для их активности. Домены, акцептирующие NH3 (второй субстрат реакции), различаются. Показаны два типа акцепторов аминов. X — активированная группа, обычно фосфорил, полученный от АТР, что облегчает замещение гидроксильной группы в R-OH на NH3.
Краткое содержание раздела 22.1 Общий обзор метаболизма азота
■ Молекулярный азот, составляющий более 80% земной атмосферы, до тех пор, пока он не восстановлен, не доступен большинству живых организмов. Фиксацию атмосферного азота осуществляют некоторые виды свободноживущих почвенных бактерий и симбиотических клубеньковых бактерий бобовых растений.
■ Круговорот азота обеспечивают: синтез аммиака путем фиксации азота бактериями, нитрификация аммония до нитратов почвенными организмами, превращение нитратов снова в аммиак высшими растениями, синтез аминокислот из аммония всеми организмами и превращение нитратов обратно в N2 денитрифицирующими почвенными бактериями. Бактериальный анаммокс анаэробно окисляет аммоний до молекулярного азота, используя нитрит в качестве акцептора электронов.
■ Фиксация азота в виде NH3 осуществляется нитрогеназой в реакции, требующей АТР. Комплекс нитрогеназы очень неустойчив в присутствии O2.
■ В живых системах восстановленный азот включается сначала в аминокислоты, а затем в целый ряд других биомолекул, в том числе нуклеотиды. Ключевым веществом в этой цепи является глутаминовая кислота. Глутаминовая кислота и глутамин служат донорами азота в широком спектре реакций биосинтеза. Глутаминсинтетаза, катализирующая синтез глутамина из глутаминовой кислоты, — главный регуляторный фермент метаболизма азота.
■ В путях биосинтеза аминокислот и нуклеотидов неоднократно используются биологические кофакторы: пиридоксальфосфат, тетрагидрофолат и S-аденозилметионин. Пиридоксальфосфат требуется для реакций трансаминирования с участием глутамата и для других превращений аминокислот. Тетрагидрофолат и S-аденозилметионин необходимы для переноса одноуглеродных фрагментов. Глутаминамидотрансферазы катализируют реакции включения в молекулу атома азота из амидной группы глутамина.