ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
22. БИОСИНТЕЗ АМИНОКИСЛОТ, НУКЛЕОТИДОВ И РОДСТВЕННЫХ СОЕДИНЕНИЙ
Вопросы и задачи
1. Потребление АТР в корневых клубеньках бобовых.
Бактерии, находящиеся в корневых клубеньках гороха, потребляют более чем 20% АТР, образованного в растении. Объясните, почему бактерии тратят такое большое количество АТР.
2. Глутаматдещдрогеназа и синтез белка.
Бактерия Methylophilus methylotrophus может синтезировать белок из метанола и аммиака. Количество белка, производимого бактерией, было увеличено благодаря тому, что в геном М. methylotrophus методами рекомбинации ДНК был встроен ген глутаматдегидрогеназы из Е. coli. Объясните, почему эти манипуляции с генами увеличили выход белка.
3. Механизм реакций с участием пиридоксальфосфата.
Пиридоксальфосфат (PLP) помогает катализировать химические превращения, сопровождающиеся удалением одного или двух атомов углерода из молекулы аминокислоты. Так, фермент треонинсинтаза (см. рис. 22-15) осуществляет PLP-зависимое превращение фосфогомосерина в треонин. Предложите механизм этой реакции.
4. Образование аспарагина из аспартата.
Есть два способа образования аспарагина из аспартата в присутствии АТР. Многие бактерии имеют аспарагинсинтетазу, которая использует ион аммония в качестве донора азота. У млекопитающих аспарагинсинтетаза использует в качестве донора азота глутамин. Учитывая последующие затраты АТР (для синтеза глутамина), почему же млекопитающие используют второй путь?
5. Уравнение синтеза аспартата из глюкозы.
Напишите полное уравнение синтеза аспартата (заменимой аминокислоты) из глюкозы, диоксида углерода и аммиака.
6. Лечение лейкоза нгибиторами аспарагинсинтетазы.
Аспарагинсинтетаза млекопитающих представляет собой глутаминзависимую амидотрансферазу. Поиски эффективного ингибитора человеческой аспарагинсинтетазы для лечения лейкоза связаны с ингибированием не N-концевого домена с глутаминазной активностью, а С-концевого домена, в котором расположен активный центр синтетазы. Объясните, почему глутаминазный домен не может быть мишенью лекарственного препарата.
7. Дефект фенилаланингидроксилазы и питание.
В норме тирозин является заменимой аминокислотой, но организмам с генетическим дефектом в гене фенилаланингидроксилазы для нормального роста требуется поступление тирозина вместе с пищей. Объясните этот факт.
8. Кофакторы для реакций переноса одноуглеродных фрагментов.
Большинство переносов одноуглеродных фрагментов осуществляется одним из трех кофакторов: биотином, тетрагидрофолатом или S-аденозилметионином (гл. 18). В качестве донора метальной группы обычно используется S-аденозилметаонин; в большинстве реакций биосинтеза недостаточно энергии, выделяемой при переносе метильной группы N5-метилтетрагидрофолата. Однако существует пример использования N5-метилтетрагидрофолата в качестве переносчика метильной группы при образовании метионина в реакции метионинсинтазы (стадия (9) на рис. 22-15); метионин служит непосредственным предшественником S-аденозилметионина (см. рис. 18-18). Объясните, как метильная группа для S-аденозилметаонина может отщепляться от N5- метилтетрагидрофолата, хотя энергия переноса метильной группы в N5-метилтетрагидрофолате составляет тысячные доли по сравнению с таким процессом в S-аденозилметионине.
9. Согласованная регуляция биосинтеза аминокислот.
Глутаминсинтетаза Е. coli модулируется независимо различными продуктами метаболизма глутамина (см. рис. 22-6). В этом согласованном ингибировании степень подавления фермента намного больше, чем просто сумма эффектов каждого продукта-ингибитора в отдельности. Каково будет преимущество согласованного ингибирования для роста Е. coli в среде, богатой гистидином?
10. Связь между недостатком фолиевой кислоты и анемией.
Недостаток фолиевой кислоты считается наиболее распространенной недостаточностью витаминов и вызывает такой тип анемии, при которой снижен синтез гемоглобина и эритроциты созревают не до конца. Какова метаболическая связь между синтезом гемоглобина и недостатком фолиевой кислоты?
11. Биосинтез нуклеотидов у бактерий, ауксотрофных по аминокислоте.
Клетки Е. coli дикого типа способны синтезировать все 20 протеиногенных аминокислот, но некоторые мутанты, называемые ауксотрофами по какой-либо определенной аминокислоте, не способны синтезировать эту аминокислоту, поэтому для нормального роста им необходимо ее присутствие в среде. Помимо участия в синтезе белка некоторые аминокислоты служат также предшественниками других азотсодержащих продуктов в клетке. Рассмотрите три ауксотрофа, которые не способны синтезировать глицин, глутамин и аспартат. Для каждого мутанта определите, какие азотсодержащие продукты наряду с белками, не смогут синтезировать эти клетки.
12. Ингибирование биосинтеза нуклеотидов.
Предположите механизмы ингибирования (а) аланинрацемазы L-фтораланином и (б) глутаминамидотрансферазы азасерином.
13. Способ действия серосодержащих лекарств.
Некоторым бактериям для нормального роста необходимо присутствие в среде пара-аминобензоата, и их рост сильно ингибируется добавлением сульфаниламида, одного из первых серосодержащих лекарств. Более того, в присутствии этого препарата в среде накапливается 5-аминоимидазол-4-карбоксамид-рибонуклеотид (АIСАR; см. рис. 22-33). Эти эффекты снимаются добавлением избытка пара-аминобензоата.
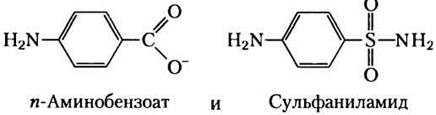
а) Какую функцию выполняет пара-аминобензоат в этих бактериях? (Подсказка. См. рис. 18-16.)
б) Почему в присутствии сульфаниламида накапливается AICAR?
в) Почему эффекты ингибирования исчезают при добавлении избытка пара-аминобензоата?
14. Путь углерода при биосинтезе пиримидина.
Предскажите локализацию 14С в оротате, выделенном из клеток, растущих в среде, содержащей небольшое количество полностью меченного [14С] сукцината. Докажите свой прогноз.
15. Нуклеотиды как бедный источник энергии.
В условиях голодания организм может использовать белки и аминокислоты в качестве источника энергии. При дезаминировании аминокислот их углеродные скелеты могут расщепляться в гликолизе или цикле трикарбоновых кислот с высвобождением энергии в виде АТР. В то же время нуклеотиды при деградации не образуют соединения, которые могли бы использоваться как биологическое топливо. Какие факты из клеточной физиологии поддерживают такое утверждение? Какие структурные особенности нуклеотидов делают их относительно бедным источником энергии?
16. Лечение подагры.
При лечении хронической подагры используется ингибитор ксантиноксидазы аллопуринол (см. рис. 22-47). Объясните биологические основы такого лечения. Иногда у пациентов, принимающих аллопуринол, образуются ксантиновые камни в почках, хотя частота случаев повреждения почек значительно ниже, чем у тех, кто не лечится. Объясните это наблюдение на основе растворимости этих веществ: мочевая кислота 0,15 г/л, ксантин 0,05 г/л и гипоксантин 1,4 г/л.
17. Ингибирование синтеза нуклеотидов азасерином.
Диазосоединение О-(2-диазоацетил)-L- серин, известный как азасерин (см. рис. 22-48), служит мощным ингибитором глутаминамидотрансфераз. Если в среду с растущими клетками добавить азасерин, какие будут накапливаться интермедиаты нуклеотидного биосинтеза? Объясните свой ответ.
Анализ экспериментальных данных
18. Использование современных технологий для определения пути синтеза новой аминокислоты.
Большинство путей биосинтеза, описанных в данной главе, были изучены до развития технологии рекомбинантных ДНК и до появления геномики, так что методы анализа того времени сильно отличались от современных методов. Здесь мы рассмотрим пример применения новых молекулярных технологий для изучения пути синтеза новой аминокислоты (25)-4-амино-2-гидроксибутирата (АНВА). Используемые в данной задаче методы описаны в различных разделах книги, а здесь мы попытаемся показать, каким образом они могут применяться в одном конкретном исследовании.
АНВА — это y-аминокислота, входящая в состав некоторых аминогликозидных антибиотиков, в частности бутирозина. Антибиотики, модифицированные путем введения остатка АНВА, часто более устойчивы к инактивации под действием бактериальных ферментов. Поэтому понимание путей синтеза АНВА и ее связывания с молекулами антибиотиков необходимо для разработки новых лекарственных препаратов.
В опубликованной в 2005 г. статье Ли с соавторами описали свой метод изучения пути синтеза АНВА из глутамата.
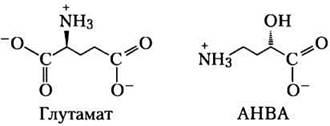
а) Перечислите химические превращения, необходимые для образования АНВА из глутамата; можно не стараться указывать реакции в правильном порядке.
Ли с соавторами взялись клонировать генный кластер, ответственный за синтез бутирозина в клетках Bacillus circulans, где образуется много бутирозина. Они идентифицировали пять генов, необходимых для осуществления этого метаболического пути: btrl, btrJ, btrK, btrO и btrV. Исследователи встроили эти гены в плазмиду, позволяющую получить высокий выход продукта в клетках Е. coli, образующиеся белки содержали на N-конце последовательность из нескольких остатков гистидина (см. с. 447, т. 1), что облегчало их выделение и очистку. Предсказанная аминокислотная последовательность белка Btrl имела высокий уровень гомологии с последовательностями известных ацилпереносящих белков (см. рис. 21-5). Методом масс-спектрометрии (см. доп. 3-2, т. 1) Ли с соавторами определили, что молекулярная масса очищенного белка Btrl (вместе с гистидиновой последовательностью) составляет 11812. После инкубации очищенного белка Btrl с коферментом А и с ферментом, присоединяющим СоА к другим ацилпереносящим белкам, были получены продукты, среди которых значительную часть составлял белок с молекулярной массой Мr = 12 153.
б) Как эти данные подтверждают тот факт, что белок Btrl может выполнять функцию ацил- переносящего белка с СоА в качестве простетической группы?
Согласно стандартной терминологии, Ли с соавторами назвали белок, не связанный с СоА, apo-Btrl, а белок с СоА (см. рис. 21-5) — holo- Btrl. В результате инкубации белка holo-Btrl с глутамином, АТР и очищенным белком BtrJ белок holo-Btrl с Мr = 12 153 превратился в белок с Мr = 12 281, что соответствует тиоэфиру глутамата и holo-Btrl. На основании этих данных авторы предположили, что формула белка с Мr = 12 281 (y-глутамил-S-BtrI) следующая:
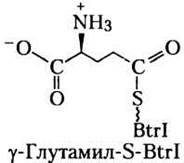
в) Какие еще структурные формулы могли бы соответствовать представленным выше данным?
г) Ли с соавторами утверждали, что изображенная здесь структура (y-глутамил-S-BtrI) справедлива, поскольку α-карбоксильная группа должна удаляться в какой-то момент в процессе биосинтеза. Объясните химический смысл этого утверждения. (Подсказка. См. рис. 18-6, в.)
Белок BtrK имел значительную гомологию с PLP-зависимой декарбоксилазой аминокислот, а выделенный из клеток Е. coli белок BtrK был прочно связан с PLP. В результате инкубации y-глутамил-S-BtrI с очищенным белком BtrK было получено вещество с Мr = 12 240.
д) Какова наиболее вероятная структура этого вещества?
е) Интересно, что в результате инкубации глутамата и АТР с очищенными белками Btrl, BtrJ и BtrK получалось вещество с Мr = 12 370. Какова наиболее вероятная структура этого вещества? Подсказка. Вспомните, что BtrJ может использовать АТР для взаимодействия с y-глутамильной нуклеофильной группой.
Ли с соавторами обнаружили, что BtrO является гомологом монооксигеназы (см. доп. 21-1), осуществляющей гидроксилирование алканов, используя в качестве кофактора FMN, a BtrV является гомологом NАD(Р)Н-оксидоредуктазы. Два других гена в кластере, btrG и btrН, возможно, кодируют ферменты, удаляющие y-глутамильную группу и присоединяющие АНВА к молекуле антибиотика-мишени.
ж) На основании этих данных предложите возможный механизм синтеза АНВА и его присоединения к антибиотику-мишени. Укажите ферменты, катализирующие каждую стадию, а также все необходимые субстраты и кофакторы (АТР, NAD и т. д.).