ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
Спиртовое брожение, которое лежит в основе чудесного и, по-видимому, самопроизвольного процесса превращения простого виноградного сока в возбуждающее вино, с древних времен привлекало внимание естествоиспытателей.
Артур Гарден, Alcoholic Fermentation (Спиртовое брожение), 1923
14. ГЛИКОЛИЗ, ГЛЮКОНЕОГЕНЕЗ И ПЕНТОЗОФОСФАТНЫЙ ПУТЬ
В метаболизме растений, животных и многих микроорганизмов глюкоза занимает центральное место. Молекула глюкозы богата энергией и поэтому используется клетками в качестве «топлива». Полное окисление глюкозы до углекислого газа и воды сопровождается изменением свободной энергии, равным -2840 кДж/моль. В клетках глюкоза запасается в виде высокомолекулярных соединений крахмала или гликогена, что позволяет накапливать большое количество гексозных звеньев и при этом сохранять сравнительно низкую осмолярность цитозоля. При увеличении энергетических затрат клетки глюкоза высвобождается из внутриклеточных запасов и используется для продуцирования АТР аэробным или анаэробным путем.
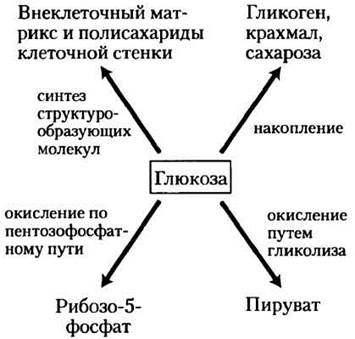
Глюкоза не только прекрасный источник энергии, но и универсальный предшественник, из которого в реакциях биосинтеза образуется множество интермедиатов. Например, бактерия Escherichia coli производит из глюкозы углеродные скелеты всех аминокислот, нуклеотидов, коферментов, жирных кислот и других продуктов, необходимых ей для роста. Для полного понимания метаболических процессов с участием глюкозы необходимо было бы рассмотреть сотни или даже тысячи различных реакций. В клетках животных и в клетках сосудистых растений глюкоза претерпевает превращения трех основных типов: 1) запасается в виде полисахаридов или сахарозы: 2) путем гликолиза окисляется до трикарбоновых соединений (пирувата) с образованием АТР и различных интермедиатов метаболизма; 3) по пентозофосфатному (фосфоглюконатному) пути окисляется до рибозо-5-фосфата, необходимого для синтеза нуклеиновых кислот и NADPH, участвующего в восстановительных реакциях биосинтеза (рис. 14-1).
Рис. 14-1. Основные пути использования глюкозы в клетке. Глюкоза претерпевает и другие превращения, однако в большинстве клеток наиболее существенные количества глюкозы расходуются именно по этим трем самым важным направлениям.
Те организмы, которые не могут получить глюкозу из других источников, должны синтезировать ее самостоятельно. Фотосинтезирующие организмы образуют глюкозу из атмосферного СO2, превращая его триозу и далее в глюкозу. Нефотосинтезирующие клетки производят глюкозу из более простых трех- и четырехуглеродных предшественников в глюконеогенезе (процессе, обратном гликолизу), где эффективно используются многие гликолитические ферменты.
В данной главе мы остановимся на отдельных реакциях гликолиза, глюконеогенеза и пентозофосфатного пути и обсудим функциональное значение каждого из этих путей. Кроме того, мы рассмотрим различные превращения пирувата, образующегося в результате гликолиза; к ним относятся процессы брожения, используемые многими организмами в анаэробных условиях для получения АТР, а человеком для промышленного производства этилового спирта, молочной кислоты и других важных продуктов. Мы также разберем метаболические пути, поставляющие для гликолиза различные сахара из моно-, ди- и полисахаридов. Обсуждение метаболизма глюкозы продолжается в гл. 15, где рассматриваются процессы анаболизма и катаболизма, связывающие глюкозу с гликогеном. Механизмы регуляции метаболизма мы проиллюстрируем на примере реакций синтеза и деградации углеводов. Пути биосинтеза полисахаридов внеклеточного матрикса и клеточных стенок из глюкозы обсуждаются в г л. 20.
14.1. Гликолиз
В процессе гликолиза (от греч. glykys — сладкий или сахар и lysis — разрушение) происходит последовательное ферментативное расщепление молекулы глюкозы с образованием двух молекул трехуглеродного соединения пирувата. Часть высвобождающейся в этом процессе свободной энергии запасается в виде АТР и NADH. Из всех метаболических путей последовательность реакций гликолиза была установлена первой, и он, по- видимому, изучен лучше всего. Начиная с открытия Эдуардом Бухнером в 1897 г. ферментации в дрожжевом экстракте и вплоть до установления полного метаболического пути в дрожжах (работы Отто Варбурга и Ганса Эйлера-Челпина) и в мышцах (работы Густава Эмбдена и Отто Мейергофа) в 1930-х гг. основное направление биохимических исследований было сконцентрировано на реакциях гликолиза в дрожжевом экстракте и мышцах. Изменение научных взглядов под влиянием данного открытия было сформулировано Жаком Лебом в 1906 г.:
«Благодаря открытию Бухнера биология освободилась еще от одного мифа. Разложение сахара на СO2 и спирт нельзя считать проявлением «принципа витализма», как и расщепление тростникового сахара инвертазой. История данного вопроса поучительна, поскольку не позволяет считать, что те или иные проблемы находятся вне нашего понимания лишь по той причине, что они пока еще не нашли своего объяснения.»

Исследование процесса гликолиза стимулировало развитие методов очистки ферментов, помогло осознать роль коферментов, например, NAD, а также выявить ключевую метаболическую функцию АТР и других фосфорилированных соединений. Были очищены и детально изучены гликолитические ферменты из многих видов организмов.
Гликолиз — практически универсальный центральный путь катаболизма глюкозы; в большинстве клеток в этом процессе происходит превращение основных количеств углеродсодержащих соединений. В некоторых клетках и тканях млекопитающих (например, эритроцитах, мозговом веществе почки, головном мозге, сперме) гликолитическое расщепление глюкозы — это единственный источник метаболической энергии. Некоторые ткани растений, служащие для накопления крахмала (картофельные клубни), а также ряд водных растений (например, водяной кресс) получают большую часть необходимой им энергии в процессе гликолиза; многие анаэробные организмы полностью зависят от гликолиза.
Брожение — это общий термин, обозначающий анаэробное разложение глюкозы или других органических питательных веществ с целью высвобождения энергии, запасаемой в виде АТР. Поскольку живые организмы возникли в бескислородной атмосфере, анаэробное разложение глюкозы, возможно, самый древний биологический механизм, позволяющий получить энергию из органических молекул. В процессе эволюции данная последовательность химических превращений полностью сохранилась. Гликолитические ферменты позвоночных очень похожи на своих гомологов у дрожжей и шпината как по аминокислотной последовательности, так и по третичной структуре. У организмов разных видов гликолиз различается лишь деталями регуляции и судьбой образующегося пирувата. При этом термодинамические принципы и типы регуляторных механизмов, управляющих гликолизом, такие же, как и для всех метаболических путей в клетке. Итак, гликолиз играет важную роль в химии жизни и как модельный процесс он удобен для изучения общих принципов метаболизма.
Прежде чем начать изучение отдельных стадий гликолиза, взглянем на этот процесс в целом.
Гликолиз протекает в две стадии
Расщепление шестиуглеродной глюкозы на две молекулы трехуглеродного пирувата представляет собой последовательность из 10 реакций, из которых первые пять называют подготовительной стадией (рис. 14-2, а). Сначала глюкоза фосфорилируется по гидроксильной группе у атома С-6 (реакция (1)). Образующийся при этом D-глюкозо-6-фосфат превращается в D-фруктозо-6-фосфат (реакция (2)), который в свою очередь тоже фосфорилируется — теперь по атому С-1 — с образованием D-фруктозо-1,6-бисфосфата (реакция (3)). В обеих реакциях фосфорилирования донором фосфорильной группы служит АТР. Поскольку все производные сахаров, образующиеся в процессе гликолиза, — D-изомеры, мы посчитали возможным здесь опустить в названиях соединений букву D, за исключением тех случаев, когда важно подчеркнуть их стереохимические свойства.
Рис. 14-2. Две стадии гликолиза. На подготовительной стадии (а) из каждой молекулы глюкозы образуются две молекулы глицеральдегид-3-фосфата; обе эти молекулы претерпевают дальнейшие превращения на возвратной стадии. б — конечным продуктом второй стадии гликолиза является пируват. На первой стадии гликолиза на одну молекулу глюкозы расходуются две молекулы АТР, а на второй стадии образуются четыре молекулы АТР, что в сумме приводит к образованию двух молекул АТР на каждую молекулу глюкозы, превращенную в пируват. Нумерация реакций на схеме соответствует нумерации в тексте; ферменты, катализирующие соответствующие реакции, перечислены справа. Помните, что каждая фосфорильная группа, обозначенная здесь как![]() несет два отрицательных заряда (-РО2-3).
несет два отрицательных заряда (-РО2-3).
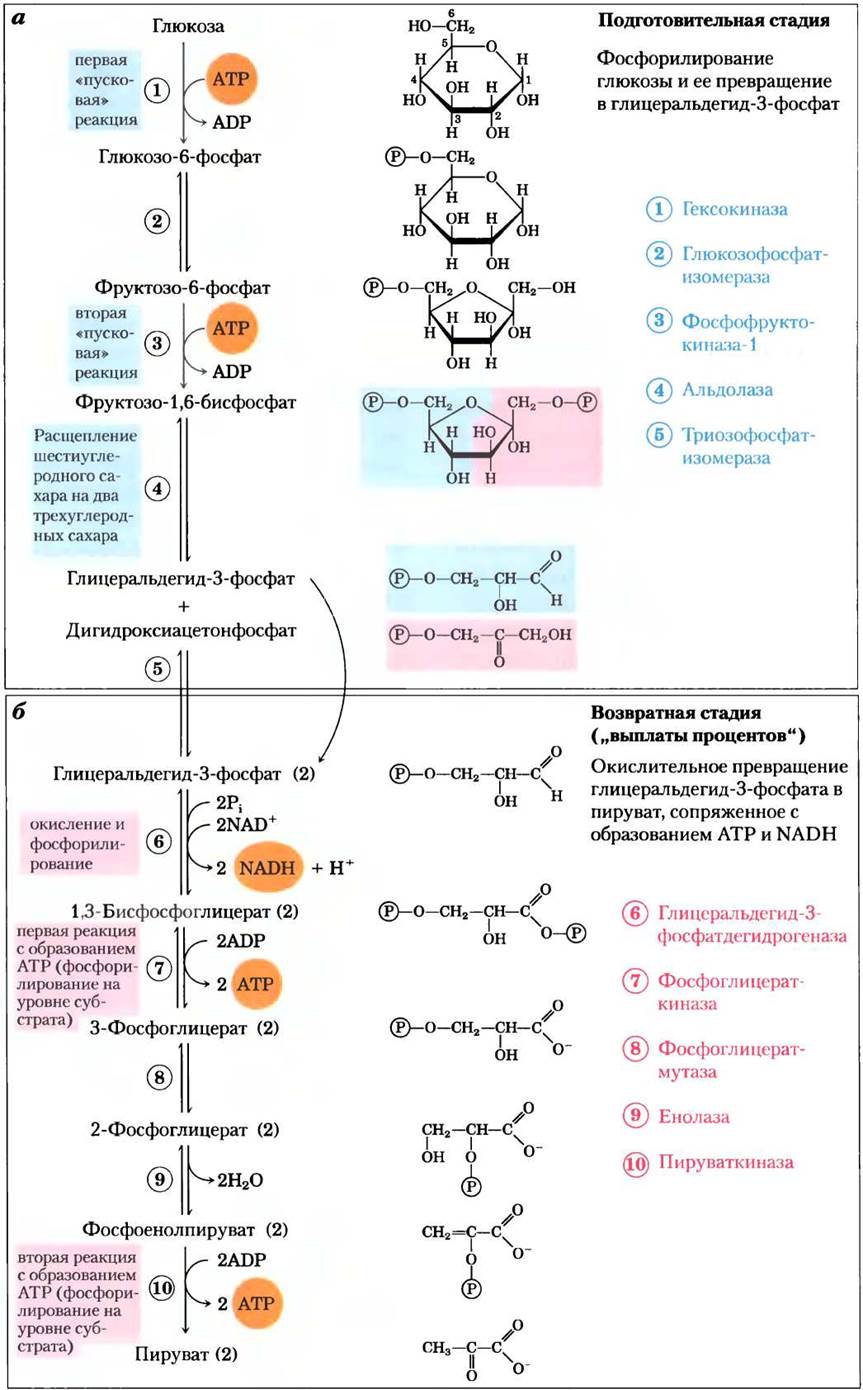
Фруктозо-1,6-бисфосфат распадается с образованием двухтреху глеродных молекул-дигидроксиацетонфосфата и глицеральдегид-3-фосфата (реакция ®; именно эта стадия «лизиса» дает название всему процессу). Затем в результате изомеризации дигидроксиацетонфосфата образуется вторая молекула глицеральдегид-3-фосфата (реакция (5); на этом заканчивается первая стадия гликолиза. Далее мы с химической точки зрения обсудим подробнее, насколько важную роль играет стадия изомеризации (реакция (2)) для фосфорилирования и разрушения связи С—С в реакциях (3) и (4). Обратите внимание, что до стадии расщепления глюкозы на трехуглеродные соединения расходуются две молекулы АТР; несколько позже эти затраты АТР будут не только компенсированы, но и перекрыты. Итак, на подготовительной стадии гликолиза энергия, заключенная в АТР, увеличивает потенциальную энергию интермедиатов; углеродные цепи всех расщепляемых гексоз превращаются в один и тот же продукт — глицеральдегид-3-фосфат.
Вторая (возвратная) стадия гликолиза (стадия «выплаты процентов») сопровождается высвобождением энергии (рис. 14-2, б). Каждая молекула глицеральдегид-3-фосфата окисляется и фосфорилируется под действием неорганического фосфата (не АТР!) с образованием 1,3-бисфосфоглицерата (реакция (6)). При превращении двух молекул 1,3- бисфоглицерата в две молекулы пирувата (реакции (7)-(10) происходит высвобождение энергии.
В результате сопряженного фосфорилирования четырех молекул ADP большая часть этой энергии накапливается в виде АТР. Общий выход АТР в процессе гликолиза, однако, составляет не четыре, а лишь две молекулы на одну молекулу глюкозы, поскольку две молекулы АТР расходуются на подготовительной стадии. Кроме того, энергия, высвобождающаяся на второй стадии гликолиза, запасается в виде двух молекул NADPH в расчете на одну молекулу глюкозы.
В процессе гликолиза происходят превращения трех разных типов: 1) расщепление углеродного скелета глюкозы с образованием пирувата; 2) фосфорилирование ADP до АТР под действием высокоэнергетических фосфорилированных соединений, образующихся при гликолизе; 3) перенос гидрид-иона на NAD+ с образованием NADH.
Превращения молекулы пирувата.
За исключением нескольких интересных случаев среди бактерий у всех остальных организмов образующийся в результате гликолиза пируват претерпевает дальнейшие превращения по одному из трех основных путей катаболизма. У аэробных организмов и в тканях при аэробных условиях гликолиз — это всего лишь первая стадия полного расщепления глюкозы (рис. 14-3). При окислении пирувата образуется ацетогруппа ацетилкофермента А, а карбоксильная группа пирувата превращается в СО2. Далее ацетогруппа полностью окисляется до СО2 в цикле лимонной кислоты (гл. 16). Эти процессы сопровождаются переносом электронов на молекулу О2 с образованием Н2О в митохондриях. Энергия, высвобождаемая при переносе электронов, является движущей силой образования АТР в митохондриях (гл. 19).
Рис. 14-3. Возможные пути катаболизма пирувата, образующегося в результате гликолиза. Пируват, кроме того, служит предшественником во многих реакциях анаболизма, которые здесь не изображены.
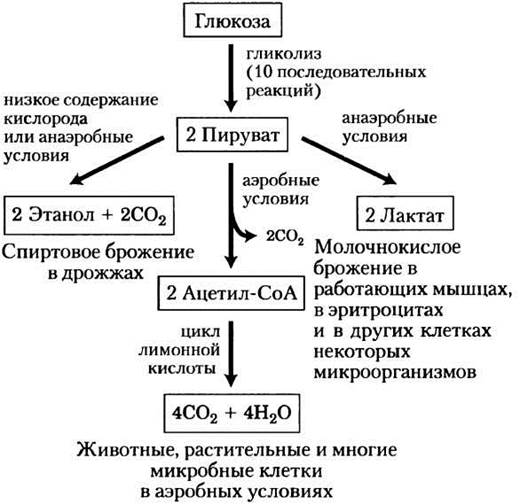
Второй возможный путь превращения пирувата — его восстановление до лактата в процессе молочнокислого брожения. При интенсивной работе мышц в условиях недостатка кислорода (гипоксия) NADH не может вновь превращаться в NAD+, однако NAD+ как акцептор электронов необходим для дальнейшего окисления пирувата. В таких условиях пируват восстанавливается до лактата, принимая электроны от NADH, в результате чего образуется NAD+, необходимый для продолжения гликолиза. Некоторые типы клеток и тканей (например, клетки сетчатки и эритроциты) превращают глюкозу в лактат даже в аэробных условиях; кроме того, некоторые микроорганизмы также образуют лактат в процессе гликолиза в анаэробных условиях (рис. 14-3).
На третьем основном пути катаболизма пируват превращается в этиловый спирт. Превращение пирувата в этанол и СО2 в некоторых тканях растений, у определенных видов беспозвоночных, простейших и микроорганизмов (например, у пекарских дрожжей) при недостатке кислорода или в анаэробных условиях называют спиртовым брожением (рис. 14-3).
Окисление пирувата — важный процесс катаболизма, однако пируват участвует и в реакциях анаболизма. Например, на его основе строится углеродный скелет аминокислоты аланина. Мы рассмотрим эти реакции пирувата в последующих главах.
Образование АТР и NADH в процессе гликолиза.
Часть энергии, запасенной в молекуле глюкозы, в результате гликолиза переходит в АТР, а часть сохраняется в пирувате. Полное уравнение гликолиза можно записать следующим образом:
Глюкоза + 2NAD+ + 2ADP + 2Рi —> 2 пируват + 2NADH + 2Н+ + 2АТР + 2Н2O (14-1)
При разложении каждой молекулы глюкозы до пирувата происходит образование двух молекул АТР из ADP и Pi и двух молекул NADH при восстановлении NAD+. Акцептором водорода в данной реакции выступает NAD+ (см. рис. 13-24), связанный с мотивом укладки Россмана (см. рис. 13-25). Восстановлению NAD+ предшествует ферментативный перенос гидрид-иона (:Н-) от альдегидной группы глицеральдегид-3-фосфата на никотинамидное кольцо NAD+, что приводит к образованию восстановленной формы кофермента NADH. Другой атом водорода из молекулы субстрата высвобождается в раствор как Н+.
Мы можем записать гликолиз в виде двух отдельных реакций — экзергонической реакции (превращение глюкозы в пируват)
Глюкоза + 2NAD+ —> 2 пируват + 2NADH + 2Н+ (14-2)
∆G'° = -146 кДж/моль
и эндергонической (образование АТР из ADP и Рi)
2ADP + 2Рi —> 2АТР + 2Н2O (14-3)
∆G2° = 2 • 30,5 кДж/моль = 61,0 кДж/моль
Суммируя уравнения 14-2 и 14-3, получим изменение свободной энергии в процессе гликолиза (∆G'°общ):
∆G'°общ = ∆G1'° + ∆G2'° = -146 кДж/моль + 61,0 кДж/моль = -85 кДж/моль
В стандартных условиях в клетке гликолиз необратим и проходит полностью (до конца) — большая отрицательная величина изменения свободной энергии.
Энергия, заключенная в пирувате.
В результате гликолиза высвобождается лишь небольшая часть энергии, запасенной в молекуле глюкозы. Образующиеся две молекулы пирувата по- прежнему содержат значительную долю энергии молекулы глюкозы, и эту энергию можно извлечь в ходе окислительных реакций в цикле лимонной кислоты (гл. 16) и окислительного фосфорилирования (гл. 19).
Роль фосфорилированных интермедиатов.
Каждый из девяти интермедиатов на пути превращения глюкозы в пируват фосфорилирован (рис. 14-2). Фосфорильные группы, по-видимому, выполняют три функции.
1. Поскольку в плазматической мембране обычно нет переносчиков фосфорилированных сахаров, фосфорилированные интермедиаты не могут покинуть клетку. После первой же стадии фосфорилирования отпадает необходимость затрачивать энергию на удерживание интермедиатов внутри клетки, несмотря на большую разницу в их внутри- и внеклеточной концентрациях.
2. Фосфорильные группы играют важную роль в сохранении метаболической энергии. Энергия, высвобождающаяся при разрыве фосфоангидридной связи (например, в АТР), частично сохраняется благодаря образованию эфиров фосфорной кислоты (например, глюкозо-6-фосфата). Богатые энергией фосфорилированные соединения, образующиеся в процессе гликолиза (1,3-бисфосфоглицерат и фосфоенолпируват), отдают свою фосфорильную группу молекулам ADP, в результате чего образуется АТР.
3. Энергия связывания фосфатных групп в активных центрах ферментов снижает энергию активации и повышает специфичность ферментативных реакций (гл. 6). Фосфатные группы ADP, АТР и интермедиатов гликолиза образуют комплексы с ионами Mg2+, а центры связывания субстратов многих гликолитических ферментов специфичны к этим комплексам. Большинству гликолитических ферментов для проявления активности требуются ионы Mg2+.
На подготовительной стадии гликолиза расходуется АТР
На подготовительной стадии гликолиза расходуются две молекулы АТР, а фосфорилированный шестиуглеродный сахар расщепляется на два фосфорилированных трехуглеродных сахара. Понимание того, что интермедиатами гликолиза являются именно фосфорилированные гексозы, было достигнуто не сразу и в некотором смысле случайно. В 1906 г. Артур Гарден и Уильям Янг проверяли свою гипотезу, в соответствии с которой ингибиторы протеолитических ферментов должны стабилизировать ферменты в дрожжевом экстракте при сбраживании глюкозы. Они добавляли к дрожжевому экстракту сыворотку крови (в которой, как было известно, содержатся ингибиторы протеолитических ферментов) и действительно наблюдали усиление метаболизма глюкозы. Однако контрольный эксперимент, целью которого было продемонстрировать отсутствие стимулирующей активности сыворотки после кипячения, показал, что сыворотка и после кипячения оказывала такое же стимулирующий эффект на гликолиз. Тщательный анализ содержимого прокипяченной сыворотки показал, что стимулирующий эффект связан с наличием неорганического фосфата. Вскоре Гарден и Янг обнаружили, что глюкоза, добавленная к дрожжевому экстракту, превращалась в гексозобисфосфат («эфир Гардена-Янга», идентифицированный впоследствии как фруктозо-1,6-бисфосфат). Это открытие дало начало длительной серии исследований, посвященных изучению функций органических эфиров фосфорной кислоты в биохимии, в результате которых сложились наши современные представления о центральной роли переноса фосфорильных групп.

(1) Фосфорилирование глюкозы.
В первой реакции гликолиза происходит активация глюкозы путем ее фосфорилирования по атому С-6, в результате чего образуется глюкозо-6-фосфат; донором фосфорильной группы является АТР:
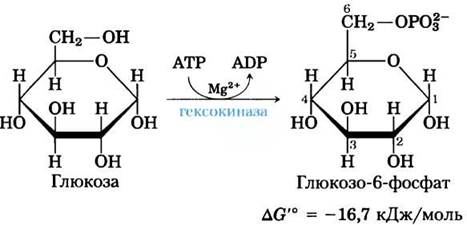
Эта необратимая во внутриклеточных условиях реакция катализируется гексокиназой. Вспомните, что киназами называют ферменты, катализирующие перенос концевой фосфорильной группы от АТР на нуклеофильную акцепторную молекулу (см. рис. 13-20). Киназы относятся к классу ферментов трансфераз (см. табл. 6-3). В случае гексокиназы акцептором выступает гексоза (обычно D-глюкоза, хотя в некоторых тканях гексокиназы катализируют также фосфорилирование других распространенных гексоз, таких как D-фруктоза и D-манноза).
Как и многим другим ферментам, гексокиназе для проявления активности необходимы ионы Mg2+, поскольку на самом деле субстратом данного фермента выступает не АТР4-, а комплекс MgATP2-« (см. рис. 13-2). Ионы Mg2+ экранируют отрицательные заряды фосфорильных групп АТР, в результате чего концевой атом фосфора становится более доступным для нуклеофильной атаки -ОН-группой глюкозы. При связывании глюкозы молекула гексокиназы претерпевает значительные изменения (индуцированное соответствие), а при связывании АТР два домена белка сближаются на ~8 А (см. рис. 6-22, т. 1). В результате такого смещения связанная молекула АТР приближается к связанной молекуле глюкозы, что предотвращает проникновение окружающей воды. В противном случае вода могла бы попадать в активный центр и атаковать (гидролизовать) фосфоангидридные связи АТР. Подобно девяти другим ферментам гликолиза, гексокиназа представляет собой растворимый белок, находящийся в цитозоле.
Гексокиназа есть почти у всех организмов. В геноме человека закодированы четыре гексокиназы (I—IV), и все они катализируют одну и ту же реакцию. Ферменты, катализирующие одну и ту же реакцию, но кодируемые разными генами, называют изоферментами (см. доп. 15-2). Одна из форм, присутствующая в гепатоцитах, гексокиназа IV (она же глюкокиназа) отличается от всех других форм гексокиназы своими кинетическими и регуляторными свойствами, что имеет важное физиологическое значение (см. разд. 15.3).
(2) Превращение глюкозо-6-фосфата во фруктозо-6-фосфат.
Фермент фосфоглюкоизомераза (глюкозофосфатизомераза) катализирует обратимую изомеризацию альдозы глюкозо-6- фосфата и кетозы фруктозо-6-фосфата:
Механизм этой реакции включает образование промежуточного ендиола (рис. 14-4). Реакция легко протекает в обоих направлениях, что связано с небольшим изменением свободной энергии. Изомеризация играет принципиальную роль для всего процесса гликолиза, поскольку перегруппировки карбонильной и гидроксильной групп у атомов С-1 и С-2 необходимы для протекания двух следующих реакций. Для реакции фосфорилирования (реакция (3)) требуется, чтобы у атома С-1 появилась спиртовая группа, а для расщепления связи между атомами С-3 и С-4 (реакция (4)) важно, чтобы у атома С-2 находилась карбонильная группа (с. 22).
Рис. 14-4. Механизм реакции. Реакция, катализируемая фосфоглюкоизомеразой. В раскрытии и замыкании кольца (стадии (1) и(4)) принимает участие остаток His активного центра (для простоты здесь не показан). Протон (выделен розовым цветом), исходно находящийся у атома С-2, становится более подвижным благодаря смещению электронов к карбонильному кислороду и кислороду соседней гидроксильной группы. После переноса протона от атома С-2 на остаток Glu (слабая кислота) в активном центре он свободно обменивается на протоны из раствора, так что вовсе не обязательно, что на стадии (3) к атому С-1 присоединяется тот же самый протон. Механизм действия фосфоглюкоизомеразы
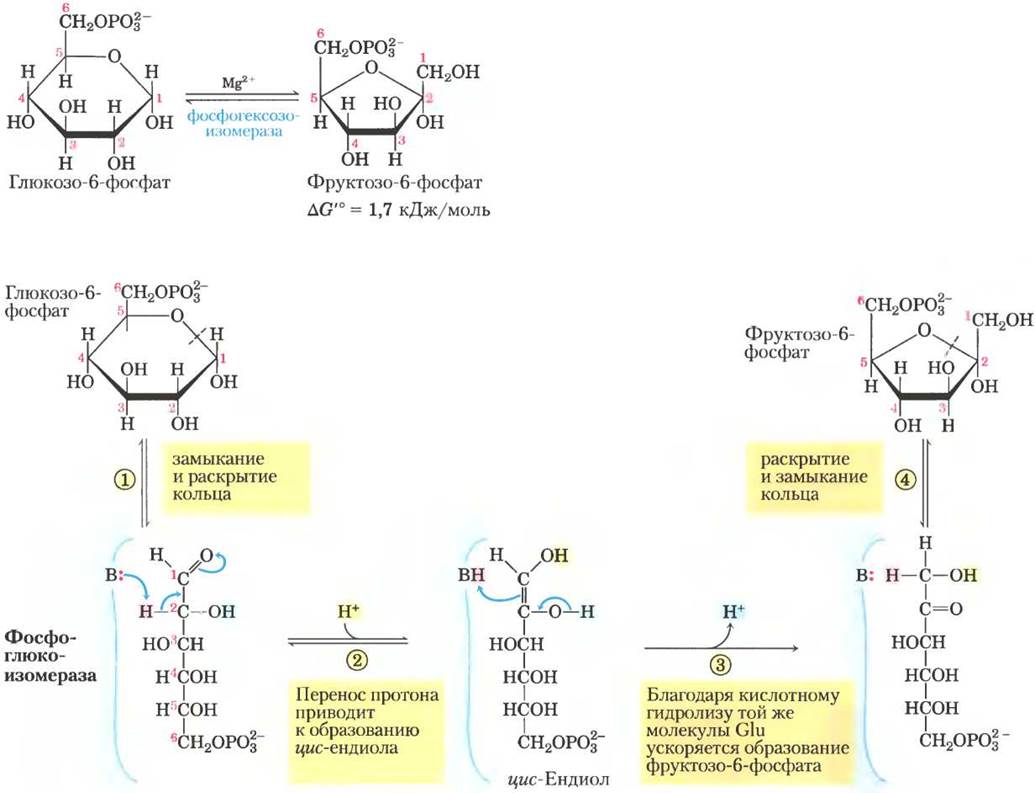
(3) Фосфорилирование фруктозо-6-фосфата до фруктозо-1,6-бисфосфата.
Во второй из двух «пусковых» реакций гликолиза фосфофруктокиназа-1 (PFK-1) катализирует перенос фосфорильной группы АТР на фруктозо-6-фосфат, в результате чего образуется фруктозо-1,6-бисфосфат:
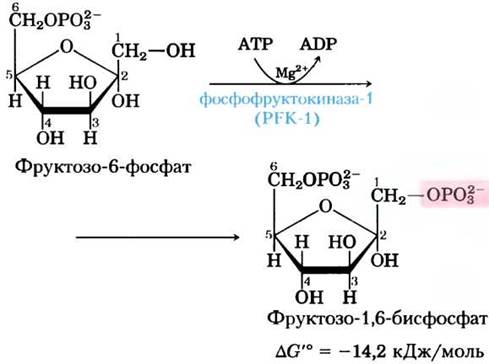
Ключевые договоренности.
Соединения, имеющие в своем составе две фосфатные или фосфорильные группы, присоединенные к разным участкам молекулы, называют бисфосфатами (или бисфосфо- соединениями); например, фруктозо-1,6-бисфосфат и 1,3-бисфосфоглицерат. Соединения с двумя соединенными между собой фосфатными группами, как в пирофосфорильной группе, называют дифосфатами, например, аденозиндифосфат ADP. Те же правила используются и в номенклатуре соединений с тремя фосфатными группами: различают трисфосфаты (например, инозит-1,4,5-трисфосфат) и трифосфаты (например, аденозинтрифосфат АТР). ■
Фермент, который превращает фруктозу во фруктозо-1,6-бисфосфат, называется PFK-1, чтобы отличить его от другого фермента PFK-2, который катализирует в другом метаболическом пути образование фруктозо-2,6-бисфосфата из фруктозо-6-фосфата. Во внутриклеточных условиях реакция, катализируемая PFK-1, необратима; это первый «контрольный пункт» гликолиза. Глю- козо-6-фосфат и фруктозо-6-фосфат могут претерпевать и другие превращения, однако фруктозо-1,6- бисфосфат задействован лишь в гликолизе.
Фосфофруктокиназы некоторых бактерий, простейших, а также, по-видимому, всех растений в качестве донора фосфатной группы для синтеза фруктозо-1,6-бисфосфата используют пирофосфат PPi, а не АТР:
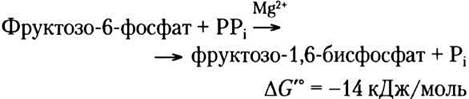
Фосфофруктокиназа-1 — один из ферментов со сложной аллостерической регуляцией. Его активность возрастает всякий раз, когда в клетке уменьшаются запасы АТР или начинают накапливаться продукты его распада — ADP и особенно АМР. Напротив, фермент ингибируется, когда в клетке оказывается достаточное количество АТР, а также других топливных молекул, например жирных кислот. У некоторых организмов фруктозо-2,6-бисфосфат (не путайте с фруктозо- 1,6-бисфосфатом, образующимся при действии PFK-1) является мощным аллостерическим активатором PFK-1. Рибулозо-5-фосфат, промежуточное соединение пентозофосфатного пути, который обсуждается ниже в данной главе, также косвенным путем активирует фосфофруктокиназу. Более подробно разные уровни регуляции этой стадии гликолиза обсуждаются в гл. 15.
(4) Расщепление фруктозо-1,6-бисфосфата.
Фермент фруктозодифосфатальдолаза, который часто называют просто альдолазой, катализирует обратимую реакцию альдольной конденсации (см. рис. 13-4). Фруктозо-1,6-бисфосфат расщепляется с образованием двух триозофосфатов — альдозы глицеральдегид-3-фосфата и кетозы дигидроксиацетонфосфата:
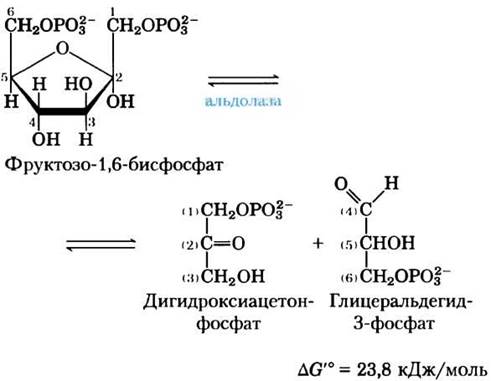
Существует два класса альдолаз. Альдолазы I, обнаруженные в клетках растений и животных, действуют в соответствии с механизмом, изображенным на рис. 14-5. Ферменты класса II, присутствующие в грибах и бактериях, не образуют основания Шиффа в качестве промежуточного соединения. Ион цинка в активном центре этих ферментов координирован с карбонильным кислородом у атома С-2; Zn2+ поляризует карбонильную группу и стабилизирует енольное производное, образующееся при расщеплении связи С-С.
Рис. 14-5. Механизм реакции. Реакция, катализируемая альдолазой I. Здесь изображена реакция, обратная альдольной конденсации. Обратите внимание, что расщепление связи между С-3 и С-4 зависит от наличия карбонильной группы у атома С-2. А и В — аминокислотные остатки.
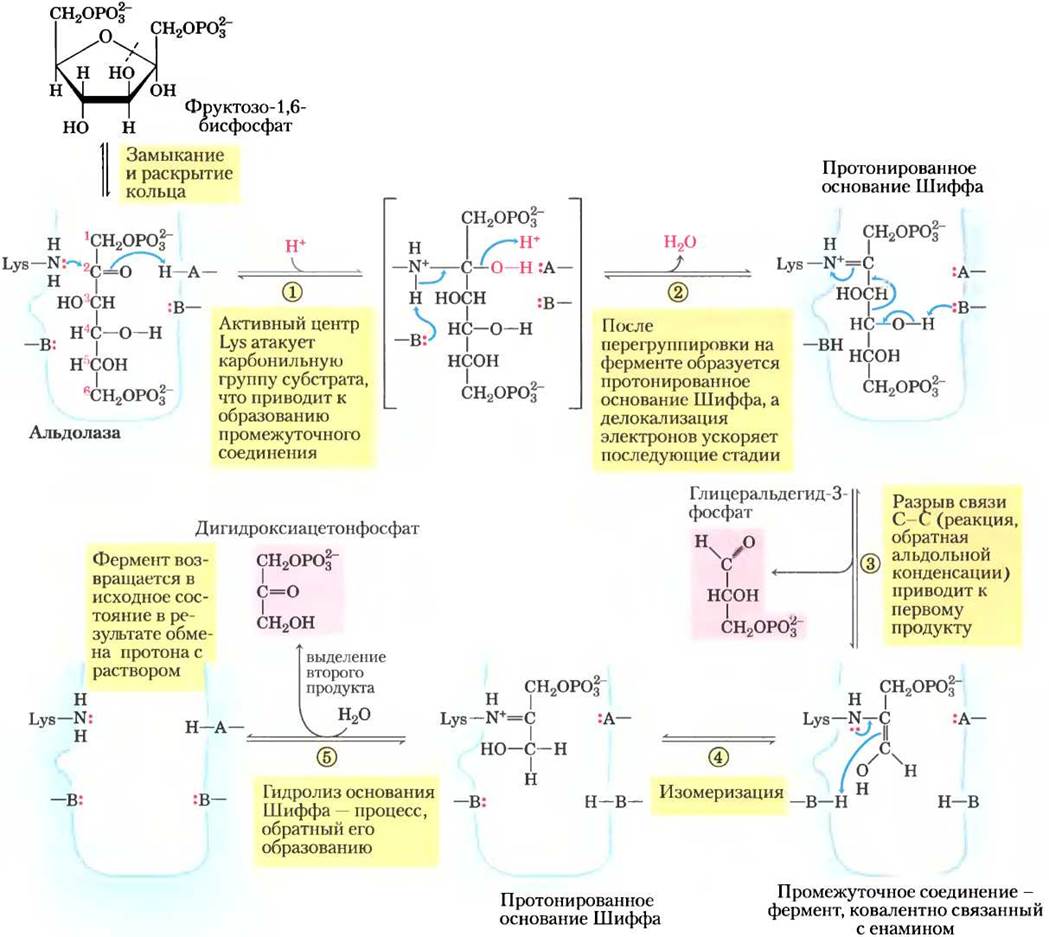
Хотя реакция расщепления фруктозо-1,6- бисфосфата характеризуется положительным изменением стандартной свободной энергии, при низких внутриклеточных концентрациях реагирующих веществ реальное изменение свободной энергии невелико, поэтому альдолазная реакция может протекать в обоих направлениях. Далее мы увидим, что в глюконеогенезе альдолаза катализирует обратную реакцию (см. рис. 14-16).
Рис. 14-6. Судьба атомов углерода при превращении глюкозы в глицеральдегид-3-фосфат. а — происхождение атомов углерода у двух трехуглеродных продуктов в реакциях, катализируемых альдолазой и триозофосфатизомеразой. Конечный продукт этих двух реакций — глицералъдегид-3-фосфат (2 молекулы). б — в молекуле глицеральдегид-3-фосфата атомы углерода происходят из одного из двух определенных атомов углерода молекулы глюкозы. Заметьте, что нумерация атомов глицеральдегид-3-фосфата отличается от нумерации углеродной цепочки в глюкозе, из которой он образован. В молекуле глицеральдегид-3-фосфата углерод наиболее сложной функциональной группы (карбонильной группы) имеет первый номер, С-1. Подобное изменение нумерации важно учитывать при интерпретации результатов экспериментов с глюкозой, несущей один меченный изотопной меткой углерод (см. в конце главы задачи 3 и 5).
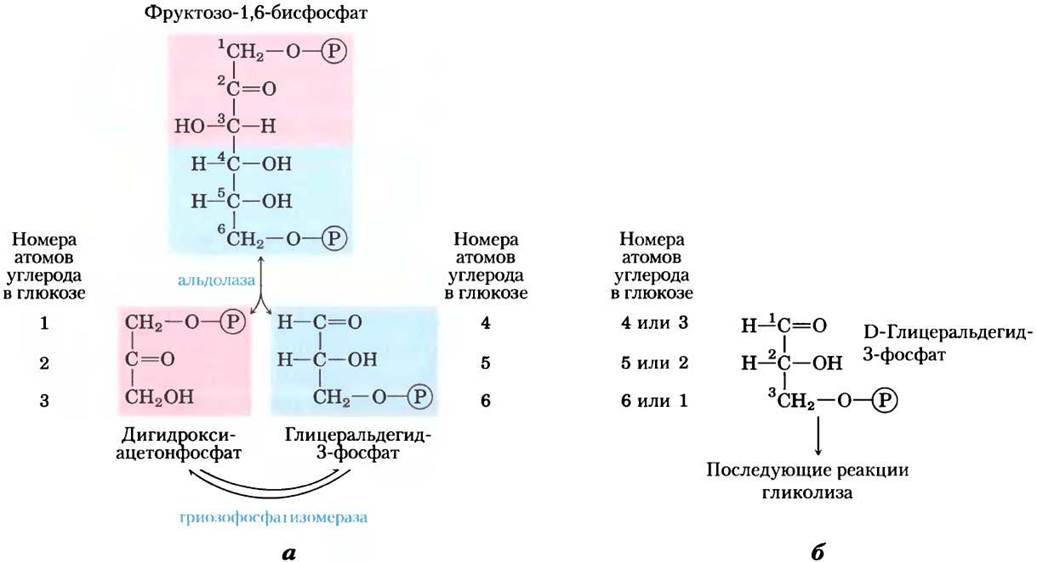
(5) Взаимопревращения триозофосфатов.
В последующих стадиях гликолиза непосредственное участие может принимать лишь один из двух триозофосфатов, образованных альдолазой, а именно, глицеральдегид-3-фосфат. Другой продукт дигидроксиацетонфосфат быстро и обратимо превращается в глицеральдегид-3-фосфат под действием пятого фермента гликолиза триозофосфатизомеразы:
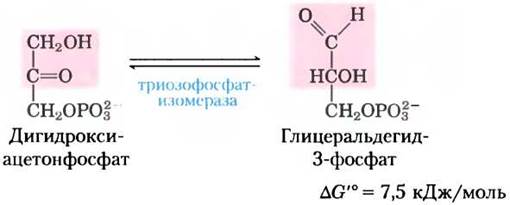
Механизм этой реакции аналогичен механизму катализируемой фосфоглюкоизомеразой реакции (2) (рис. 14-4). Последействия триозофосфат- изомеразы в исходной молекуле глюкозы атомы С-1, С-2 и С-3 химически неразличимы от атомов С-4, С-5 и С-6 соответственно (рис. 14-6) — обе «половинки» молекулы глюкозы превращаются в глицеральдегид-3-фосфат.
Этой реакцией завершается подготовительная стадия гликолиза: фосфорилирование молекулы гексозы по положениям 1 и 6 и ее расщепление с образованием двух молекул глицеральдегид-3-фосфата.
На второй стадии гликолиза образуются АТР и NADH
Вторая (возвратная) стадия гликолиза (стадия «выплаты процентов», рис. 14-2,6) включает реакции фосфорилирования, в ходе которых часть свободной энергии из исходной молекулы глюкозы запасается в форме АТР. Выше мы показали, что из одной молекулы глюкозы получаются две молекулы глицеральдегид-3-фосфата, которые претерпевают дальнейшие превращения на второй стадии гликолиза. Превращение двух молекул глицеральдегид-3-фосфата в две молекулы пирувата сопровождается образованием четырех молекул АТР из ADP. Однако в расчете на одну молекулу глюкозы суммарный выход АТР составляет лишь две молекулы, поскольку две молекулы АТР были израсходованы на подготовительной стадии гликолиза для фосфорилирования двух концевых углеродов молекулы гексозы.
(6) Окисление глицеральдегид-3-фосфата до 1,3- бисфосфоглицерата.
Первая реакция на второй стадии гликолиза — окисление глицеральдегид- 3-фосфата до 1,3-бисфосфоглицерата, катализируемое глицеральдегидфосфатдегидрогеназой:
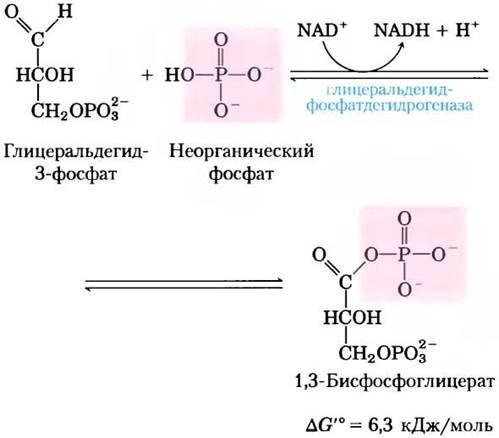
Это первая из двух реакций гликолиза, которые ведут к запасанию энергии в виде АТР. В результате данной реакции альдегидная группа глицеральдегид-3-фосфата окисляется, но образуется не свободная карбоксильная группа, а смешанный ангидрид фосфорной и карбоновой кислот. Ангидрид такого типа, называемый ацилфосфатом,характеризуется очень высокой стандартной свободной энергией гидролиза (∆G′° = -49,3 кДж/моль; см. рис. 13-4, табл. 13-6). В ацилфосфатной группе у атома С-1 в 1,3-бисфосфоглицерате сохраняется большая часть энергии от окисления альдегидной группы глицеральдегид-3-фосфата.
В ходе реакции глицеральдегид-3-фосфат остается ковалентно связанным с ферментом (рис. 14-7). Альдегидная группа глицеральдегид- 3-фосфата реагирует с -SH-группой остатка Cys в активном центре фермента; эта реакция напоминает образование полуацеталя (см. рис. 7-5), но в данном случае образуется тиополуацеталь. Взаимодействие остатка Cys, играющего важную роль в катализе, с ионами тяжелых металлов, такими как Hg+, приводит к необратимому ингибированию фермента.
Количество NAD+ в клетке (≤10-5 М) значительно меньше количества глюкозы, метаболизируемой за несколько минут. Если бы образующийся на этой стадии гликолиза NADHпостоянно не окислялся и не использовался вновь, гликолиз очень скоро остановился бы. О рецикле NAD+ мы поговорим чуть позже.
Рис. 14-7. Механизм реакции. Реакция, катализируемая глицеральдегид-3-фосфатдегидрогеназой.
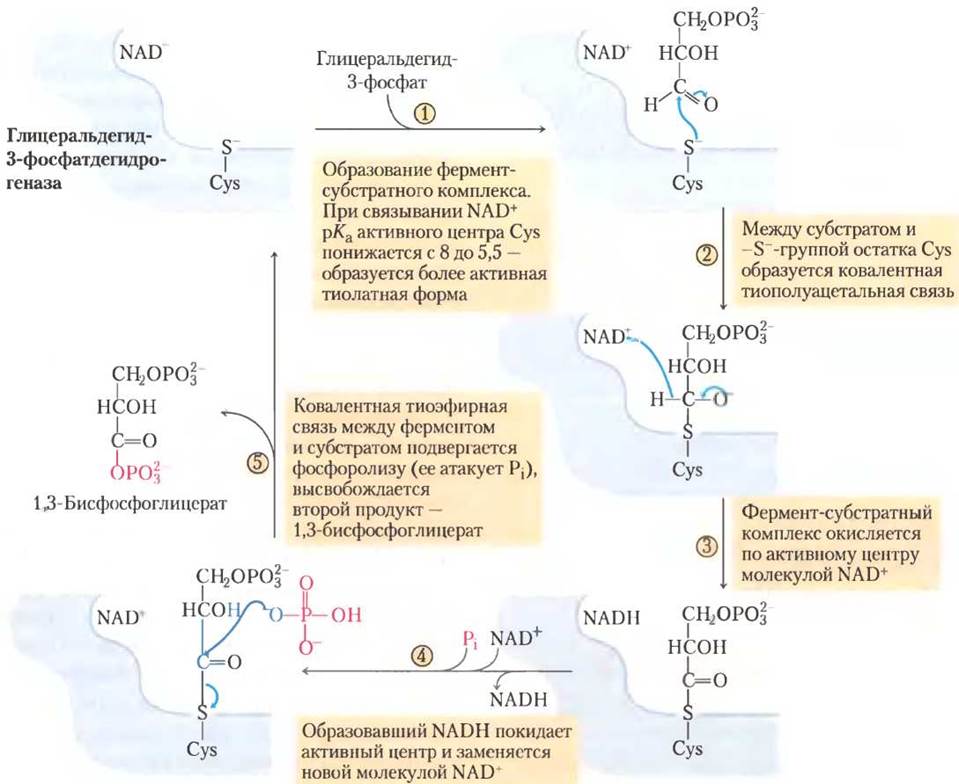
(7) Перенос фосфатной группы с 1,3-бисфосфо- глицерата на ADP.
Фермент фосфоглицераткиназа катализирует перенос высокоэнергетической фосфатной группы от карбоксильной группы 1,3-бисфосфоглицерата на ADP, в результате чего образуются АТР и 3-фосфоглицерат.
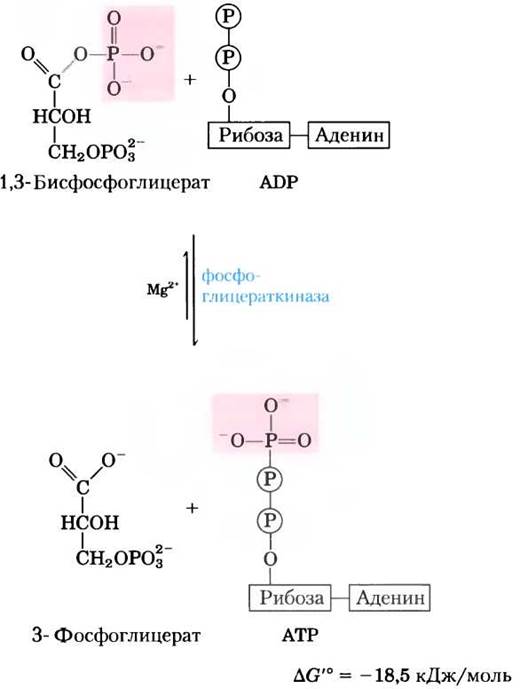
Обратите внимание, что название фермента фос- фоглицераткиназы соответствует обратной реакции, когда фосфорильная группа переносится с АТР на 3-фосфоглицерат. Как и все ферменты, фосфоглицераткиназа катализирует реакцию в обоих направлениях. В соответствии со своим названием данный фермент действует в реакциях глюконеогенеза (см. рис. 14-16) и фотосинтетической ассимиляции СО2 (см. рис. 20-4). При гликолизе катализируемая этим ферментом реакция протекает в направлении синтеза АТР, как указано выше.
Реакции гликолиза (6) и (7) сопряжены друг с другом, поскольку имеют общий промежуточный продукт 1,3-бисфосфоглицерат, образующийся в первой (эндергонической) реакции и отдающий свою ацилфосфатную группу АТР во второй (экзергонической) реакции. Суммарное уравнение этих двух реакций выглядит следующим образом:
Глицеральдегид-3-фосфат + ADP + Pi + NAD+ ⇄ 3-фосфоглицерат + АТР + NADH + Н+ ∆G′° = -12,5 кДж/моль
Таким образом, суммарная реакция характеризуется отрицательным изменением стандартной свободной энергии.
Как обсуждалось в гл. 13, реальное изменение свободной энергии ∆G зависит от изменения стандартной свободной энергии ∆G′° и отношения действующих масс Q — отношение произведения концентраций продуктов к произведению концентраций реагирующих веществ (см. уравнение 13-4). Для реакции (6) можно записать:
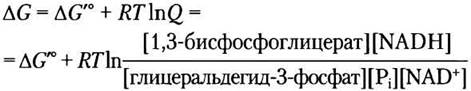
Обратите внимание, что [Н+] не входит в параметр Q, поскольку при биохимических расчетах [Н+] считают постоянной величиной (10-7 М) и включают в ∆G′° (с. 15).
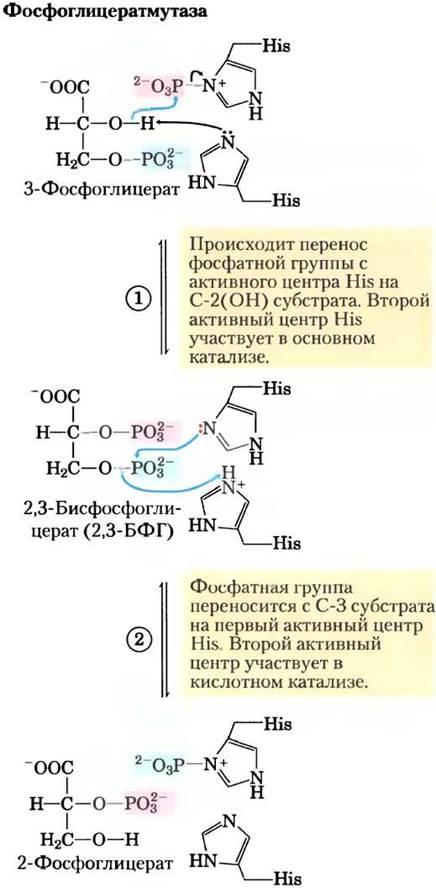
Рис. 14-8. Реакция, катализируемая фосфоглицерат- мутазой.
Если Q <1, то In Q <0. Потребление продукта реакции (6) (1,3-бисфосфоглицерата) в реакции (7) приводит к тому, что в стационарном состоянии концентрация 1,3-бисфосоглицерата довольно низкая, следовательно, для всего процесса с сопряжением энергии Q — малая величина. Тогда множитель InQ имеет знак минус, а изменение свободной энергии (∆G) — большая отрицательная величина. Таким образом, мы еще одним способом показали, как происходит сопряжение реакций (6) и (7), имеющих общее промежуточное соединение.
Конечным результатом этих двух сопряженных реакций, обратимых в условиях клетки, является то, что энергия, высвобождаемая при окислении альдегидной группы до карбоксильной, запасается в ходе сопряженного образования АТР из ADP и Pi. Синтез АТР в результате переноса фосфорильной группы от субстрата 1,3-бисфосфоглицерата называют фосфорилированием на уровне субстрата в отличие от механизма окислительного фосфорилирования. В фосфорилировании на уровне субстрата принимают участие растворимые ферменты и химические интермедиаты (в нашем случае 1,3- бисфосфоглицерат), тогда как окислительное фосфорилирование связано с переносом протонов через мембрану с участием мембраносвязанных ферментов (гл. 19).
(8) Превращение 3-фосфоглицерата в 2-фосфоглицерат.
Фермент фосфоглицератмутаза катализирует обратимый перенос фосфорильной группы между атомами С-2 и С-3 в молекуле глицерата; важную роль в данной реакции играют ионы Mg2+:
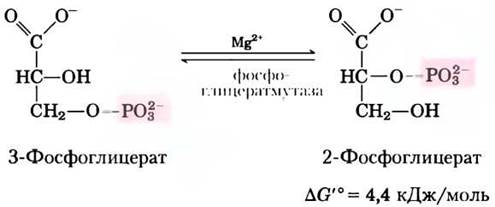
Реакция протекает в две стадии (рис. 14-8). Сначала фосфорильная группа, связанная с остатком His в молекуле фермента, переносится на гидроксильную группу у атома С-2 3-фосфоглицерата, в результате чего образуется 2,3-бисфосфоглицерат (2,3-БФГ). Затем фосфатная группа у атома С-3 2,3-БФГ переносится на тот же остаток His, образуется 2-фосфоглицерат и высвобождается фосфо- рилированный фермент. Фосфоглицератмутаза фосфорилирована — фосфатная группа от 2,3-БФГ; для начала каталитического цикла необходимо небольшое количество последнего, поэтому 2,3-БФГ постоянно возобновляется в ходе реакции.
(9) Дегидратация 2-фосфоглицерата с образованием фосфоенолпирувата.
Это вторая реакция гликолиза, в которой образуется соединение, способное активно участвовать в переносе фосфорильной группы (первая — реакция (6)). Фермент енолазакатализирует обратимое удаление молекулы воды от 2-фосоглицерата, что приводит к образованию фосфоенолпирувата (ФЕП):
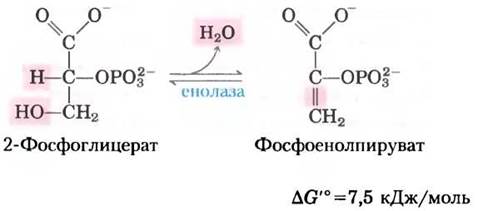
Механизм реакции, катализируемой енолазой, включает образование енольного интермедиата, который стабилизируется ионами Mg2+ (рис. 6-23). Несмотря на сравнительно небольшое изменение стандартной свободной энергии в данной реакции, ∆G гидролиза фосфорильных групп исходного вещества и гидролиза продукта существенно различаются: -17,6 кДж/моль для 2-фосфоглицерата (низкоэнергетический эфир фосфорной кислоты) и -61,9 кДж/моль для фосфоенолпирувата (высокоэнергетическое фосфорилированное соединение) (см. рис. 13-3, табл. 13-6).
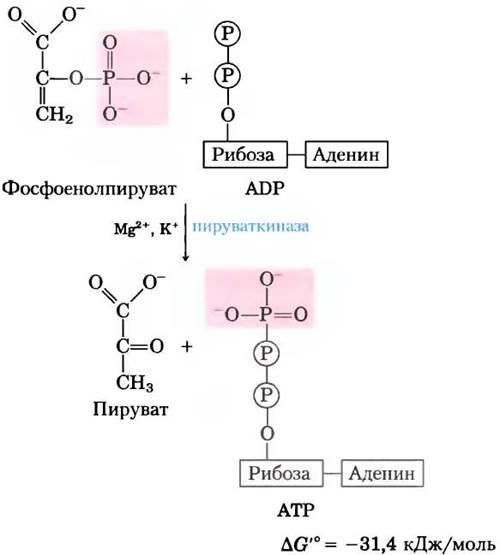
(10) Перенос фосфорильной группы от фосфоенолпирувата на ADP.
Последняя стадия гликолиза состоит в переносе фосфорильной группы с фосфоенолпирувата на ADP под действием пируваткиназы, для активности которой необходимо присутствие К+, а также Mg2+ или Мn2+:
В данной реакции фосфорилирования на уровне субстрата продукт реакции (пируват) сначала появляется в енольной форме, а затем подвергается быстрой неферментативной таутомеризации, превращаясь в кетоформу, преобладающую при pH 7:
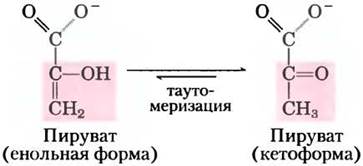
Суммарная реакция характеризуется большим отрицательным значением изменения стандартной свободной энергии, что в значительной степени связано с самопроизвольным превращением енольной формы пирувата в кетоформу (см. рис. 13-3). Для реакции гидролиза фосфоенолпирувата ∆G'° = -61,9 кДж/моль. Почти половина этой энергии запасается в фосфоангидридной связи молекулы АТР (-30,5 кДж/моль), а другая часть (-31,4 кДж/моль) выступает движущей силой, смещающей равновесие реакции в сторону образования АТР. Во внутриклеточных условиях реакция, катализируемая пируваткиназой, практически необратима и выполняет важную роль в регуляции (см. гл. 15).
Выигрыш в ATP заметен при составлении полного баланса гликолиза
Составим полный материальный баланс гликолиза. При этом надо учесть следующее: 1) превращения углеродного скелета глюкозы; 2) расход Рi и ADP и выход АТР; 3) пути переноса электронов в окислительно-восстановительных реакциях. В левой части уравнения запишем все вещества, расходуемые в процессе гликолиза, а именно ATP, NAD+, ADP и Pi (см. рис. 14-2), а в правой части — все продукты гликолиза (помните, что из каждой молекулы глюкозы образуется две молекулы пирувата).
Глюкоза + 2 АТР + 2 NAD+ + 4 ADP + 2 Pi —> 2 пируват + 2 ADP+2 NADH + 2 Н++4 ATP+2 Н2O
Вычитая из левой и правой части уравнения одинаковые слагаемые, получаем общее уравнение гликолиза в аэробных условиях:
Глюкоза + 2 NAD+ + 2 ADP + 2 Pi—> 2 пируват + 2 NADH + 2 Н+ + 2 АТР + 2 Н2O
Две молекулы NADH, образующиеся в цитозоле в процессе гликолиза, в аэробных условиях вновь окисляются до NAD+путем переноса своих электронов по электронтранспортной цепи, что в эукариотических клетках происходит в митохондриях. По электронтранспортной цепи электроны направляются к месту назначения — молекуле О2:
2 NADH + 2 Н+ + O2 —> 2 NAD+ + 2 Н2O
Перенос электронов от NADH на O2 в митохондриях обеспечивает энергию, необходимую для синтеза АТР путем окислительного фосфорилирования (гл. 19).
Итак, при гликолизе из одной молекулы глюкозы образуются две молекулы пирувата (путь превращения углерода). Две молекулы ADP и две молекулы Pi превращаются в две молекулы АТР (путь превращения фосфорильных групп). Четыре электрона в виде двух гидрид-ионов переносятся от двух молекул глицеральдегид-3-фосфата на две молекулы NAD+ (путь переноса электронов).
Гликолиз находится под строгим контролем
При изучении сбраживания глюкозы дрожжами Луи Пастер обнаружил, что скорость потребления глюкозы и общее количество потребляемой глюкозы в анаэробных условиях во много раз выше, чем в аэробных. Позже исследования на мышечной ткани выявили столь же значительное различие в скоростях анаэробного и аэробного гликолиза. Сегодня биохимические причины «эффекта Пастера» понятны. Выход АТР при гликолизе в анаэробных условиях (2 молекулы на молекулу глюкозы) гораздо ниже, чем при полном окислении глюкозы до СO2 в аэробных условиях (30 или 32 молекулы АТР на молекулу глюкозы; см. табл. 19-5). Таким образом, для образования одного и того же количества АТР в анаэробном процессе должно расщепляться примерно в 15 раз больше глюкозы, чем в аэробном.
Количество глюкозы, распадающейся в процессе гликолиза, регулируется так, чтобы поддерживать примерно постоянный уровень (концентрацию) АТР (и интермедиатов гликолиза, участвующих в биосинтезе). Необходимый контроль скорости гликолиза достигается благодаря сложной взаимосвязи между расходованием АТР, регенерацией NADH, аллостерической регуляцией некоторых гликолитических ферментов (в том числе гексокиназы PFK-1 и пируваткиназы); концентрации ключевых метаболитов испытывают ежесекундные колебания при поддержании внутриклеточного баланса потребления и образования АТР. В несколько более длительном временном диапазоне гликолиз регулируется с помощью гормонов (глюкагона, адреналина и инсулина), а также путем изменения экспрессии генов некоторых гликолитических ферментов. Особый интерес представляет аномальная регуляция гликолиза при злокачественных новообразованиях. Немецкий биохимик Отто Варбург в 1928 г. обратил внимание на то, что почти во всех опухолевых тканях гликолиз происходит с более высокими скоростями, чем в нормальных тканях, даже при достаточном количестве кислорода. Это наблюдение положено в основу некоторых методов диагностирования и лечения онкологических заболеваниях (доп. 14-1).
Варбурга часто считают самым выдающимся биохимиком первой половины XX в. Он внес существенный вклад в развитие многих направлений, в том числе известны его исследования в области дыхания, фотосинтеза, энзимологии и промежуточного метаболизма. Начиная с 1930 г. Варбург с коллегами выделили и получили в крис
таллическом виде семь ферментов, участвующих в гликолизе. Этими же учеными создан прибор, который совершил переворот в традиционных методах изучения окислительного метаболизма. С помощью манометра Варбурга можно определить потребление кислорода в тканях, измеряя изменения объема газа во времени, и по этим данным рассчитать концентрацию ферментов с окислительной активностью.
В лаборатории Эмиля Фишера (Нобелевская премия по химии в 1902 г.) Варбург изучал химию углеводов, а сам стал лауреатом Нобелевской премии по физиологии и медицине в 1931 г. Ряд учеников и сподвижников Варбурга также были награждены Нобелевской премией, среди них Отто Мейергоф (1922), Ханс Кребс и Фриц Липманн (1953) и Хуго Теорелль (1955). В лаборатории Мейергофа обучался Липманн и некоторые другие лауреаты Нобелевской премии: Северо Очоа (1959), Андре Львов (1965) и Джордж Уолд (1967).

Дополнение 14-1. МЕДИЦИНА. Высокая скорость гликолиза в опухолевых тканях лежит в основе методов химиотерапии при некоторых онкологических заболеваниях и облегчает постановку диагноза
Во многих типах опухолей у человека и животных потребление глюкозы и гликолиз происходят приблизительно в 10 раз быстрее, чем в нормальных тканях. Большинство опухолевых клеток существует в условиях гипоксии (т. е. при недостаточном содержании кислорода), поскольку в начале развития опухоли капиллярная сеть недостаточно развита и не может доставлять необходимое количество кислорода. В опухолевых клетках, расположенных на расстоянии более 100-200 мкм от ближайшего капилляра, образование АТР полностью зависит от гликолиза (без последующего окисления пирувата). Энергетический выход (две молекулы АТР на молекулу глюкозы) значительно ниже того, что можно получить при полном окислении пирувата до СO2 в митохондриях (-30 молекул АТР на молекулу глюкозы; см. гл. 19). Чтобы получить такое же количество АТР, опухолевые клетки вынуждены потреблять больше глюкозы, чем нормальные клетки, превращая ее в пируват, а затем в лактат с рециклом NADH. Возможно, вначале трансформации нормальных клеток в опухолевые, во-первых, производство АТР переходит на зависимость от гликолиза и, во-вторых, во внеклеточной жидкости развивается толерантность к низким pH (что обусловлено образованием молочной кислоты — конечного продукта гликолиза). Обычно чем агрессивнее опухоль, тем выше в ней скорость гликолиза.
Эта активизация гликолиза в какой-то степени достигается благодаря увеличению продукции гликолитических ферментов и мембранных переносчиков GLUT1
и GLUT3 (см. табл. 11-3), переносящих глюкозу внутрь клетки. (Вспомните, что GLUT1 и GLUT3 не зависят от инсулина.) Индуцируемый гипоксией транскрипционный фактор-1 (hypoxia-inducible transcription factor, HIF-1) представляет собой белок, который действует на уровне синтеза мРНК, стимулируя производство не менее восьми ферментов гликолиза и переносчиков глюкозы при недостатке кислорода (рис. 1). При повышении скорости гликолиза опухолевые клетки способны выживать в анаэробных условиях до появления новых кровеносных сосудов. Еще один белок, индуцируемый HIF-1, это пептидный гормон фактор роста сосудистого эндотелия VEGF (vascular endothelial growthfactor), который стимулирует ускоренный рост кровеносных сосудов (ангиогенез) в опухоли.
Рис. 1. При анаэробном метаболизме глюкозы в опухолевых клетках образуется значительно меньше АТР (две молекулы АТР на молекулу глюкозы), чем при полном окислении до СO2, которое происходит в здоровых клетках в аэробных условиях (~30 молекул АТР на молекулу глюкозы). В результате опухолевые клетки вынуждены потреблять существенно больше глюкозы, чтобы получить то же количество АТР. В опухолевых тканях наблюдается значительная активация синтеза переносчиков глюкозы и гликолитических ферментов. Вещества, ингибирующие гексокиназу, глюкозо-6-фосфат-дегидрогеназу или транскетолазу, блокируют производство АТР в ходе гликолиза и в результате убивают раковые клетки, лишая их необходимой энергии.
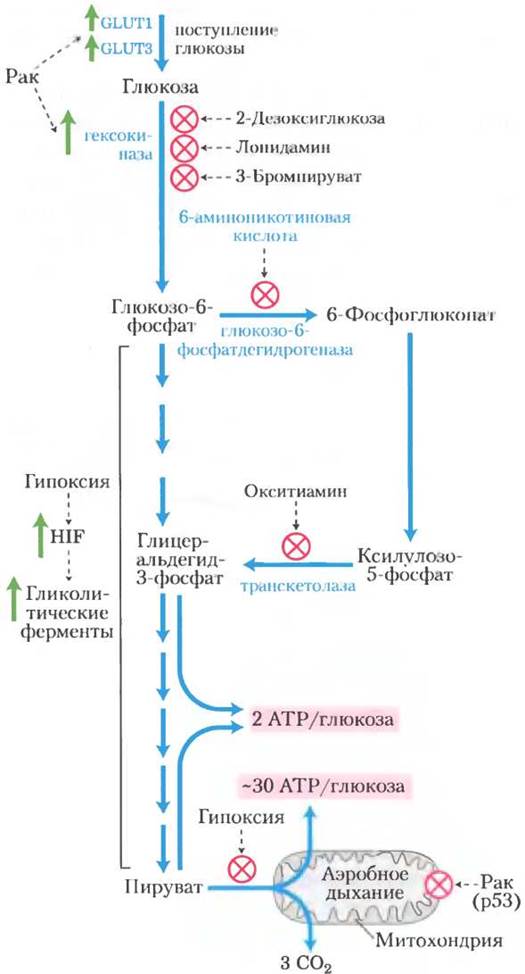
Кроме того, существуют доказательства того, что опухолевый супрессор р53, который при многих онкологических заболеваниях мутирует (т. 1, с. 670), контролирует синтез и сборку митохондриальных белков, необходимых для передачи электронов на молекулу кислорода. В клетках с мутантной формой р53 митохондриальный транспорт электронов нарушен, в связи с чем для образования АТР в этих клетках преобладает гликолиз (рис. 1).
Высокая зависимость опухолевых клеток от гликолиза по сравнению с нормальными клетками предоставляет возможность для разработки стратегии противоопухолевой химиотерапии: ингибиторы гликолиза могут находить и уничтожать опухолевые клетки путем ограничения в этих клетках запасов АТР. В настоящий момент известны три эффективных ингибитора гексокиназы, которые можно использовать в качестве химиотерапевтических агентов: 2-дезоксиглюкоза, лонидамин и 3-бромпируват. Предотвращая синтез глюкозо-6-фосфата, эти три вещества не только лишают опухолевые клетки образующегося при гликолизе АТР, но также препятствуют образованию пентозофосфатов в пентозофосфатном пути, который также начинается с глюкозо-6-фосфата. Без пентозофосфатов клетки не могут синтезировать важные для синтеза ДНК и РНК нуклеотиды и поэтому не могут расти и делиться. Еще одним противоопухолевым препаратом, уже допущенным к клиническому применению, является иматиниб (гливек; см. доп. 12-5). Он ингибирует специфическую тирозинкиназу, предотвращая активацию синтеза гексокиназы, которую обычно стимулирует эта тирозинкиназа. В настоящее время проходит фазу доклинических испытаний в качестве противоопухолевого препарата аналог тиамина окситиамин, блокирующий действие фермента транс-кетолазы, которая превращает ксилулозо-5-фосфат в глицеральдегид-3-фосфат (рис. 1).
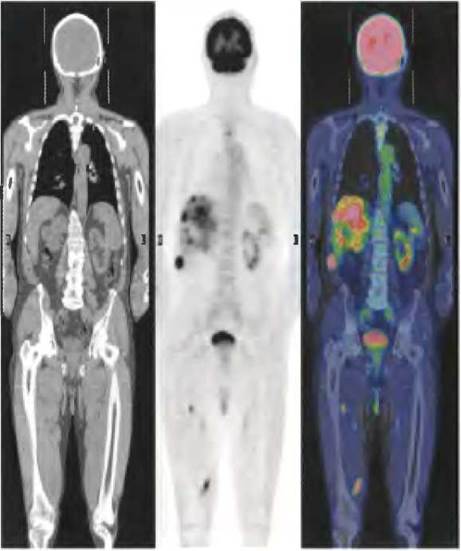
Высокая скорость гликолиза в опухолевых клетках имеет также диагностическое значение. Сравнение скоростей захвата глюкозы в различных участках ткани может помочь в локализации опухоли. При позитронно-эмиссионной томографии (ПЭТ) пациентам вводят неопасный для здоровья меченый аналог глюкозы, который захватывается, но не метаболизируется тканями. В качестве такого меченого соединения может использоваться 2-фтор-2-дезоксиглюкоза (ФДГ), в которой гидроксильная группа в положении С-2 глюкозы заменена на 18F (рис. 2). Это соединение захватывается транспортной молекулой GLUT и является хорошим субстратом для гексокиназы, но не может превращаться в ендиольное промежуточное соединение в реакции, катализируемой фосфогексозоизомеразой (см. рис. 14-4) и, следовательно, накапливается в виде 6-фосфо-ФДГ. Степень накопления этого вещества зависит от скорости его захвата и фосфорилирования, которая, как отмечалось ранее, обычно в 10 и более раз выше в опухолевых тканях, чем в здоровых тканях. При радиоактивном распаде 18F образуются позитроны (два на атом 18F), которые можно обнаружить с помощью серии чувствительных детекторов, расположенных вокруг тела человека, что позволяет достаточно точно локализовать зоны накопления 6-фосфо-ФДГ (рис. 3).
Рис. 2. Гексокиназа фосфорилирует 18F-меченую 2-фтор-2-дезоксиглюкозу (ФДГ или FdG), образующаяся меченая 6-фосфо-ФДГ проникает в клетки, где ее можно обнаружить по эмиссии позитронов из 18F.
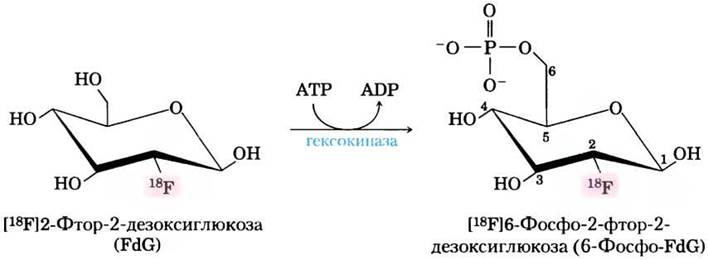
Рис. 3. Обнаружение опухолевой ткани методом позитронно-эмиссионной томографии (ПЭТ). Взрослому мужчине хирургическим путем удалили первичную опухоль кожи (злокачественную меланому). Слева — изображение, полученное с помощью компьютерной томографии (КТ-сканирование всего тела), видно расположение мягких тканей и костей. В центре — результаты ПЭТ после введения пациенту 18F-меченой 2-фтор- 2-дезоксиглюкозы (ФДГ). Темные пятна соответствуют областям с активным поглощением глюкозы. Как и ожидалось, высокое содержание метки наблюдается в области головного мозга и мочевого пузыря. Это связано с тем, что головной мозг является основным потребителем глюкозы в организме, а выведение 18F-меченой 6-фосфо- ФДГ осуществляется с мочой. Если интенсивность свечения метки при ПЭТ-сканировании представить в цветовом изображении (с увеличением интенсивности от зеленого цвета через желтый — к красному) и наложить эту картину на изображение, полученное методом КТ- сканирования, можно обнаружить наличие раковых клеток в верхних отделах позвоночника, в печени и некоторых мышцах (справа) из-за метастазирования первичной злокачественной опухоли.
Нарушение потребления глюкозы клетками при сахарном диабете I типа
Метаболизм глюкозы у млекопитающих ограничен скоростью потребления глюкозы клетками и ее фосфорилированием гексокиназой. Транспорт глюкозы из кровотока осуществляется при участии семейства переносчиков глюкозы GLUT (см. табл. 11-3). Переносчики глюкозы в гепатоцитах (GLUT1, GLUT2) и нейронах головного мозга (GLUT3) всегда присутствуют в плазматической мембране клеток. Напротив, основной переносчик глюкозы в клетках скелетных мышц, сердечной мышцы и жировой ткани (GLUT4) хранится в небольших внутриклеточных везикулах и перемещается к плазматической мембране только в ответ на сигнал инсулина (рис. 14-9). Механизм передачи сигнала с помощью инсулина мы обсуждали в гл. 12 (см. рис. 12-16). Таким образом, в скелетных мышцах, сердце и жировой ткани захват и метаболизм глюкозы зависят от нормальной выработки инсулина β -клетками поджелудочной железы в ответ на повышение уровня глюкозы крови (см. рис. 23-27).
Рис. 14-9. Метаболизм углеводов и жиров в адипоцитах при диабете I типа. В норме инсулин инициирует проникновение переносчиков глюкозы GLUT4 в плазматическую мембрану путем слияния содержащих GLUT4 везикул с мембраной, что позволяет осуществлять потребление глюкозы из кровотока. При снижении уровня инсулина в крови GLUT4 вновь включается в везикулы путем эндоцитоза. При инсулинозависимом диабете (диабете I типа) этот нормальный ход событий нарушается. Отсутствие инсулина предотвращает потребление глюкозы при помощи GLUT4; в результате клеткам не хватает глюкозы, а в крови ее содержание избыточно. Недостаток глюкозы для производства энергии приводит к тому, что адипоциты начинают расщеплять запасенные в виде жировых капелек триацилглицерины и поставлять образующиеся жирные кислоты другим тканям для выработки АТР в митохондриях. В печени образуются два побочных продукта этого процесса (ацетоацетат и β-гидроксибутират, см. с. 252), которые накапливаются и выделяются в кровь. Они служат источником энергии для головного мозга, но при этом происходит снижение pH крови, что вызывает кетоацидоз. Та же последовательность событий наблюдается и в мышечной ткани, за исключением того, что миоциты не запасают триацилглицерины, а вместо этого используют жирные кислоты, высвобождаемые в кровь адипоцитами.
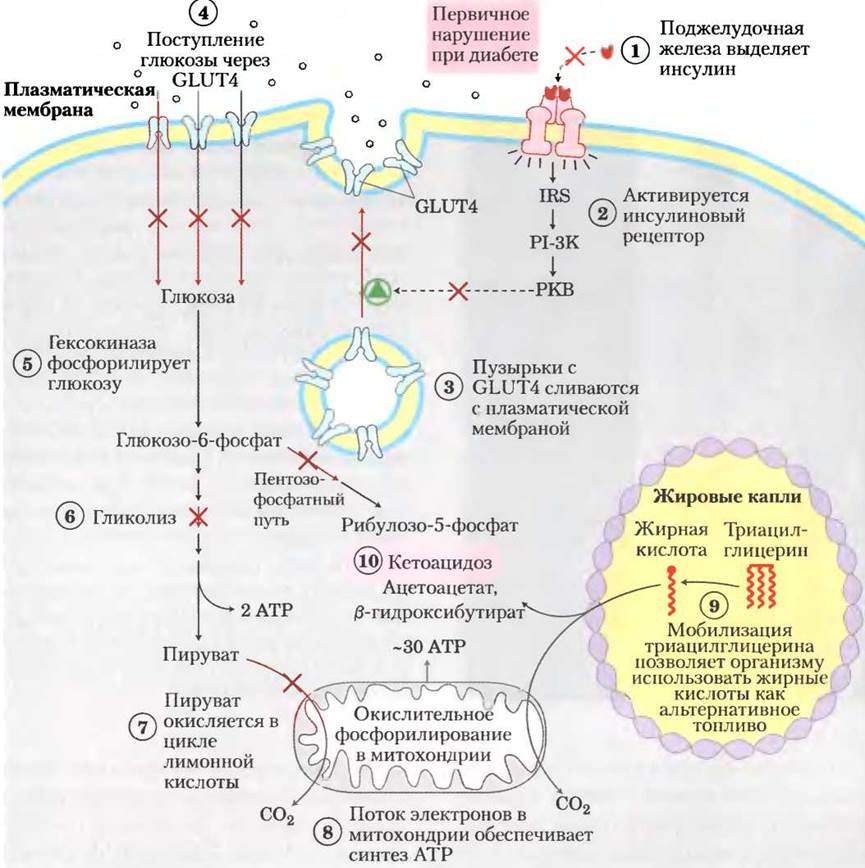
При сахарном диабете I типа (который также называют инсулинозависимым диабетом) слишком мало β -клеток, и поэтому в организме вырабатывается недостаточное количество инсулина для стимуляции потребления глюкозы клетками скелетных и сердечной мышц и клетками жировой ткани. После приема пищи, содержащей углеводы, уровень глюкозы крови повышается до аномально высоких показателей; такое состояние называют гипергликемией. Неспособные усваивать глюкозу мышечные и жировые ткани начинают использовать жирные кислоты из запасных триацилглице- ринов. В печени образующийся из этих жирных кислот ацетил-СоА превращается в кетоновые тела (ацетоацетат и (3-гидроксибутират), которые переносятся в другие ткани и служат в качестве источника энергии (гл. 17). Эти вещества играют особенно важную роль в головном мозге, который при недостатке глюкозы использует кетоновые тела как альтернативное топливо. (Жирные кислоты не могут проникать через гематоэнцефалический барьер и поэтому не могут быть источником энергии для нейронов головного мозга.)
Если больного диабетом I типа не лечить, избыточное образование ацетоацетата и β-гидроксибутирата приводит к их накоплению в крови, что сопровождается снижением pH крови и кетоацидозом, несущим угрозу для жизни больного. Инъекции инсулина обращают ход событий: GLUT4 перемещается в плазматическую мембрану гепатоцитов и адипоцитов, глюкоза потребляется клетками и фосфорилируется, уровень глюкозы крови снижается, что приводит к уменьшению выработки кетоновых тел.
При диабете значительно изменяется метаболизм как углеводов, так и жиров. Мы вновь обратимся к этой теме в гл. 23 после обсуждения метаболизма липидов (гл. 17 и 21). ■
Краткое содержание раздела 14.1 Гликолиз
■ Гликолиз — это практически универсальный процесс, в результате которого молекула глюкозы окисляется с образованием двух молекул пирувата, а энергия накапливается в виде АТР и NADH.
■ Все 10 ферментов гликолиза находятся в цитозоле, а все 9 интермедиатов представляют собой фосфорилированные соединения, состоящие из шести или трех атомов углерода.
■ На подготовительной стадии гликолиза для превращения глюкозы во фруктозо-1,6- бисфосфат расходуются две молекулы АТР. При разрыве связи между атомами С-3 и С-4 образуются две молекулы триозофосфата.
■ На второй стадии гликолиза каждая молекула глицеральдегид-3-фосфата, образовавшаяся из глюкозы, окисляется по атому С-1. Энергия, высвобождаемая в этой реакции, запасается в форме одной молекулы NADH и двух молекул АТР в пересчете на один окисленный триозофосфат. Суммарное уравнение гликолиза:
Глюкоза + 2 NAD+ + 2 ADP + 2 Рi —> 2 пируват + 2 NADH + 2 Н+ + 2 АТР + 2 Н2O
■ Гликолиз строго регулируется в соответствии с другими процессами, идущими с выигрышем в энергии, что обеспечивает постоянный уровень АТР.
■ При диабете I типа нарушение потребления глюкозы мышечной и жировой тканью оказывает большое влияние на метаболизм углеводов и жиров.