Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Фибриллярные белки
ß-Кератины имеют другую конформацию полипептидной цепи, называемую ß-структурой
ß-Кератины, в частности фиброин (белок шелка и паутины), тоже принадлежат к категории нитевидных нерастворимых белков; хотя они более гибки, вместе с тем с трудом поддаются растяжению. Они отличаются от а-кератинов тем, что имеют другую периодичность структуры, элементы которой повторяются через каждые 0,70 нм. Еще одно различие между а- и ß-кератинами сыграло важную роль в установлении структуры ß-кератинов. При обработке а-кератина волос паром его можно растянуть почти вдвое по сравнению с исходной длиной. В этом растянутом состоянии он дает рентгенограммы, напоминающие рентгенограммы, характерные для фиброина шелка. Отсюда был сделан вывод, что при растяжении а-кератин волос утрачивает а-спиральную конформацию и его полипептидная цепь приобретает вытянутую конформацию, почти вдвое превышающую по длине а-спираль. Это происходит потому, что в обработанном паром волосе разрываются водородные связи, стабилизирующие а-спираль, витки спирали распрямляются и принимают более вытянутую конформацию. Если а-кератину, обработанному паром, снова дать остыть и снять нагрузку, он самопроизвольно возвращается к исходной а- спиральной конформации.
Более вытянутая конформация полипептидных цепей в шелке, растянутом волосе и шерсти была установлена методом рентгеноструктурного анализа и названа ß-конформацией. Как показано на рис. 7-10, остов полипептидной цепи в ß-конформации вытянут таким образом, что имеет уже не спиральную, а зигзагообразную структуру. В фиброине зигзагообразные полипептидные цепи уложены параллельно друг другу в виде целого ряда складок; поэтому такая структура называется складчатым слоем (рис. 7-10). Для ß-конформации характерно отсутствие внутрицепочечных водородных связей. Вместо них образуются межцепочечные водородные связи между пептидными группами соседних полипептидных цепей, находящихся в вытянутой конформации. В образовании таких межцепочечных водородных связей участвуют все пептидные группы ß-кератина. R-группы аминокислот выступают по обе стороны зигзагообразной структуры, что хорошо видно при изображении полипептидной цепи в боковой проекции. Существуют еще два важных различия между а- и ß-кератинами. Во-первых в ß-кератинах нет поперечных цистиновых связей между соседними цепями, и, во-вторых, соседние полипептидные цепи в ß-кератинах обычно направлены в противоположные стороны, т.е. имеют антипараллельную ориентацию, тогда как для цепей а-кератина характерна параллельная ориентация (см. рис. 7-8).
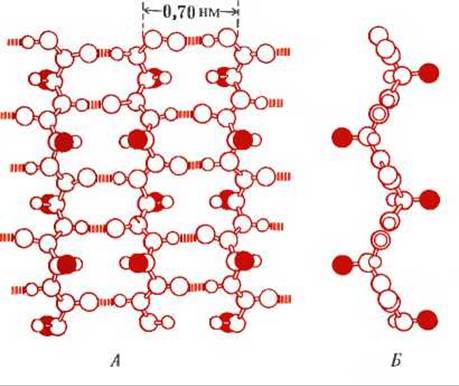
Рис. 7-10. ß-Конформация полипептидных цепей в ß-кератинах. А. Три цепи, образующие складчатый слой (вид сверху); показано расположение поперечных водородных связей между соседними цепями. R-группы выделены красным цветом. Б. Та же структура (вид сбоку); показано расположение R-гpyпп, выступающих по обе стороны складчатого слоя.
ß-Структура может образоваться только при наличии в составе полипептида соответствующих аминокислот, расположенных в определенной последовательности. Необходимо, в частности, чтобы R-группы аминокислотных остатков имели сравнительно небольшие размеры. Так, в фиброине шелка и других ß-кератинах, например в белке паутины, наблюдается очень высокое содержание глицина и аланина-аминокислот с наименьшими по размеру R-группами. Примечательно, что в фиброине шелка каждой второй аминокислотой является глицин.