Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Фибриллярные белки
Полипептиды в коллагене представляют собой трехцепочечные спиральные структуры
Фибриллы коллагена состоят из повторяющихся полипептидных субъединиц, называемых тропоколлагеном. Эти субъединицы уложены вдоль фибриллы в виде параллельных пучков по типу «голова к хвосту» (рис. 7-14). Головки параллельно расположенных молекул тропоколлагена сдвинуты относительно друг друга ступенчатым образом на одно и то же расстояние в продольном направлении. Этим объясняется характерная для коллагеновых волокон поперечная исчерченность, которой соответствует период 64 нм.
Коллагеновые волокна дают рентгенограмму, отличающуюся от рентгенограмм а- и ß-кератинов. На основе данных рентгеноструктурного анализа был сделан вывод, что тропоколлагеновые субъединицы состоят из трех полипептидных цепей, плотно скрученных в виде трехжильного каната.
Тропоколлаген представляет собой палочкообразную молекулу длиной 300 нм и толщиной всего лишь 1,5 нм. Его молекулярная масса составляет приблизительно 300000. Три спирально навитые друг на друга полипептидные цепи имеют равную длину, и в каждой из них содержится около 1000 аминокислотных остатков. В одних коллагенах все три цепи имеют одинаковую аминокислотную последовательность, тогда как в других идентичны только две цепи, а третья отличается от них. Достигнут весьма значительный прогресс в определении аминокислотной последовательности основных типов коллагеновых цепей, которые относятся к числу наиболее длинных из известных полипептидных цепей белков.
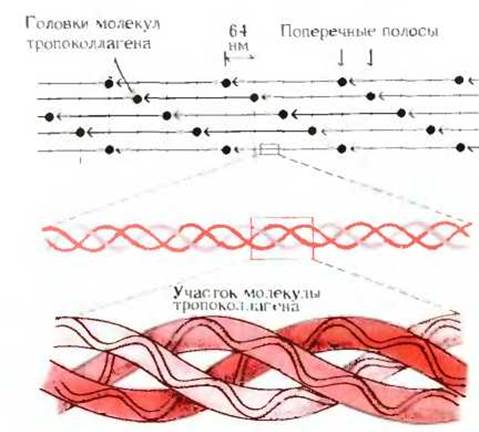
Рис. 7-14. Расположение молекул тропоколлагена в коллагеновых фибриллах.
В каждой молекуле тропоколлагена обнаруживаются четыре поперечные полосы, повторяющиеся с интервалом 64 нм. Головки молекул тропоколлагена расположены так, что они сдвинуты относительно друг друга на 64 нм. Ниже схематического изображения фибриллы показан участок молекулы тропоколлагена в виде остова тройной спирали. В самом низу дано еще более сильно увеличенное изображение тройной спирали, показывающее, что каждая из полипептидных цепей тропоколлагена также предоставляет собой спираль; шаг и период этой спирали определяются геометрией жестких R-групп многочисленных остатков пролина и гидроксипролина.
Рентгеноструктурные исследования показали, что каждая полипептидная цепь тропоколлагена тоже представляет собой спираль, хотя ее периодичность и размеры весьма отличаются от соответствующих параметров а-спирали. Полипептидная цепь тропоколлагена образует левую спираль, на один виток которой приходится только три аминокислотных остатка. Поскольку в коллагене присутствует много остатков Пронина и гидроксипролина, что придает цепи жесткую изогнутую конформацию, три спиральные полипептидные цепи плотно обвиты одна вокруг другой. Они соединены между собой также поперечными водородными связями. Кроме того, в коллагене обнаружены ковалентные связи необычного типа, образующиеся между двумя остатками лизина, находящимися в соседних цепях (рис. 7-15). Расположенные рядом друг с другом тропоколлагеновые тройные спирали тоже соединены поперечными связями. Тропоколлаген практически нерастяжим вследствие очень плотной скрученности его тройных спиралей, а также из-за наличия поперечных связей. Тропоколлаген содержит боковые углеводные цепи, присоединенные к гидроксильным группам гидроксилизина.
По мере того как мы становимся старше, в тропоколлагеновых субъединипах и между ними образуется все большее число поперечных связей, что делает фибриллы коллагена в соединительной ткани более жесткими и хрупкими. Поскольку коллаген присутствует в очень многих структурах, его увеличивающиеся при старении хрупкость и жесткость изменяют механические свойства хрящей и сухожилий, делают более ломкими кости и понижают прозрачность роговицы глаза.
Коллагеновая спираль уникальна, так как не встречается ни в каких других белках, кроме коллагена, в отличие от а-спирали и ß-конформации, которые хотя бы в виде небольших участков обнаруживаются во многих глобулярных белках.