Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Глобулярные белки: структура и функция гемоглобина
Глобулярные белки различных типов имеют неодинаковую структуру
Может быть, и все другие глобулярные белки свернуты точно так же, как миоглобин? На этот вопрос ответ уже получен, так как методом рентгеноструктурного анализа установлена третичная структура целого ряда других, небольших по размеру белков, состоящих из одной полипептидной цепи. Особенно интересны результаты, полученные при изучении митохондриального белка цитохрома с, который служит переносчиком электронов. Аминокислотная последовательность цитохрома с была определена более чем для 60 видов (разд. 6.10). Как и миоглобин, цитохром с - это небольшой гемсодержащий белок (мол. масса 12 400), имеющий одну полипептидную цепь, состоящую приблизительно из 100 аминокислотных остатков, и одну гемогруппу, которая в этом случае ковалентно связана с полипептидом. Подобно миоглобину, цитохром с тоже свернут в компактную глобулу, причем большинство его гидрофильных R-гpyпп расположено снаружи, а большинство гидрофобных R-групп - внутри глобулярной структуры. Поскольку и цитохром с, и миоглобин - гемсодержащие белки, можно было бы думать, что они сходны и по третичной структуре. Но это не так. Рентгеноструктурный анализ цитохрома с показал, что он имеет совсем иную трехмерную структуру (рис. 8-5 и табл. 8-2). Если в миоглобине почти 80% аминокислотных остатков содержится в а-спиральных сегментах, то в цитохроме с на долю а-спиралей приходится только 40% остатков. В остальной части полипептидной цепи цитохрома с находятся всевозможные изгибы, повороты, нерегулярные витки и сегменты в вытянутой конформации. Таким образом, хотя и цитохром с, и миоглобин оба представляют собой гемсодержащие белки, они сильно различаются как по вторичной и третичной структурам, так и по аминокислотным последовательностям в соответствии с их совершенно разными биологическими функциями.
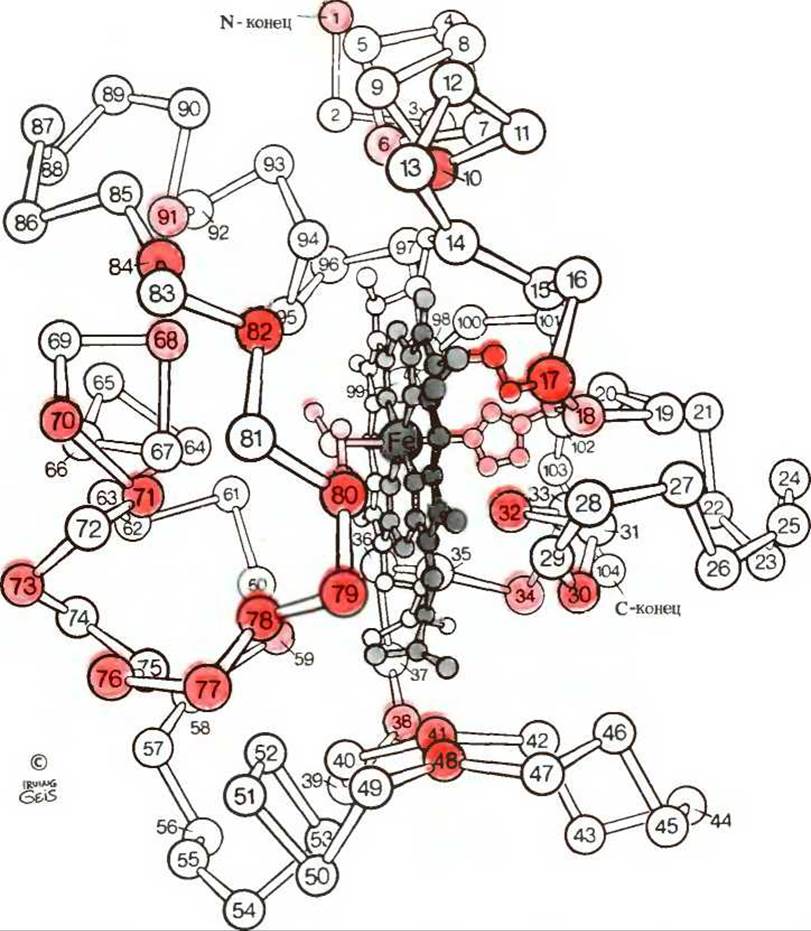
Рис. 8-5. Остов молекулы цитохрома с. Ковалентно связанная гемогруппа, показанная серым цветом, помещается в полости внутри молекулы. Красным цветом выделены инвариантные аминокислотные остатки.
В цитохроме с пятая и шестая координационные связи атома железа заняты R-группами остатков 18 и 80. В нормально функционирующем цитохроме с, участвующем в системе переноса электронов, атом железа попеременно находится в ферро- и ферриформе, т. е. в [Fe(II)]- и [Fe(III)]-форме.
Для сравнения можно рассмотреть третичную структуру еще двух небольших белков. Лизоцим - это фермент, содержащийся в яичном белке, а также в слезах человека. Он катализирует гидролитическое расщепление сложных полисахаридов, присутствующих в клеточных стенках некоторых бактерий. Лизоцим назван так потому, что он вызывает лизис, т.е. растворение, бактериальных клеточных стенок и, следовательно, может служить бактерицидным агентом. Подобно миоглобину и цитохрому с, лизоцим имеет компактно свернутую конформацию, причем большая часть его гидрофобных R-групп находится внутри глобулярной структуры, где они защищены от контактов с водой, а гидрофильные группы выступают наружу, в водную среду. Около 40% всех 129 аминокислотных остатков лизоцима содержится в а-спиральных сегментах (табл. 8-2), которые выстилают длинную полость, находящуюся на одной стороне молекулы. Эта полость представляет собой каталитический центр фермента. Как мы увидим в гл. 9, каждый фермент имеет каталитический центр, который связывает субстрат молекулу, подвергающуюся действию данного фермента. Во время каталитического акта бактериальный полисахарид, на который действует лизоцим, располагается в этой полости, плотно прилегая к ее внутренней поверхности. На рис. 8-6 представлена пространственная структура лизоцима, иллюстрирующая компактность структуры глобулярных белков.
Таблица 8-2 Приблизительное содержание а-спиралей и участков с ß-структурой в некоторых одноцепочечных белках1)
|
Белок |
Общее число остатков |
Число остатков, % |
|
|
а-спирали |
ß-структура |
||
|
Миоглобин |
153 |
78 |
0 |
|
Цитохром с |
104 |
39 |
0 |
|
Лизоцим |
129 |
40 |
12 |
|
Рибонуклеаза |
124 |
26 |
35 |
|
Химотропсин |
241 |
14 |
45 |
|
Карбоксипептидаза |
307 |
38 |
17 |
1) Участки полипептидных цепей, не относящиеся ни к а-спиралям, ни к ß-структуре, представляют собой изгибы или обратные повороты цепи, а также нерегулярно скрученные или вытянутые ее отрезки. а-Спиральные и ß-структурные сегменты иногда имеют слегка искаженные размеры и геометрию, отличающиеся от соответствующих нормальных параметров. Данные взяты из книги Cantor С. R. and Schimmel Р. R., Biophysical Chemistry, pt. 1, p. 100, Freeman, San Francisco, 1980.
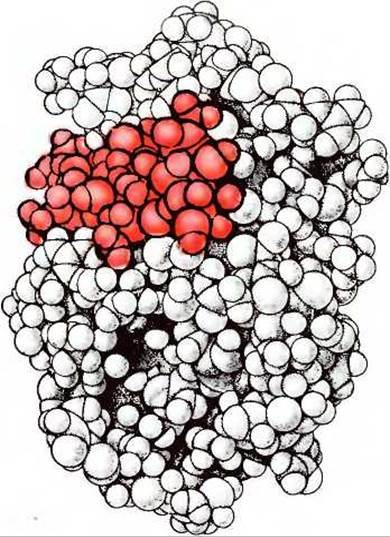
Рис. 8-6. Пространственная модель молекулы лизоцима, с которой прочно связана молекула полисахаридного субстрата (показана красным цветом). Обратите внимание на очень компактную форму молекулы лизоцима, внутри которой почти не остается свободного пространства. Другое изображение молекулы лизоцима см. на рис. 1 к дополнению 9-4 в гл. 9.
Рибонуклеаза, еще один глобулярный белок небольшого размера, представляет собой фермент, секретируемый клетками поджелудочной железы в тонкий кишечник, где он катализирует гидролиз некоторых связей в молекулах рибонуклеиновых кислот, содержащихся в перевариваемых пищевых продуктах. Третичная структура рибонуклеазы, установленная методом рентгеноструктурного анализа (рис. 8-7), характеризуется тем, что в ее полипептидной цепи имеется очень мало а-спиральных участков, но зато в ней есть достаточно большое число сегментов, находящихся в ß-конформации. В этом отношении рибонуклеаза отличается от миоглобина, цитохрома с и лизоцима. Однако, подобно лизоциму, она содержит четыре остатка цистина, образующих ковалентные дисульфидные связи между петлями полипептидной цепи. Это придает прочность всей нативной третичной структуре фермента (рис. 8-7). Такие внутрицепочечные дисульфидные связи имеются во многих белках, особенно в тех, которые функционируют вне клетки.
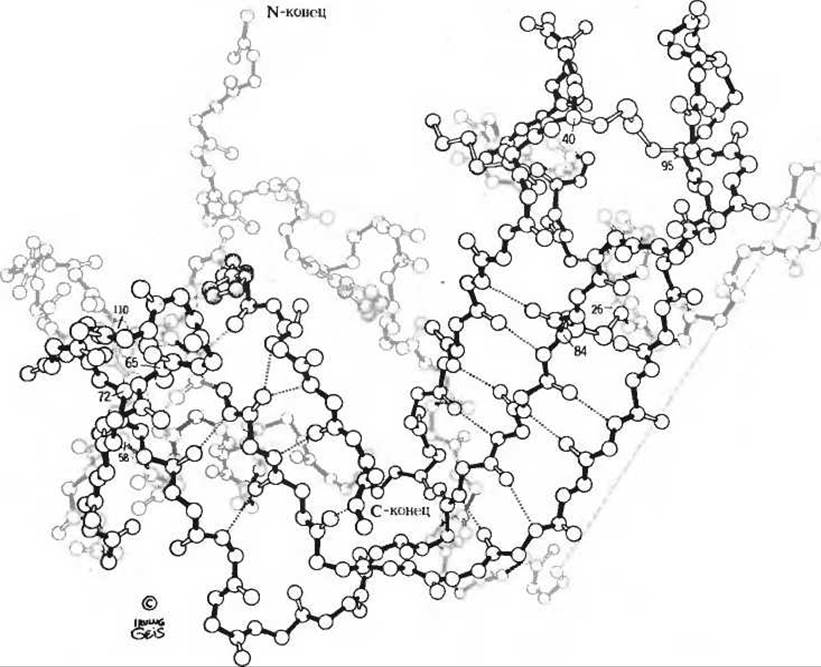
Рис. 8-7. Конформации молекулы рибонуклеази, установленная методом рентгеноструктурного анализа. Пунктирными линиями показаны водородные связи между петлями полипептидной цепи, уложенными в виде складчатого ß-слоя. Полость в середине верхней части молекулы служит центром связывания субстрата. Расположение внутрицепочечных дисульфидных поперечных связей показано на рис. 8-8.
Совершенно очевидно, что эти четыре одноцепочечных глобулярных белка небольших размеров существенно отличаются друг от друга (см. табл. 8-2). В них содержится разное число а-спиральных участков и сегментов, имеющих ß-конформацию; поэтому они различным образом свертываются в пространстве. Эти белки различаются также по аминокислотным последовательностям и выполняют совершенно разные биологические функции. Из данных, полученных при рентгеноструктурных исследованиях и определении аминокислотных последовательностей глобулярных белков многих типов, теперь хорошо известно, что каждый тип белков имеет характерную для него трехмерную конформацию, специально приспособленную для выполнения определенной биологической функции.