Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Глобулярные белки: структура и функция гемоглобина
Гемоглобин больных серповидноклеточной анемией имеет измененную аминокислотную последовательность
В конце 40-х годов Лайнус Полинг и Гарвей Итано обнаружили, что серповидноклеточный и нормальный гемоглобины, помещенные в электрическом поле, т.е. подвергнутые электрофорезу (разд. 6.6), мигрируют к положительно заряженному электроду с разными скоростями: гемоглобин S немного отстает от гемоглобина А. Исследователи сделали вывод, что гемоглобин S должен содержать несколько меньше отрицательно заряженных R-групп, чем гемоглобин А. Позднее Вернон Инграм придумал довольно простой экспериментальный способ, позволяющий более точно локализовать различия в полипептидных цепях гемоглобина S и гемоглобина А. Предложенный им метод пептидных карт и поныне широко используется для выявления генетических разновидностей не только гемоглобинов, но и других белков. Инграм обработал оба гемоглобина, S и А, трипсином, который разрывает только те пептидные связи, в которых карбоксильная группа принадлежит остаткам аргинина или лизина (разд. 6.7, в). Это привело к образованию пептидных фрагментов 28 сортов, поскольку в а- и ß-цепях содержится в общей сложности 27 остатков лизина и аргинина. Смесь пептидов, полученных при расщеплении каждого гемоглобина, была нанесена на фильтровальную бумагу, смоченную буферным раствором, и подвергнута электрофорезу, в результате чего пептидные фрагменты разделились, хотя и не полностью, на отдельные зоны. После того как фильтровальная бумага была высушена, через нее пропустили буферный раствор с другим значением pH для хроматографического разделения пептидных фрагментов в направлении, перпендикулярном направлению электрофореза (разд. 5.21). Когда бумага была снова высушена и в прогретом состоянии обработана нингидрином (разд. 5.19), получилась характерная двумерная пептидная карта со всеми пептидными фрагментами. Как видно из рис. 8-22, гемоглобин S отличается от гемоглобина А по положению на пептидных картах только одного пятна, из чего следует, что в гемоглобине S содержится всего лишь один пептид, отличающийся по своему заряду от соответствующего пептида гемоглобина А. Анализ элюированных из бумаги пептидов позволил Инграму сделать вывод, что они различаются только по одному аминокислотному остатку: в том положении полипептидной цепи, в котором пептид из нормального гемоглобина А содержит остаток глутаминовой кислоты, в смещенном пептиде из гемоглобина S находится остаток валина (рис. 8-22). Все остальные аминокислотные остатки в цепях гемоглобина S идентичны остаткам гемоглобина А. Оказалось, что «неправильный» остаток находится в положении 6 ß-цепей. Поскольку R-группа валина не имеет электрического заряда, а R-группа глутаминовой кислоты несет при pH 8 отрицательный заряд (рис. 8-23), ясно, что серповидноклеточный гемоглобин должен содержать на два отрицательных заряда меньше, чем гемоглобин А - по одному на каждую из двух ß-цепей молекулы гемоглобина. Из-за этой разницы гемоглобин S движется в электрическом поле несколько медленнее гемоглобина А.
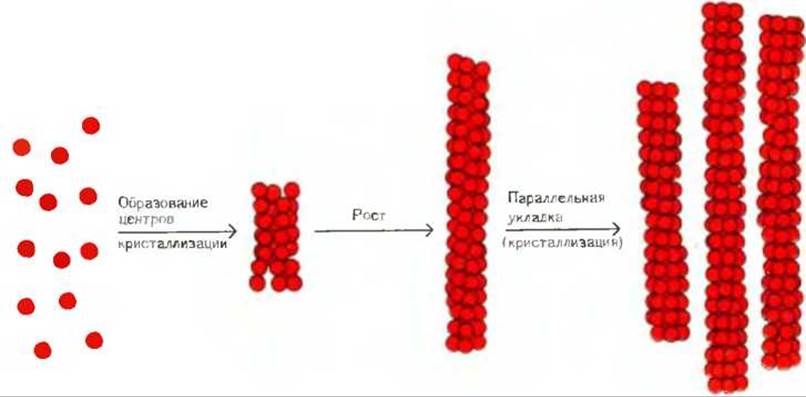
Рис. 8-21. Ассоциация молекул дезоксигемоглобина S. образующих пучки нерастворимых трубчатых нитей, которые придают эритроцитам искаженную серповидную форму.

Рис. 8-22. Пептидные карты трипсиновых пептидов гемоглобина А и гемоглобина S. На карте гемоглобина S смещено положение всего одного пептида (показанного красным цветом), содержащего генетически измененную аминокислоту.