Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Ферменты
Краткое содержание главы
Ферменты - это белки, катализирующие строго определенные химические реакции. Они связываются с молекулой субстрата, в результате чего образуется промежуточный фермент-субстратный комплекс, который затем распадается на свободный фермент и продукт реакции. При повышении концентрации субстрата S и постоянной концентрации фермента Е каталитическая активность последнего будет повышаться до тех пор, пока не достигнет характерной для данного фермента максимальной скорости Vmах, при которой практически весь фермент находится в форме комплекса ES и, следовательно, насыщен субстратом. Такая зависимость между концентрацией субстрата и скоростью ферментативной реакции описывается гиперболической кривой. Концентрация субстрата, при которой скорость реакции составляет половину величины Vmаx, получила название константы Михаэлиса-Ментен (КM). Эта константа является характеристикой каталитического действия фермента применительно к какому-то определенному субстрату. Уравнение Михаэлиса-Ментен
![]()
связывает скорость ферментативной реакции с концентрацией субстрата и величиной Vmax через константу КM. Это уравнение приложимо также к двухсубстратным реакциям, протекающим по механизму единичного или двойного замещения (механизм типа «пинг-понг»). Каждый фермент имеет оптимум pH, т. е. определенное значение pH, при котором его активность достигает максимального уровня. Все ферменты обладают строгой специфичностью по отношению к субстратам, на которые они действуют. Ферменты можно инактивировать путем необратимой модификации некоторых функциональных групп, имеющих важное значение для каталитической активности ферментов. Их можно также подвергнуть обратимому ингибированию по конкурентному или неконкурентному механизму. Конкурентные ингибиторы, по своей структуре напоминающие обычно субстрат, обратимо конкурируют с ним за связывание с активным центром, но в отличие от субстрата не претерпевают никаких превращений под действием фермента. Неконкурентные ингибиторы связываются не с активным центром, а с каким-то другим участком молекулы фермента. Они могут присоединяться как к свободному ферменту, так и к фермент- субстратному комплексу; их действие нельзя устранить путем добавления субстрата. Ферменты ускоряют химические реакции благодаря тому, что обеспечивают правильную ориентацию молекулы субстрата в непосредственной близости от каталитического центра, предоставляют для катализа протон-донорные и протон-акцепторные группы, образуют при помощи ковалентных связей нестабильные промежуточные соединения с субстратом и вызывают напряжение в молекуле субстрата или ее деформацию.
Кроме каталитической активности некоторые ферменты обладают также и регуляторной активностью. Они служат как бы «дирижерами», задающими темп метаболическим процессам. Некоторые регуляторные ферменты, называемые аллостерическими, регулируют скорость реакций путем обратимого нековалентного присоединения специфических модуляторов, или эффекторов, к регуляторному, или аллостерическому, центру фермента. Такими модуляторами могут быть либо сами субстраты, либо какие-то промежуточные продукты метаболизма. К другому классу относятся регуляторные ферменты, способные изменять свою активность путем ковалентной модификации содержащихся в них специфических функциональных групп, необходимых для активности фермента. Некоторые ферменты существуют в нескольких формах, называемых изоферментами, которые различаются по своим кинетическим характеристикам. Многие генетические заболевания человека обусловлены нарушением в результате мутаций функционирования одного или нескольких ферментов.
ЛИТЕРАТУРА
Книги
Barman Т. Enzyme Handbook, vol. 1, Springer-Verlag, New York, 1969. Полезная сводка данных об основных свойствах известных в то время ферментов, классифицированных в соответствии с международными правилами.
Enzyme Nomenclature, Academic, New York, 1979. Рекомендации Международной комиссии по ферментам.
Fersht A. Enzyme Structure and Mechanism, Freeman, San Francisco, 1977. Ясно описанное краткое введение в эту область науки. [Имеется перевод: Фёршт Э. Структура и механизм действия ферментов.-М.: Мир, 1982.]
Friedmann Н., Herbert (ed.). Benchmark Papers in Biochemistry, vol. 1, Enzymes, Hutchinson Ross, Stroudsburg, Pa., 1981. Сборник классических статей по химии ферментов с комментариями редактора. Чрезвычайно интересная книга.
Newsholme Е. A., Start С. Regulation in Metabolism, Wiley, New York, 1973. В главах 1 и 2 рассматриваются свойства регуляторных ферментов.
Segel L.H. Enzyme Kinetics: Behavior and Analysis of Rapid Equilibrium and Steady State Enzyme Systems, Wiley, New York, 1975. Для более подготовленных читателей.
Статьи
Anderson С. М, Zucker F. H., Steitz Т. A. Space- Filling Models of Kinase Clefts and Conformational Changes, Science, 204, 375-380 (1979). Структура гексокиназы и других ферментов, использующих АТР.
Dische Z. The Discovery of Feedback Inhibition, Trends Biochem. Sci, 1, 269 (1976).
Enzymes: One Hundred Years, FEBS Lett. Suppl, vol. 62 (1976).
Koshland D. E, Jr, Neet К. E. The Catalytic and Regulatory Properties of Enzymes, Annu. Rev. Biochem, 37, 359-410 (1968). Серия интересных статей, представленных по случаю 100-й годовщины изобретения слова «энзим».
Monod J, Changeux J.-Р., Jacob F. Allosteric Proteins and Cellular Control Systems, J. Mol. Biol, 6, 306-329 (1963). Классическая статья, в которой впервые была выдвинута концепция аллостерической регуляции.
Mosbach К. Enzymes Bound to Artifical Matrixes, Sci. Am, 224, 26-33, March (1971). Ферменты, связанные с носителями, не только имитируют действие некоторых ферментов в клетках, но и используются как биокатализаторы в промышленности и медицине.
Phillips D. С. The Three-Dimensional Structure of an Enzyme Molecule, Sci. Am., 215, 78-90, Nevember (1966) (offprint 1055). Превосходная статья, посвященная трехмерной структуре и механизму каталитического действия лизоцима.
Schmidt E., Schmidt F. W. Clinical Enzymology, FEBS Lett. Suppl., vol. 62 (1976). Использование ферментов для диагностики болезней.
Segal H. L. Enzymatic Interconversion of Active and Inactive Forms of Enzymes, Science, 180, 25-31 (1973).
Вопросы и задачи
1. Сохранение сладкого вкуса кукурузы. Сладкий вкус зерен в свежесобранных початках кукурузы обусловлен высоким содержанием в них сахара. Кукуруза, которую продают через несколько дней после сбора, имеет более низкую сахаристость, так как около 50% свободного сахара в зернах превращаются в крахмал в течение одного дня хранения. Чтобы сохранить сладкий вкус свежесобранной кукурузы, очищенные початки помещают на несколько минут в кипящую воду («бланшируют»), а затем охлаждают в холодной воде. Кукуруза, обработанная таким образом и хранящаяся в замороженном виде, сохраняет свой сладкий вкус. В чем биологическая основа этой обработки?
2. Внутриклеточная концентрация ферментов. Чтобы оценить в первом приближении фактическую концентрацию ферментов в бактериальной клетке, предположим, что она содержит 1000 разных ферментов, растворенных в цитозоле. Мы можем сильно упростить задачу, предположив далее, что молекулярная масса каждого из них составляет 100000, и что все 1000 ферментов присутствуют в одинаковой концентрации. Рассчитайте среднюю молярную концентрацию ферментов в такой гипотетической клетке, исходя из следующих условий: в бактериальной клетке (которая представляет собой цилиндр диаметром 1 мкм и высотой 2 мкм) цитозоль (удельный вес 1,20) содержит 20% (по весу) растворимого белка и весь этот растворимый белок полностью состоит из различных ферментов.
3. Катализ уреазой. Фермент уреаза повышает скорость гидролиза мочевины при pH 8,0 и 20 °С в 1014 раз. Если данное количество уреазы может полностью гидролизовать данное количество мочевины за 5 мин при pH 8,0 и 20°С, сколько времени потребовалось бы для полного гидролиза мочевины в тех же условиях без уреазы? Предполагается, что обе реакции проходят в стерильных условиях без доступа бактерий.
4. Требования, которым удовлетворяют активные центры ферментов. Активный центр фермента обычно представляет собой «карман» на поверхности фермента, выстланный боковыми цепями аминокислот, необходимыми для связывания субстрата и катализа его химического превращения. Молекула карбоксипептидазы, последовательно отщепляющей С-концевые аминокислотные остатки от субстратов (пептидов), состоит из одной полипептидной цепи (307 аминокислотных остатков). Три главные каталитические группы в активном центре-это аргинин 145, тирозин 248 и глутаминовая кислота 270 (номер указывает положение аминокислоты в аминокислотной последовательности фермента).
а) Если бы карбоксипептидаза представляла собой идеальную а-спираль, то на каком расстоянии (в нм) друг от друга находились бы аргинин 145 и тирозин 248; аргинин 145 и глутаминовая кислота 270? (Подсказка; см. рис. 7-6).
б) Объясните, каким образом эти три аминокислоты, расположенные так далеко друг от друга в полипептидной цепи, могут катализировать реакцию, участники которой занимают пространство размером в несколько десятых долей нанометра.
в) Если в процессе гидролиза участвуют только эти три каталитические группы, для чего ферменту необходимо иметь так много аминокислотных остатков?
5. Количественное определение лактатдегидрогеназы. Мышечный фермент лактатдегидрогеназа катализирует реакцию:
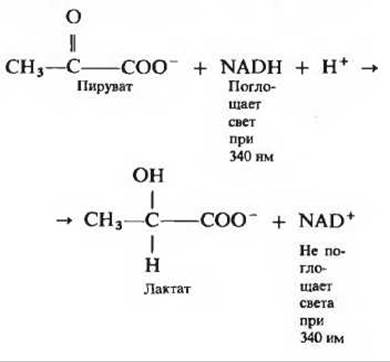
В отличие от NAD+ раствор NADH поглощает свет при 340 нм (ближняя ультрафиолетовая область спектра). Это свойство используется для определения концентрации NADH в растворе путем измерения поглощения раствора при 340 нм с помощью спектрофотометра. Объясните, как эти свойства NADH можно использовать для количественного определения лактатдегидрогеназы
6. Оценка Vmах и КM непосредственно по данным о скорости реакции. Хотя для точного определения величин Vmаx и КM, характеризующих ферментативную реакцию, используют обычно графические методы (см., например, дополнение 9-2), эти величины можно определить, измерив скорости реакции при возрастающих концентрациях субстрата. Исходя из определения Vmax и КM, оцените приблизительные значения этих величин для ферментативной реакции по следующим данным 7
|
[S], м |
К мкмоль/л∙мин |
|
2,5∙10-6 |
28 |
|
4,0∙10-6 |
40 |
|
1∙10-5 |
70 |
|
2∙10-5 |
95 |
|
4∙10-5 |
112 |
|
1∙10-4 |
128 |
|
2∙10-3 |
139 |
|
1∙10-2 |
140 |
7. Физический смысл Vmax. В лаборатории два студента независимо друг от друга выделили фермент лактатдегидрогеназу (из сердца цыпленка), катализирующую восстановление пирувата до лактата. Фермент был получен в виде концентрированного раствора. Затем оба студента измерили ферментативную активность полученных ими растворов в одних и тех же условиях при разных концентрациях субстрата и таким образом определили Vmах и КM своих препаратов. При сравнении результатов они обратили внимание на то, что значения КМ у них совпадали, а значения Vmax существенно различались Один из студентов утверждал, что разные значения Vmax свидетельствуют о том, что они получили различные формы одного и того же фермента. Другой же утверждал, что, несмотря на разные значения Vmах, они выделили одну и ту же форму фермента. Кто из них прав? Объясните, как можно разрешить это противоречие?
8. Связь между скоростью реакции и концентрацией субстрата уравнение Михаэлиса-Ментен.
а) При какой концентрации субстрата фермент, для которого максимальная скорость превращения субстрата составляет 30 мкмолей/мин ∙ мг, а величина КM равна 0,005 М, будет работать со скоростью, равной 1/4 максимальной?
б) Определите, какую долю Vmax будет составлять скорость реакции при концентрациях субстрата, равных 1/2 КM, 2КM и 10КМ.
9. Графическое определение величин Vmax и КM. При определении каталитической активности пептидазы из тонкого кишечника, гидролизующей дипептид глицилглицин:
Глицилглицин + Н2O → 2 Глицин,
были получены следующие экспериментальные данные:
|
[S], мМ |
1,5 |
2,0 |
3,0 |
4,0 |
8,00 16,0 |
|
Продукт, мг/мин |
0,21 |
0,24 |
0,28 |
0,33 |
0,40 0,45 |
По этим данным определите графическим путем (см. дополнение 9-2) величины Км и для этого препарата фермента.
10. Число оборотов карбоангидразы. Карбоангидраза эритроцитов, имеющая молекулярную массу 30000, один из самых активных ферментов, известных в настоящее время. Она катализирует обратимую реакцию гидратации СO2
H2O + СO2 ⇄ H2CO3,
которая играет важную роль в транспорте СO2 из тканей в легкие. Рассчитайте число оборотов карбоангидразы, если при оптимальных условиях 10 мкг чистой карбоангидразы катализируют гидратацию 0,30 г СO2 в 1 мин при 37 ˚С.
11. Необратимое ингибирование фермента. Многие ферменты необратимо ингибируются ионами тяжелых металлов, такими, как Mg2+, Cu2+ или Ag+, которые могут взаимодействовать с важными для активности фермента сульфгидрильными группами с образованием меркаптидов:
Е—SH + Ag+→ Е—S—Ag + Н+.
Сродство ионов Ag+ к сульфгидрильным группам столь велико, что эти ионы можно использовать для количественного титрования —SH-гpyпп. К 10 мл раствора, содержащего 1 мг/мл чистого фермента, добавили такое количество AgNО3, которое достаточно для полной инактивации фермента. Для этого потребовалось 0.342 мкмоля AgNО3 Рассчитайте минимальную молекулярную массу фермента. Почему значение молекулярной массы, полученное таким путем, будет минимальным?
12. Защита фермента от тепловой денатурации. При нагревании раствора фермента со временем он постепенно утрачивает каталитическую активность. Это обусловлено разворачиванием молекулы нативного фермента, которая по мере возрастания ее тепловой энергии принимает конформацию беспорядочного клубка. При инкубации раствора гексокиназы в течение 12 мин при 45 ˚С фермент теряет 50% активности, но если гексокиназа инкубируется при 45 С в присутствии очень большой концентрации одного из ее субстратов - глюкозы, то она утрачивает только 3% активности. Объясните, почему тепловая денатурация гексокиназы замедляется в присутствии одного из ее субстратов.
13. Клиническое применение дифференцированного ингибирования ферментов. В сыворотке крови человека содержатся ферменты, известные под названием кислых фосфатаз, которые гидролизуют биологические фосфоэфиры в слабо кислой среде (pH 5,0):
![]()
Кислые фосфатазы синтезируются в эритроцитах, печени, почках, селезенке и предстательной железе (простате). С медицинской точки зрения фермент из предстательной железы имеет весьма важное значение, так как повышение его концентрации в крови часто служит указанием на рак простаты. Фосфатаза из простаты сильно ингибируется тартрат-ионами, тогда как кислые фосфатазы из других тканей не ингибируются этими ионами. Как можно использовать эти данные для разработки метода специфического определения активности кислой фосфатазы из предстательной железы в сыворотке крови человека?
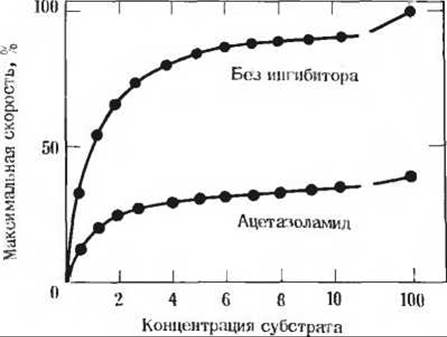
14. Ингибирование карбоангидразы ацетазол-амидом. Карбоангидраза сильно ингибируется ацетазоламидом. применяемым как мочегонное средство и как препарат для лечения глаукомы, характеризующейся чрезмерным повышением внутриглазного давления. В этих и других секреторных процессах карбоангидраза играет важную роль, поскольку она участвует в регуляции pH и содержания бикарбоната во многих жидкостях организма человека. На рисунке показана экспериментальная кривая, выражающая зависимость скорости реакции, катализируемой карбоангидразой от концентрации субстрата. При проведении опыта в присутствии ацетазоламида получается нижняя кривая. Исходя из анализа кривых и ваших знаний о кинетических свойствах конкурентных и неконкурентных ингибиторов ферментов, определите природу ингибирования ацетазоламидом. Объясните, на чем основано ваше утверждение.
15. Помощь при отравлении метанолом. Метанол (древесный спирт), который когда-то использовался как антифриз для автомобилей. очень токсичен; прием внутрь всего лишь 30 мл метанола может привести к смерти. Такая необычайно высокая токсичность метанола обусловлена действием не столько самого метанола, сколько продукта его метаболизма - формальдегида. Метанол быстро окисляется до формальдегида под действием фермента печени алкогольдегидрогеназы:
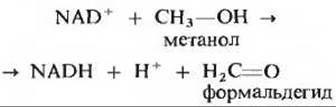
Один из методов лечения при отравлении метанолом состоит в том, что больному назначают этанол (этиловый спирт) либо внутрь, либо внутривенно в количествах, которые у здорового человека вызывают интоксикацию. Объясните, почему такое лечение оказывается эффективным?
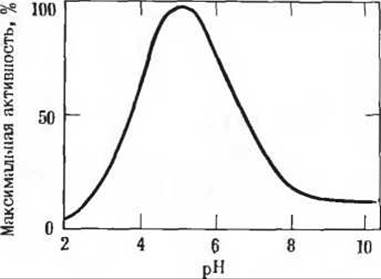
16. Оптимум pH лизоцима. Ферментативная активность лизоцима максимальна при pH 5,2 и уменьшается как при снижении, так и при повышении этого значения pH (см. рисунок). Лизоцим содержит в активном центре два аминокислотных остатка, необходимых для катализа: глутаминовую кислоту в положении 35 и аспарагиновую кислоту в положении 52. Величины рК' карбоксильных групп боковых цепей этих двух остатков равны соответственно 5,9 и 4,5. В каком ионизированном состоянии (протонированном или депротонированном) находится каждый из этих аминокислотных остатков в оптимуме pH лизоцима? Как можно объяснить форму приведенной на рисунке кривой, характеризующей зависимость активности лизоцима от pH, исходя из того, что нам известно, в каком состоянии ионизации находятся эти два аминокислотных остатка?
Задача 16