Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Витамины и микроэлементы: их роль в функционировании ферментов
Витамин К-компонент карбоксилирующего фермента
Две основные формы витамина К-витамины K1 и К2 - в значительных количествах содержатся в большинстве высших растений. Обе формы представляют собой нафтохиноны с изопреноидными боковыми цепями разной длины (рис. 10-24). Недостаток витамина К у цыплят и других животных вызывает у них нарушение свертываемости крови.
Сравнительно недавно удалось установить биохимическую функцию витамина К. в механизме свертывания крови. Витамин К необходим для нормального образования белка плазмы крови протромбина, который является неактивным предшественником тромбина - фермента, превращающего белок плазмы крови фибриноген в фибрин - нерастворимый, волокнистый белок, способствующий формированию кровяного сгустка. Чтобы протромбин мог активироваться и превратиться в тромбин, он должен связать ионы Са2+. При недостатке витамина К в организме животных синтезируются дефектные молекулы протромбина, неспособные правильно связывать ионы Са2+. В нормальной молекуле протромбина содержится несколько остатков особой аминокислоты-у-карбоксиглутаминовой кислоты, которая и связывает ионы Са2+. При недостаточности витамина К вместо остатков у-карбоксиглутаминовой кислоты в молекуле протромбина содержатся остатки глутаминовой кислоты. Джон Сатти из Висконсинского университета обнаружил ферментативную систему, способную превращать остатки глутаминовой кислоты в протромбине, выделенном из крови животных с недостаточностью витамина К, в остатки у- карбоксиглутаминовой кислоты. Для действия этого фермента необходим витамин К (рис. 10-25). Некоторые другие Са2+-связывающие белки в организме также содержат остатки у-карбоксиглутаминовой кислоты.
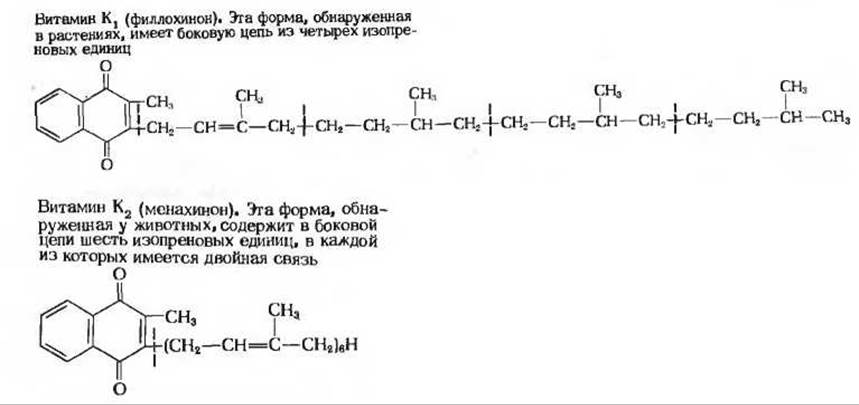
Рис. 10-24. Разные формы витамина К.
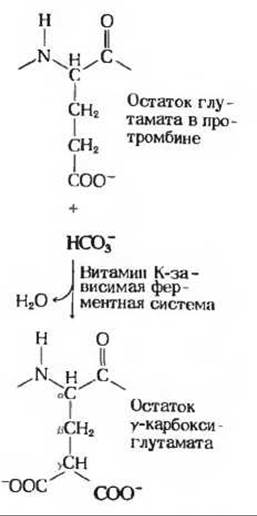
Рис. 10-25. Функция витамина К как кофактора при образовании остатков у-карбоксиглутаминовой кислоты в протромбине и других белках.