Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Липиды и мембраны
Мембраны эритроцитов исследованы очень подробно
Изучение белков, содержащихся в плазматической мембране эритроцитов, позволило сформулировать новые представления о строении мембран. Возникло, в частности, предположение о том, что по крайней мере некоторые мембраны имеют «скелет». В мембране эритроцита человека содержится пять главных белков и большое число минорных. Большинство мембранных белков-гликопротеины. К интегральным белкам в мембране эритроцита относится гликофорин («переносчик сахара»). Его молекулярная масса составляет 30000; гликофорин содержит 130 аминокислотных остатков и множество остатков сахаров, на долю которых приходится около 60% всей молекулы. На одном из концов полипептидной цепи располагается гидрофильная голова сложного строения, включающая в себя до 15 олигосахаридных цепей, каждая из которых состоит приблизительно из 10 остатков сахаров. На другом конце полипептидной цепи гликофорина находится большое число остатков глутаминовой и аспарагиновой кислот (рис. 12-20), которые при pH 7,0 несут отрицательный заряд. В середине молекулы, между двумя гидрофильными концами, располагается участок полипептидной цепи, содержащий около 30 гидрофобных аминокислотных остатков. Богатый сахарами конец молекулы гликофорина локализуется на внешней поверхности мембраны эритроцита, выступая из нее в виде кустика. Считают, что расположенный в середине молекулы гликофорина гидрофобный участок проходит сквозь липидный бислой, а полярный конец с отрицательно заряженными остатками аминокислот погружен в цитозоль. Богатая сахарами голова гликофорина содержит антигенные детерминанты, определяющие группу крови (А, В или О). Кроме того, на ней имеются участки, связывающие некоторые патогенные вирусы.
На долю другого важного белка мембраны эритроцитов - спектрина - приходится до 20% общего количества белков в мембране. Этот периферический белок расположен на внутренней поверхности мембраны; он легко поддается экстракции. Молекула спектрина состоит из четырех полипептидных цепей, суммарная молекулярная масса которых составляет около 1 млн.; эти цепи образуют длинные гибкие стержни длиной 100-200 нм. Связываясь с определенными белками и липидами на внутренней поверхности мембраны эритроцита, молекулы спектрина формируют гибкую решетку, которая, по-видимому, играет роль скелета мембраны. Со спектрином связываются также микрофиламенты актина, и весьма вероятно, что именно они соединяют стержни спектрина друг с другом. Таким образом, можно говорить о том, что мембрана эритроцита имеет скелет, или каркас, на котором крепятся специфические липиды и мембранные белки (рис. 12-21).
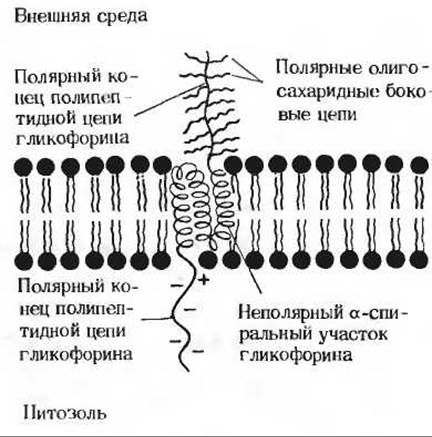
Рис. 12-20. Молекула гликофорина в мембране эритроцита. Выступающие из мембраны разветвленные углеводные цепи несут специфические участки, определяющие группу крови, а также участки, ответственные за связывание некоторых вирусов.
Плазматические мембраны других клеток имеют более сложное строение. На внешней поверхности клеток во многих плотных тканях присутствует еще один важный гликопротеин - фибронектин (разд. 11.12), обладающий высокой адгезивной способностью и, возможно, обеспечивающий слипание однотипных клеток друг с другом.
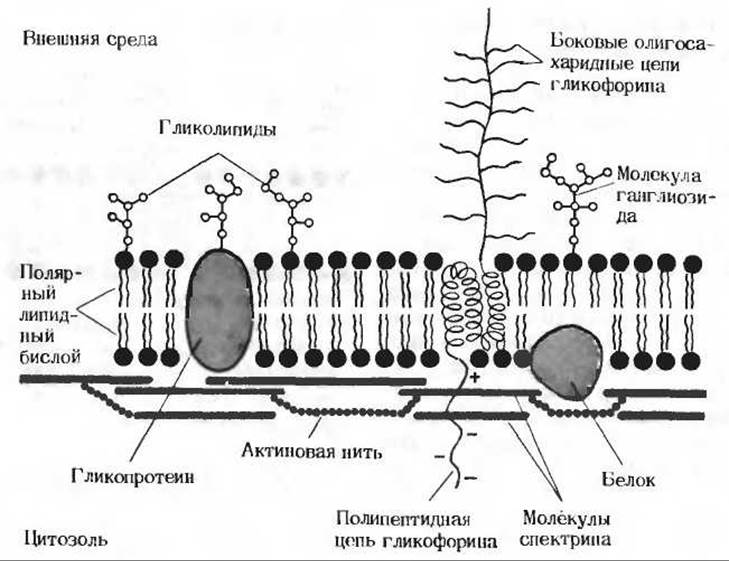
Рис 12-21. Схематическое изображение участка эритроцитарной мембраны. На схеме показаны олигосахаридные «антенны», образованные мембранными гликопротеинами и гликолипидами, боковые олигосахаридные цепи гликофорина, а также присоединенная к внутренней поверхности мембраны скелетная основа из молекул спектрина, связанных между собой короткими нитями актина.