Основы биохимии Том 1 - А. Ленинджер 1985
Приложение
Ответы
Глава 2
1. а) 625 клеток: б) 1 х 105 митохондрий: в) 2 х 105 молекул.
2. а) 1,1 х 104 молекул; б) 1 х 10-4 М.
3. а) 1 х 10-12 г (1 пикограмм); б) 5,9%: в) 4,6%.
4. а) 1,3 мм; длина ДНК в 650 раз превышает размер клетки, поэтому ДНК должна быть плотно скручена, б) 3156 белков.
5. а) Скорость метаболизма лимитируется диффузией, которая в свою очередь зависит от площади поверхности, б) Для бактерии-12 х 106 м-1, или 12 мкм-1, для амебы 4 х 104 м-1, или 0,04 мкм-1: отношение равно 300. в) Отношение площади поверхности к объему у человека равно 19 м-1; соотношение между этими показателями у бактерии и человека равно (1,2 х 106)/1. Ответ будет иным при других размерах тела.
6. а) 7850; б) 3,14 х 10-10 м2; в) 2,72 х 10-9 м2; г) 765%-ное улучшение отношения площади поверхности к объему.
Глава 3
1. Витамины, полученные из этих двух источников, идентичны, и организм не в состоянии различить их.2.
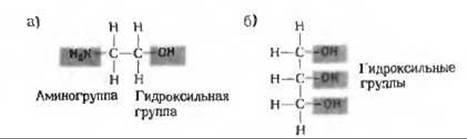
Эти два энантиомера по-разному взаимодействуют с хиральным биологическим «рецептором» (т. е. с белком).
4. Декседрин представляет собой лишь один из энантиомеров, в то время как бензедрин - это рацемическая смесь.
5. а) 3 молекулы фосфорной кислоты, a-D-рибоза, аденин.
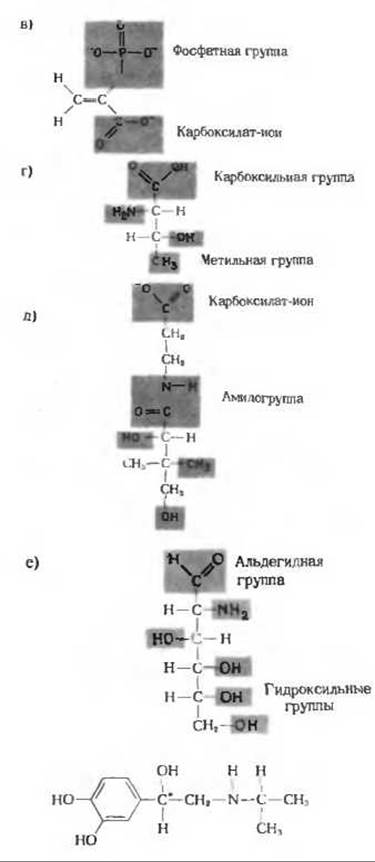
б) Холин, фосфорная кислота, глицерол, олеиновая кислота, пальмитиновая кислота. в) Тирозин, 2 молекулы глицина, фенилаланин, метионин.
6. а) СН2О; С3Н6О3.
б)
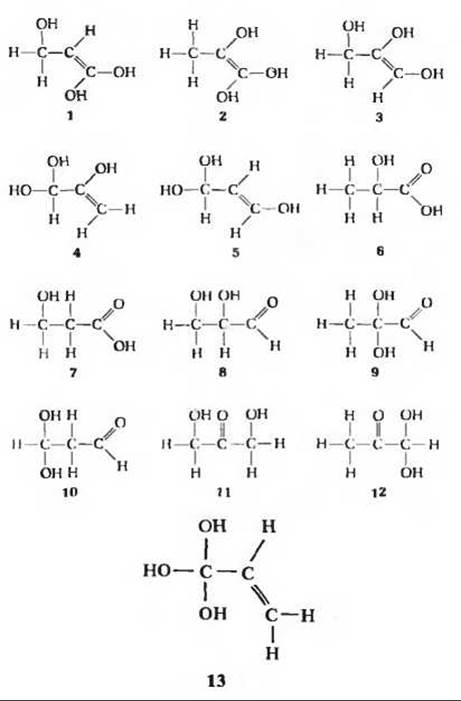
в) Это означает, что X содержит хиральный центр; все, кроме 6, 7, 8 и 12, нестабильны и как таковые не встречаются.
г) Это означает, что X содержит функциональную группу с кислотными свойствами; можно исключить 8; структура 6 согласуется со всеми полученными данными. д) Структура 6; мы не можем различить два возможных энантиомера.
Глава 4
1. 9,6 моляльный, или примерно 9,6 М.
2. 3,35 мл.
3. 1,1.
4. 7,5 х 10-6 молей.
5. Для равновесной реакции НА⇄Н++А- соответствующее уравнение Хендерсона-Хассельбаха выглядит так: рК' = pH++log[A-]/[HA], Если кислота (НА) наполовину диссоциирована, то [НА] = [А-]. Тогда [А-]/[НА] = 1, log 1 = 0 и рК' = pH.
6. а) В области pH около 9,3; ![]()
в) 10-2 л; г) pH — рК' = - 2.
7. а) 0,1 М НСl; б) 0,1 М NaCl; в) 0,1 М NaOH.
8. Правильный ответ-г).
9. В желудке.
10. 5,80 г NaH2PО4 ∙ H2О и 8,23 г Na2HPO4.
11. а) pH крови регулируется СО2 бикарбоната ой буферной системой согласно следующей суммарной реакции:
СО2 + Н2О ⇄ Н+ + НСО-3.
При слабом снабжении легких воздухом концентрация СО2 в них и в артериальной крови возрастает, сдвигая равновесие вправо и повышая концентрацию водородных ионов, т. е. pH крови при этом снижается, б) При усиленном дыхании (гипервентиляции) концентрация СО2 в легких и в артериальной крови снижается. Это сдвигает равновесие влево, в результате чего расходуются водородные ионы. Таким образом, их концентрация уменьшается, и pH возрастает по сравнению с нормальным значением, которое равно 7,4. в) Молочная кислот - это средняя по силе кислота (рК' 3,86), которая полностью диссоциирует при физиологических условиях
СН3СНОНСООН ⇄ СН3СНОНСОО-+ Н+.
Вследствие этого pH крови и мышечной ткани снижается. Усиленное дыхание полезно, так как при этом удаляются ионы водорода [см. пункт (б)] и в результате повышается pH крови и тканей в преддверии будущего накопления кислоты.
Глава 5
1. +17,9 град ∙ мл/(дм ∙ г); удельное вращение не указывает на то, является ли цитруллин D- или L-аминокислотой.
2. Определите абсолютную конфигурацию а-углеродного атома и сравните ее с D- и L-глицеральдегидом.
3. 1) Глицин (б); 2) аланин (е); 3) валин (е); 4) серин (а); 5) пролии (з); 6) фенилаланин (д); 7) триптофан (д); 8) тирозин (к); 9) аспарагиновая кислота (и); 10) глутаминовая кислота (и); 11) метионин (г); 12) цистеин (л); 13) гистидин (ж); 14) аргинин (м); 15) лизин (в); 16) аспарагин (н).
4. а) І, б) II, в) IV, г) II, д) IV, е) II и IV, ж) III, з) III, и) II, к) V, л) III, м) IV, н) V, о) II, п) III, р) IV, с) V, т) I, III и) V, у) V.
5. б) Одна десятимиллионная часть.
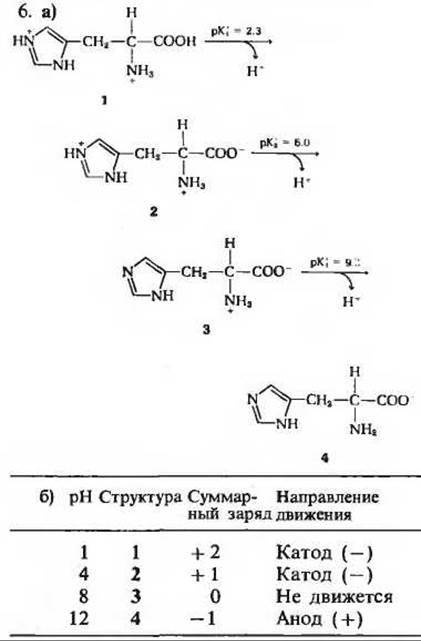
7. 0,879 л 0,1 М глицина и 0,121 л 0,1 М глицин-гидрохлорида.
8. а) К аноду: Glu; б) к катоду: Lys, Arg и His; в) остались на старте Gly и Ala.
9. a) Asp; б) Met; в) Glu; г) Gly; д) Ser.
10. а) 27; б) 6.
11. а) 2; б) 4; в)
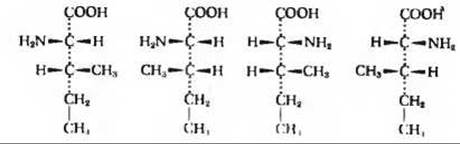
г) 2S, 3R, 2S, 3S, 2R, 3R и 2R, 3S соответственно.
12. а)
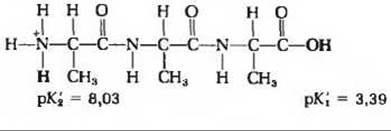
б) Ионизация первого протона и в Ala, и в Ala-олигопептиде приводит к образованию основания цвиттерионной природы. Это равновесие сдвигается вправо из-за того, что создаются благоприятные условия для взаимодействия между карбоксилатным анионом и протонирован- ной аминогруппой. Поскольку протонированная аминогруппа ближе к карбоксилатному аниону в Ala, чем в Аlа-олигопептиде, равновесие в первом случае сдвигается сильнее, на что указывает более низкое значение рК1. в) Ионизация второго протона и в Ala, и в Аlа-олигопептиде нарушает условия, благоприятствовавшие взаимодействию заряженных группировок. Поскольку эти группировки ближе друг к другу в Ala, чем в Аlа-олигопептиде, то в Ala труднее удалить второй протон и соответственно рК'2 для Ala выше, чем рК'2 для Аlа-олигопептида.
Глава 6
1. 3500 молекул.
2. а) 32100г/моль; б) 2.
3. 1200; 12200 г/моль.
4. +2; +1; 0; —2; pI = 7,8.
5. —COO-; Asp и Glu.
6. Lys, His, Arg; электростатическое притяжение между отрицательно заряженными остатками фосфора в ДНК и положительно заряженными основными остатками в гистонах.
7. a) (Glu)20; б) (Lys—Аlа)3; в) (Asn— Ser—His)5; г) (Asn—Ser—His)5.
8.
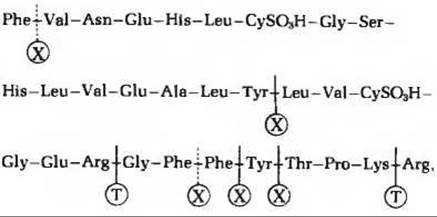
Пунктирные линии показывают плохо расщепляющиеся связи; Т - трипсин, Х - химотрипсин.
9. Туг—Gly—Gly—Phe—Leu.
10. а) 1 - к аноду; 2 - к катоду; 3 - к катоду; 4 - к аноду; б) pH 7-9.
11. а) При добавлении высоких концентраций солей из молекул белка удаляется гидратная вода, в результате чего растворимость белка уменьшается, б) Выберите такую концентрацию (NH4)2SO4, при которой белок А осаждается, а белок В остается в растворе. Соберите осажденный белок А центрифугированием.
12. Промойте колонку большим избытком свободного лиганда с тем, чтобы вытеснить лиганд, связанный с полимером.
Глава 7
1. а) Короткие связи - это сильные связи высокого порядка, т.е. не одинарные, а двойные или тройные связи. Связь С—N занимает промежуточное положение между одинарной и двойной связью, б) Пептидная связь представлена двумя резонансными структурами, в) Вращение вокруг пептидной связи при физиологических температурах затруднено.
2. Основные структурные единицы полипептидов шерстяных волокон - это следующие друг за другом витки а-спирали, интервал между которыми составляет 0,54 нм. При вытягивании и пропаривании волокон полипептидная цепь удлиняется и расстояние между R-группами в ß-конформации увеличивается до 0,70 нм.
3. Около 40 пептидных связей в одну секунду.
4. Отталкивание отрицательно заряженных карбоксильных групп полиглутаминовой кислоты при pH 7 вызывает развертывание полипептидной цепи. К такому же результату приводит отталкивание положительно заряженных аминогрупп полилизина при pH 7.
5. Дисульфидные мостики в остатках цистина служат для образования поперечных сшивок между белковыми цепями; эти мостики повышают жесткость и механическую прочность белка.
6. Шерсть «садится» вследствие перехода полипептидной цепи из вытянутой конформации (ß-структура складчатого слоя) в а-спиральную конформацию.
7. Остатки цистина препятствуют полному развертыванию белка.
8. а)
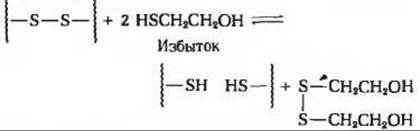
б) Из-за окисления на воздухе цистеина до цистина.
9. В слоях Gly уложен напротив Gly. а Ala/Ser напротив Ala/Ser.
10. 30 аминокислот; 89%.
11. Данные о том, что 14С-гидроксипролин не включается в коллаген, свидетельствуют против первого предположения и согласуются со вторым.
12. Способность бактерии проникать в ткань объясняется тем, что она может разрушать соединительнотканный барьер хозяина, секретируя фермент коллагеназу. Бактерии коллагена не содержат.
Глава 8
1. В положениях 7 и 19; в положениях 13 и 24.
2. Снаружи - Asp, Gln, Lys; внутри - Leu, Val: Ser - в любом месте.
3. В большинстве случаев функциональная трехмерная укладка полипептидной цепи, т.е. нативная структура белка, представляет собой его наиболее стабильную конформацию. Следовательно, хотя белки синтезируются в виде линейных полимеров, они спонтанно принимают правильную трехмерную конформацию. Подтверждение этой мысли можно найти в классической работе Анфинсена по рибонуклеазе (см. рис. 8-8).
4. а) Только комбинации, обнаруженные в нативной структуре, дают функциональную активность, б) Нативная структура определяется первичной структурой белка. в) Нативная структура инсулина не является наиболее стабильной конформацией.
5. а) Сравнивая между собой количества (в молях) содержащегося в белке валина и его производного, можно установить число NН2-концов и тем самым число полипептидных цепей. б) 4.
6. а) 16400 г/моль; б) это значит, что в гемоглобине четыре атома железа.
7. а) 3,2 х 10-11 г; б) 300 миллионов; в) 90 мкм3; г) 0,55; д) объем упаковки 94 мкм3; е) поскольку вышеприведенный расчет показывает, что молекулы гемоглобина соприкасаются друг с другом и заполняют весь эритроцит, при изменении взаимодействия соседних молекул форма клетки также должна меняться. При серповидноклеточной анемии гемоглобин находится в клетке не в кубической упаковке, а в виде длинных параллельных нитей. В результате эритроцит также становится вытянутым в направлении этих нитей.
8. а) 7,8 x 10-4 г O2 на 1 кг ткани; б) 1,3 х 10-2 г O2 на 1 кг ткани; 17/1; в) 7,8%.
9. а) Гемоглобин F. б) Благодаря этому обеспечивается поступление кислорода из материнской крови в кровь плода. в) ДФГ уменьшает сродство гемоглобина к кислороду. Тот факт, что при связывании ДФГ кривая насыщения гемоглобина А сдвигается больше, чем кривая насыщения гемоглобина F, свидетельствует о том, что гемоглобин А связывает ДФГ прочнее, чем гемоглобин F.
10. а) Он расщепляет пептидные связи с карбоксильной стороны остатков Lys и Arg. б) ОФиладельфия. в) электрофорезом интактной а-цепи.
11. С помощью элекрофореза при pH 7.
Глава 9
1. Фермент, ответственный за превращение сахара в крахмал, инактивируется при нагревании.
2. 2,4 х 10-6 М.
3. 9,5 х 108 лет.
4. а) 15,5 нм; 18,8 нм. б) При образовании трехмерной конформации фермента эти аминокислоты оказываются в непосредственной близости друг от друга, в) Белок служит «каркасом», поддерживающим каталитические группы в правильной ориентации.
5. Определите величину КМ; измерьте начальную скорость (скорость исчезновения NADH, фиксируемую с помощью спектрофотометра) при нескольких определенных концентрациях фермента; начертите график изменения начальной скорости при повышении концентрации фермента.
6. Vmax ~ 140мкмол/л∙мин; КM ~ 1 х 105М.
7. По-видимому, они выделили одну и ту же форму фермента. Величина Vmах зависит от концентрации фермента. Чтобы разрешить противоречие, им следует определить число оборотов каждого из препаратов фермента.
8. а) 1,7 x 10-3 М; б) 0,33, 0,67, 0,91.
9. КM = 2,2 мм; = 0,51 мг мин.
10. 2,0 x 107 мин-1.
11. 29 000; нам следует предположить, что каждая молекула фермента содержит всего одну способную титроваться сульфгидрильную группу.
12. Фермент-субстратный комплекс стабильнее, чем фермент и субстрат, взятые по отдельности.
13. Измерить суммарную активность кислой фосфатазы в присутствии и в отсутствие тартрат-иона.
14. Тот факт, что ацетазоламин понижает Vmax фермента, но не изменяет его КM, свидетельствует о том, что этот ингибитор действует неконкурентным образом.
15. Этанол конкурирует с метанолом за активный центр алкогольдегидрогеназы.
16. Glu-35 протонирован; Asp-52 депротонирован.
Глава 10
1. а) Никотиновая кислота необходима для биосинтеза Тrр и в то же время она сама может синтезироваться из Тrр. б) Кукуруза бедна триптофаном.
2. Недостаточность тиамина.
3. Скорость образования молочной кислоты зависит от количества рибофлавина в культуральной среде.
4. Пиридоксин превращается в пиридоксальфосфат, который служит простетической группой, выполняющей центральную роль в реакциях переаминирования.
5. а) Бактериальное заражение. б) Авидин связывает свободный биотин и препятствует росту бактерий. в) Он предохраняет развивающийся эмбрион от разрушительного действия бактерий в течение инкубационного периода.
6. При добавлении в питательную среду тимидина бактерии могут обходиться без тетрагидрофолата, для синтеза которого требуется фолиевая кислота
7. Недостаток витамина В12 в бактериальной флоре.
8. Высокая растворимость витаминов группы В приводит к их быстрому выведению из организма.
9. У взрослых витамин А запасается в печени.
10. Витамин D3; повреждение почек препятствует полному гидроксилированию витамина D3 и образованию его биологически активной формы.
11. а) Он может действовать как ингибитор в ферментативных реакциях, зависящих от витамина К. б) У них возникают сильные кровотечения, обусловленные кажущимся дефицитом витамина К. в) Антагонист витамина К понижает концентрацию факторов свертывания крови.
12. Недостаточность витамина В12.
13. а) Фитиновая кислота связывает цинк и препятствует его всасыванию в тонком кишечнике. б) Дрожжи разрушают фитиновую кислоту.
Глава 11
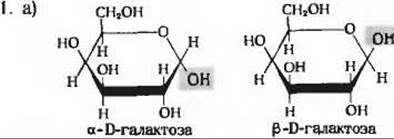
б) В свежеприготовленном растворе а- D-галактозы происходит мутаротация, приводящая к образованию равновесной смеси а- и ß-D-галактозы. В результате мутаротации чистой а- или ß-D-галактозы образуется смесь обеих форм одного и того же состава, в) 72% ß-формы и 28% а-формы.
2. а) Измерить изменение оптического вращения в зависимости от времени. б) Направление оптического вращения смеси противоположно направлению оптического вращения раствора сахарозы. в) 0,63 части сахарозы гидролизуется; конечный состав смеси: глюкоза и фруктоза - 0,77 частей, сахароза - 0,23 части.
3. Приготовить сердцевину шоколадки из пасты, содержащей сахарозу и воду; добавить небольшое количество инвертазы; сразу же покрыть шоколадом.
4. а)
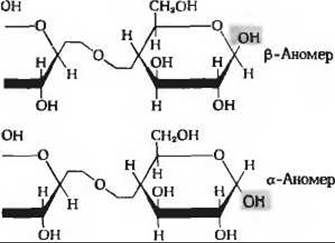
б) Гидролиз обоих аномеров лактозы приводит к образованию смеси, состоящей из а- и ß-D-глюкозы и а- й ß- D-галактозы.
5. Сахароза не принадлежит к редуцирующим сахарам.
6. 7840 остатков/с.
7. Природная целлюлоза состоит из мономеров глюкозы, соединенных между собой посредством ß(1→4)-гликозидной связи. Благодаря ß-связям остатки глюкозы образуют вытянутую полимерную цепь (см. рис. 11-16). Между несколькими параллельными цепями возникают межмолекулярные водородные связи, в результате чего формируются длинные жесткие нерастворимые волокна. Гликоген также состоит из остатков глюкозы, но они соединены друг с другом а(1→4)-связями. Такая a-связь между остатками глюкозы вызывает изгиб цепи и препятствует образованию длинных нитей. Кроме того, гликоген сильно разветвлен (рис. 11-15). Эти структурные свойства обеспечивают высокую степень гидратации гликогена, поскольку многие гидроксильные группы обращены к воде. Поэтому гликоген можно экстрагировать в диспергированном виде горячей водой. Физические свойства этих двух полимеров хорошо подходят для выполнения ими их биологической функции. Целлюлоза служит структурным материалом в растениях, что согласуется с ее способностью агрегировать с образованием нерастворимых волокон. Гликоген играет роль запасного «горючего» в организме животных. Сильно гидратированные и незащищенные гранулы гликогена быстро гидролизуются гликогенфосфорилазой до глюкозо-1-фосфата. Этот фермент действует только на нередуцирующие концы, поэтому высокая степень разветвления полимера обеспечивает наличие в нем множества мест, доступных действию гликогенфосфорилазы.
8. 10,8 с.
9. а) Из остатков, находящихся в точках ветвления, образуется 2,3-диметилглюкоза, тогда как из других остатков полимера получается 2,3,6-триметилглюкоза.
б) 3,74%.
10. D-глюкопиранозил-(1→1)-D-глюкопиранозид.
Глава 12
1. Число двойных цис-связей. Каждая двойная цис-связь вызывает изгиб углеводородной цепи, затрудняя ее упаковку в кристаллической решетке.
2. Ненасыщенные жиры (например, сливочное масло) легко окисляются молекулярным кислородом.
3. Фосфатидилхолин превращает жир в эмульсию.
4. а) Натриевые соли пальмитиновой и стеариновой кислот, а также глицерол; б) в мягких условиях гидролиза - натриевые соли пальмитиновой и олеиновой кислоты и глицерол-3-фосфорилхолин; в жестких условиях гидролиза-натриевые соли пальмитиновой, олеиновой и фосфорной кислот, а также глицерол и холин.
5. а) 0; б) 0; в) -1.
6. Воск предохраняет от потери воды.
7. 63.
8. Гидрофобные группы: а) две жирные кислоты; б, в, г) одна жирная кислота и углеводородная цепь сфингозина; д) углеводородный остов.
Гидрофильные группы: а) фосфоэтаноламин; б) фосфохолин; в) D-галактоза; г) несколько молекул сахаров; д) спиртовая группа (—ОН).
9. а) Липиды, образующие бимолекулярные слои, относятся к амфипатическим молекулам, т.е. они содержат гидрофильную и гидрофобную части. Чтобы уменьшить соприкосновение гидрофобной части молекулы с водой, липиды формируют двумерные пленки, в которых гидрофильные части обращены к воде, а гидрофобные расположены на внутренней стороне пленки. Более того, чтобы воспрепятствовать взаимодействию гидрофобных краев такой пленки с водой, липидные бислои смыкаются. В силу тех же причин образовавшееся в пленке отверстие затягивается, поскольку мембрана полужидкая.
б) Из этих свойств липидов вытекают важные биологические следствия, а именно: липидные пленки образуют замкнутые мембранные поверхности, в результате чего возникают клетки и внутриклеточные компартменты («отсеки») - органеллы.
10. Им приходится проходить сквозь неполярную среду, составляющую внутреннюю часть мембраны.
11. Додецилсульфат натрия и холат натрия солюбилизируют гидрофобные части мембран, действуя как мыла или детергенты (рис. 12-2).
12. а) Сахара представляют собой гидрофильные соединения. б) Гликопротеины не могут перевернуться и оказаться на внешней стороне мембраны.
13. а) Внутренние мембранные белки должны находиться в жидкой среде, чтобы иметь возможность принять свою функциональную конформацию. б) Повышенный уровень ненасыщенных кислот снижает температуру плавления мембраны.