Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Слабые кислоты имеют характерные кривые титрования
Для определения количества кислоты в данном растворе используется титрование. Эта процедура состоит в добавлении раствора основания (обычно едкого натра, NaOH) точно известной концентрации к отмеренному объему анализируемого раствора кислоты. Раствор основания добавляют маленькими порциями до тех пор, пока кислота не будет точно нейтрализована; момент нейтрализации устанавливают либо по изменению цвета индикатора, либо при помощи рН-метра. Исходя из объема добавленного раствора основания и его концентрации, можно рассчитать концентрацию кислоты в анализируемом растворе.
Если при титровании слабой кислоты тщательно измерять pH титруемого раствора после добавления каждой порции раствора основания вплоть до достижения точки нейтрализации, то можно не только определить концентрацию кислоты, но и получить также важную дополнительную информацию об анализируемом растворе. График, характеризующий зависимость pH титруемого раствора от количества добавленного основания, называется кривой титрования. На рис. 4-10 показана кривая титрования уксусной кислоты (типичной слабой кислоты). Проследим за ходом титрования 0,1 М раствора уксусной кислоты 0,1 М раствором NaOH при 25°С, имея в виду, что этот процесс включает два обратимых равновесия:
![]()
которые характеризуются константами равновесия, численно равными соответственно
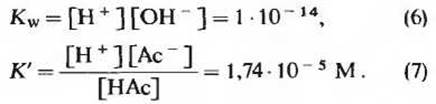
В начале титрования, до добавления NaOH, уксусная кислота уже слегка ионизирована, причем степень ее ионизации можно вычислить из константы ионизации (7). Попытаемся сделать это. Для упрощения будем считать, что степень ионизации уксусной кислоты чрезвычайно мала и потому концентрация ее недиссоциированных молекул существенно не отличается от ее общей концентрации, равной 0,1 М.
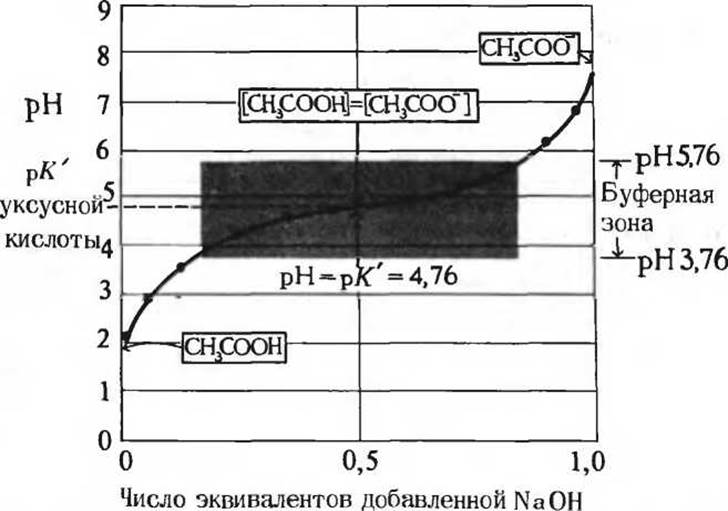
Рис. 4-10. Кривая титрования уксусной кислоты (подробности см. в тексте). После добавления каждой порции стандартного раствора NaОН к титруемому раствору уксусной кислоты, измеряют величину pH смеси. Эту величину откладывают по оси ординат, тогда как по оси абсцисс откладывают долю общего количества NaOH, требуемого для нейтрализации уксусной кислоты, т. е. для достижения pH ≈ 7. Полученные при этом точки позволяют построить кривую титрования. В рамках указаны преобладающие ионные формы уксусной кислоты при соответствующих значениях pH. В средней точке кривой титрования концентрации донора и акцептора протонов равны. Величина pH в этой точке численно равна величине рК' уксусной кислоты.
Цветная зона представляет собой область, внутри которой система обладает буферными свойствами.
Когда мы добавляем порции раствора NaOH к титруемому раствору уксусной кислоты, ионы ОН- соединяются с ионами Н+ и образуют молекулы Н2O. При этом концентрации ионов Н+ и ОН- в растворе все время должны соответствовать величине ионного произведения воды Kw = [H+][OH-] = 1∙10-14. Но как только свободные ионы Н+ связываются с ионами ОН-, некоторая часть недиссоциированных молекул НАс сразу же претерпевает дальнейшую диссоциацию, так что вновь устанавливается равновесие, характеризующееся константой диссоциации уксусной кислоты (7). Таким образом, по мере добавления новых порций раствора NaOH в процессе титрования, степень ионизации НАс будет увеличиваться. Следовательно, концентрация НАс в растворе постепенно уменьшается, а концентрация Ас- возрастает, так как равновесия (4) и (5) на каждой стадии титрования определяются константами равновесия (6) и (7). В средней точке титрования (рис. 4-10), точно соответствующей добавлению 0,5 эквивалентов NaOH, половина исходной уксусной кислоты находится в диссоциированной форме и, значит, концентрация донора протона [НАс] становится равной концентрации акцептора протона [Ас-]. В этой средней точке соблюдается очень важное соотношение: величина pH раствора, содержащего равные молярные концентрации уксусной кислоты и ацетат-иона, а именно pH 4,76, в точности равна величине рК' уксусной кислоты, в чем можно легко убедиться, если сравнить приведенные в табл. 4-4 величины рК' с показанной на рис. 4-10 кривой титрования. Скоро мы поймем смысл этого важного соотношения, которое соблюдается для всех слабых кислот.
По мере того как мы продолжаем процесс титрования, добавляя новые порции раствора NaOH, оставшиеся недиссоциированными молекулы уксусной кислоты постепенно превращаются в ацетат-ионы (СН3СОО-), тогда как ионы Н+ удаляются из раствора, соединяясь с ионами ОН- в реакции образования воды. В конце концов мы достигаем конечной точки титрования (приблизительно при pH 7,0), в которой все молекулы уксусной кислоты оказываются лишенными протонов, связавшихся с ионами ОН-. В результате образуются Н2O и ацетат. На протяжении всего процесса титрования сосуществуют два взаимосвязанных равновесия (4) и (5), причем соотношение между концентрациями веществ, участвующих в этих равновесиях, все время соответствует численным значениям констант равновесия. Оба этих равновесия обратимы и, будучи по своей природе ионными, устанавливаются практически мгновенно. Поэтому процедуру титрования можно легко провести в обратном направлении. Начиная от точки нейтрализации, мы можем добавлять к полученному раствору ионы Н+, оттитровывая ацетат-ионы, и таким путем привести раствор к исходному состоянию. После внесения поправки на изменение объема в ходе титрования мы получим точно такую же кривую, которая показана на рис. 4-10. В процессе обратного титрования добавленные ионы Н+ связываются с ионами Ас-, что приводит к образованию уксусной кислоты (НАс); по мере добавления ионов Н+ отношение [Ас]/[НАс] уменьшается до тех пор, пока не достигнет исходного состояния, которое имело место перед началом титрования раствора уксусной кислоты раствором NaOH.
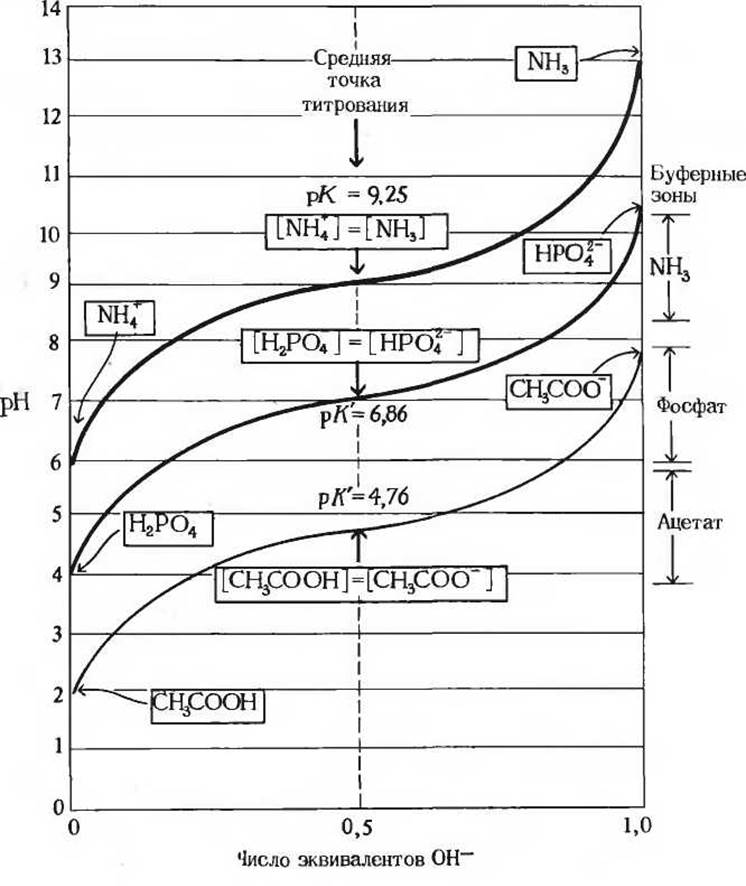
Рис. 4-П. Сравнение кривых титрования трех слабых кислот - уксусной кислоты, Н2РО-4 и NH+4. В рамках указаны преобладающие формы этих соединений при соответствующих значениях pH. Справа обозначены буферные зоны для каждой системы. Сопряженные кислотно-основные пары служат эффективными буферами при тех значениях pH, при которых соединения, играющие роль доноров протонов, ионизированы на 25-75%.
На рис. 4-11 сравниваются кривые титрования трех слабых кислот с сильно различающимися константами диссоциации, а именно уксусной кислоты (рК' = 4,76), иона Н2РO4 (рК' = 6,86) и иона аммония NH4 (рК' = 9,25). Хотя кривые титрования всех этих кислот имеют одинаковую форму, они располагаются на разных уровнях вдоль оси pH просто потому, что все три кислоты различаются по своей силе. Уксусная кислота является самой сильной из них и легче других отдает свой протон иону ОН-, так как имеет самую большую константу ионизации К’ и соответственно самую низкую величину рК'. Уксусная кислота при pH 4,76 уже диссоциирована на 50%. Труднее отщепляется протон от иона Н2РO4, который диссоциирован на 50% при pH 6,86. Ион NH4 -самая слабая из всех трех кислот, его диссоциация на 50% происходит только при pH 9,25.
Теперь мы подошли к наиболее важному пункту, касающемуся кривых титрования слабых кислот, характер этих кривых свидетельствует о возможности использования слабой кислоты и ее аниона в качестве буфера.