Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Аминокислоты имеют характерные кривые титрования
На рис. 5-10 дана кривая титрования аланина, находящегося вначале в полностью протонированной форме. Титрование проходит через две стадии, каждая из которых соответствует отщеплению одного протона. Участок кривой, отвечающий каждой из этих стадий, напоминает по форме кривую титрования одноосновной кислоты, например уксусной (см. рис. 4-10), и допускает точно такую же интерпретацию. В самом начале титрования аланина его молекулы находятся в полностью протонированной форме и в растворе преобладают ионы +NH3—CHR—СООН (в этой формуле R означает метальную группу аланина). В средней точке участка кривой, соответствующего первой стадии титрования, когда происходит отщепление протона от карбоксильной группы, присутствуют эквимолярные концентрации донора (+NH3—CHR—СООН) и акцептора (+NH3—CHR—COO-) протонов. Напомним (гл. 4), что этой средней точке соответствует значение pH, численно равное величине рК' титруемой группы. В данном случае средней точке кривой на первой стадии титрования соответствует pH 2,34; следовательно, величина рК' карбоксильной группы аланина равна 2,34. Продолжая титрование дальше, мы достигнем другой важной точки, отвечающей pH 6,02, точки перегиба кривой. Именно в этот момент заканчивается стадия отщепления первого протона и начинается стадия отщепления второго протона. При этом значении pH аланин находится преимущественно в форме биполярного иона +NH3—CHR—COO-. Чуть позже мы еще вернемся к вопросу о значении этой точки на кривой титрования.
На второй стадии титрования происходит отщепление протона от +NH3-группы аланина. Средняя точка этого участка кривой титрования соответствует эквимолярным концентрациям ионов +NH3—CHR—COO и NН2—CHR—COO-. Значение pH в этой точке равно 9,69, такое же значение имеет и рК' +NH3-гpyппы аланина. Титрование завершается приблизительно при pH 12, когда аланин находится преимущественно в форме полностью депротонированных ионов NH2—CHR—COO-.
Из кривой титрования аланина мы можем извлечь ряд ценных сведений Прежде всего она дает нам количественную информацию о величинах рК' каждой из двух ионизируемых групп: карбоксильная группа имеет рК' 2,34, а замещенная аммонийная группа рК' 9,69. Отметим что степень диссоциации карбоксильной группы аланина более чем в 100 раз выше степени диссоциации карбоксильной группы уксусной кислоты, величина рК' которой равна 4,76. Столь сильное различие кажется на первый взгляд непонятным, поскольку величины рК' других простых монокарбоновых кислот, таких, как муравьиная или пропионовая кислота, мало отличаются от величины рК' уксусной кислоты (см. табл. 4-4). Повышенная способность карбоксильной группы аланина к ионизации обусловлена электростатическим отталкиванием ее протона от находящейся поблизости положительно заряженной +NH3-гpyппы, связанной, как и СООН-группа, с атомом а-углерода (рис. 5-11). По этой причине ионизационное равновесие карбоксильной группы аланина сильно смещено вправо. При ионизации —СООН-группы уксусной кислоты никакие силы отталкивания не действуют (рис. 5-11).
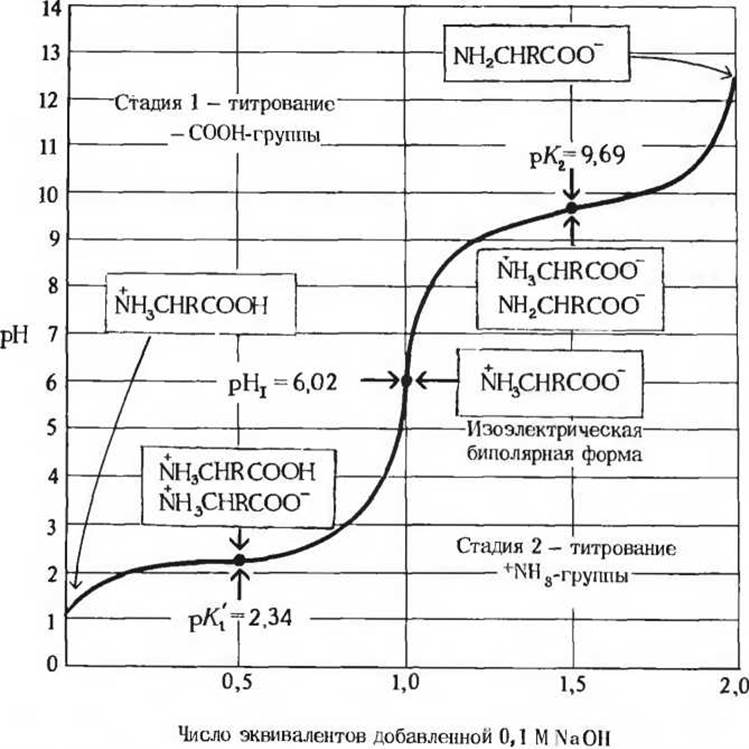
Рис. 5-10. Кривая титрования 0,1 М аланина.
Ионные формы, преобладаюшие при различных значениях pH, заключены в прямоугольные рамки. Буквой R обозначена метильная группа аланина. Пологие участки кривой титрования по обе стороны от точек, соответствующих величинам рК'1 = 2,34 и рК'2 = 9,69, представляют собой зоны, где аланин обладает буферной емкостью.
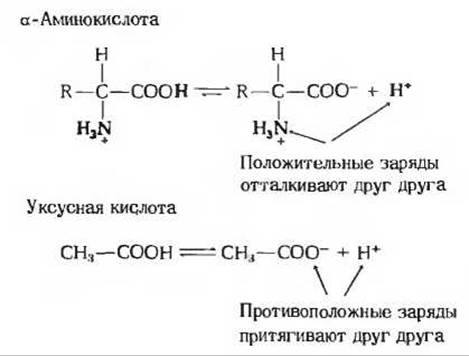
Рис. 5-11. Аминогруппа в а-аминокислотах повышает способность карбоксильной группы к ионизации вследствие взаимного отталкивания положительно заряженвой +NH3-гpyппы и положительно заряженного иона Н+ (обе группы выделены красным цветом). Благодаря такому отталкиванию карбоксильная группа в а-аминокислотах имеет более высокую степень ионизации, чем карбоксильная группа уксусной кислоты.
Из кривой титрования аланина (рис. 5-10) мы можем узнать еще об одном важном факте: эта аминокислота проявляет буферные свойства в двух областях pH (см. рис. 4-10). Одна из них определяется сравнительно плоским участком кривой по обе стороны от точки, соответствующей рК’ 2,34, откуда следует, что аланин должен быть хорошим буфером вблизи pH 2,34. Другая буферная зона расположена между значениями pH 8,7 и 10,7. Отметим также, что при значении pH около 7,4, характерном для межклеточной жидкости и крови, аланин является плохим буфером.
Используя уравнение Хендерсона-Хассельбаха (гл. 4), мы можем рассчитать, в каком соотношении нужно взять протондонорные и протонакцепторные формы аланина, чтобы приготовить буфер с заданным значением pH, находящимся в пределах буферных зон аланина. Это уравнение позволяет решать также и другие задачи, связанные с буферными свойствами аминокислот.