Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Ионообменная хроматография служит более эффективным способом разделения аминокислот
Для разделения смесей аминокислот, а также для идентификации и количественного определения разделенных аминокислот особенно широко применяется метод ионообменной хроматографии. Этот метод тоже основан на различиях кислотно-основных свойств аминокислот, но большой вклад в его эффективность вносят некоторые дополнительные факторы. Хроматографическая колонка представляет собой длинную стеклянную трубку, заполненную гранулами синтетической смолы, содержащей прочно связанные с ней заряженные группы. Смолы со связанными анионными группами называются катионообменными, а смолы со связанными катионными группами - анионообменными. В наиболее простом варианте ионообменной хроматографии разделение аминокислот осуществляют на колонке с катионообменной смолой, в которой связанные анионные группы, например остатки сульфоновой кислоты (—SO-3), сначала «нагружают» ионами Na+ (рис. 5-14). Затем на поверхность смолы наносят кислый раствор (pH 3,0), содержащий анализируемую смесь аминокислот,
Анионные центры
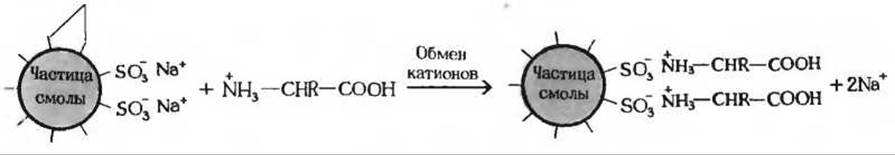
Рис. 5-14. Различные ионные формы катионообменной смолы. Отрицательно заряженные сульфогруппы (—SO-3) притягивают и связывают катионы, например Н+, Na+, или катионные группы аминокислот. При pH 3 большинство аминокислот находятся в форме катионов, хотя и различаются по величине суммарного положительного заряда и, следовательно, по способности вытеснять ионы Na+. связанные с фиксированными анионными группами. Особенно прочно связывается лизин, содержащий две—NH3-гpyппы, а наименее прочно - глутаминовая и аспарагиновая кислоты, которые при pH3 несут наименьший положительный заряд.
На связывание аминокислот ионообменными смолами влияет также их способность адсорбироваться на частицах смолы и растворяться внутри этих частиц.
и медленно пропускают его через колонку. При pH 3,0 аминокислоты представляют собой в основном катионы, несущие суммарный положительный заряд, но различающиеся по степени ионизации. По мере прохождения смеси через колонку положительно заряженные аминокислоты вытесняют ионы Na+, связанные с группами — SO-3, которые прочно присоединены к частичкам смолы. Аминокислоты, имеющие при pH 3,0 наибольший положительный заряд (лизин, аргинин и гистидин), особенно активно вытесняют ионы Na+ и вследствие этого очень прочно связываются со смолой. Аминокислоты, несущие при pH 3,0 наименьший положительный заряд (глутаминовая и аспарагиновая кислоты), связываются со смолой в наименьшей степени. Все другие аминокислоты несут в этих условиях промежуточный по величине положительный заряд и характеризуются соответственно промежуточной прочностью связывания со смолой. В результате различные аминокислоты продвигаются вниз по колонке со смолой с разными скоростями, которые зависят в основном от величин их рК’, но отчасти также и от их способности адсорбироваться на частицах смолы или растворяться внутри них. Глутаминовая и аспарагиновая кислоты будут проходить через колонку с наибольшими скоростями, так как при pH 3,0 они связываются со смолой слабее всех других аминокислот, тогда как лизин, аргинин и гистидин будут двигаться медленнее остальных аминокислот. Выходящий из нижнего конца колонки раствор (элюат) собирают в виде небольших порций (фракций) объемом по нескольку миллилитров каждая и определяют количества содержащихся в них аминокислот. Весь этот процесс сейчас полностью автоматизирован, так что отдельные его стадии - элюирование, сбор фракций, их анализ и запись данных анализа - осуществляются по заданной программе в специальном приборе - аминокислотном анализаторе. На рис. 5-15 показана хроматограмма проанализированной таким способом смеси аминокислот.
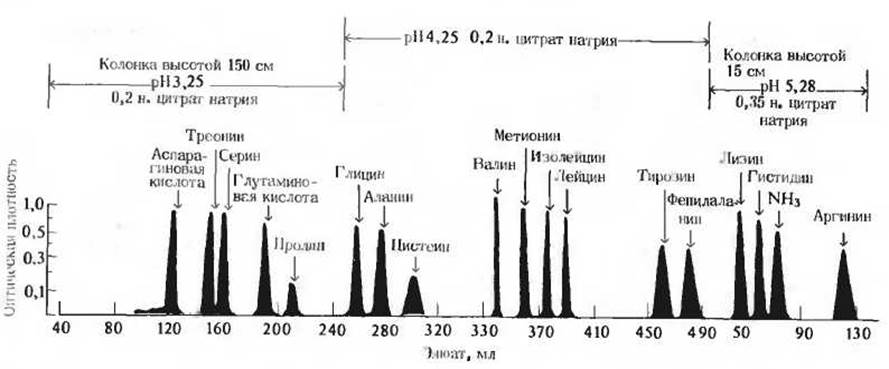
Рис. 5-15. Автоматическая регистрация результатов хроматографического разделения аминокислот на катионообменной смоле. Элюирование аминокислот проводят различными буферами с постепенно возрастающими значениями pH Выходящий из колонки раствор собирают небольшими порциями в отдельные пробирки, после чего в каждой из них автоматически определяется содержание аминокислоты. Площадь под каждым пиком пропорциональна количеству соответствующей аминокислоты в анализируемой смеси.