Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Белки: ковалентная структура и биологические функции
Белки можно выделить и подвергнуть очистке
Клетки содержат сотни, если не тысячи различных белков, и для того чтобы определить аминокислотный состав или аминокислотную последовательность того или иного белка, его прежде всего необходимо получить в виде чистого препарата. Каким же образом один белок, например какой-нибудь фермент, можно отделить от сотен других белков, присутствующих в экстракте, полученном из клеток или ткани, и добиться нужной степени его чистоты?
Прежде всего, белки отделяют от низкомолекулярных веществ, содержащихся в клеточном или тканевом экстракте, путем диализа (рис. 6-3). Крупные молекулы, такие, как молекулы белков, остаются внутри диализного мешочка, сделанного из материала, содержащего ультрамикроскопические поры, например из целлофана. Если такой мешочек с клеточным или тканевым экстрактом погрузить в воду, то содержащиеся в экстракте малые молекулы, например соли, пройдут сквозь поры, а высокомолекулярные белки останутся в мешочке.
После того как смесь белков будет освобождена от малых молекул в ходе диализа, белки можно рассортировать по их размерам при помощи гель-фильтрации. В ходе этой операции, представляющей собой разновидность хроматографии, раствор, содержащий смесь белков, пропускают через колонку, заполненную очень мелкими пористыми гранулами высокогидратированного полимера. Молекулы белков, имеющие сравнительно небольшие размеры, проникают через поры внутрь этих гранул, в результате чего их прохождение через колонку замедляется (рис. 6-4), тогда как молекулы более крупных белков не могут проникнуть внутрь гранул и проходят через колонку значительно быстрее. Белки промежуточных размеров будут проходить через колонку с промежуточными скоростями в зависимости от их способности проникать внутрь гранул. Такая колонка, в которой осуществляется гель-фильтрация, представляет собой молекулярное сито.
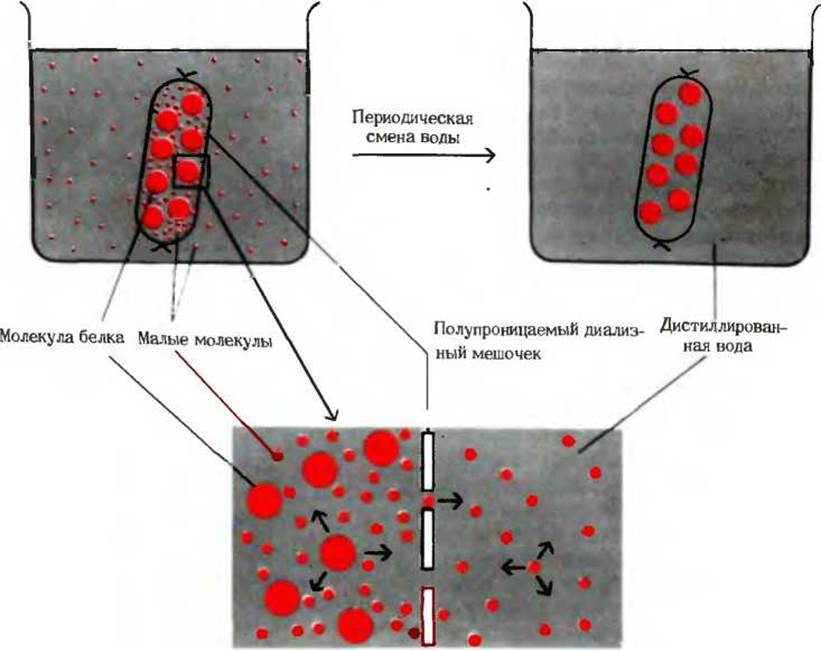
Рис. 6-3. Диализ. Мембрана, окружающая раствор белка, свободно пропускает воду и низкомолекулярные соединения, такие, как NaCl или глюкоза, но не пропускает большие молекулы, в частности молекулы белка. Малые молекулы диффундируют из диализного мешочка во внешний сосуд, так как в процессе диффузии молекулы стремятся перейти в зону с более низкой их концентрацией. Заменяя несколько раз водную фазу во внешнем сосуде на дистиллированную воду, можно снизить концентрацию низкомолекулярных соединений в растворе белка до сколь угодно малой величины.
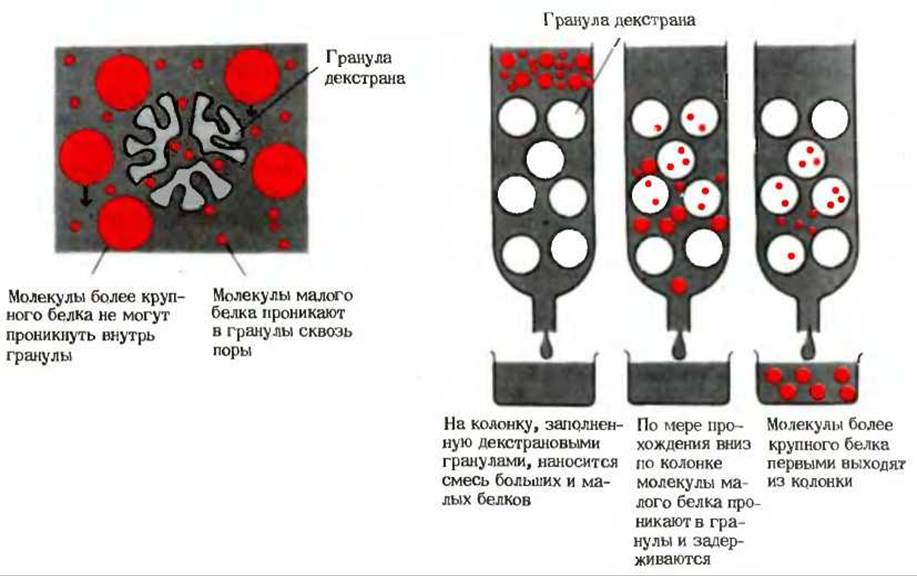
Рис. 6-4. Разделение белков в соответствии с размерами их молекул методом гель-фильтрации. Раствор, содержащий смесь белков, пропускают через колонку, заполненную очень мелкими пористыми гранулами гидрофильного полимера; широко используют для этой цели производные декстрана. Молекулы малых белков проникают внутрь гранул, тогда как более крупные молекулы не могут туда проникнуть. Молекулярную массу белка можно определить путем сравнения скорости его прохождения через колонку со скоростями прохождения других белков с известными молекулярными массами.
Белки можно отделить друг от друга также методом электрофореза (разд. 5.16). Определяющую роль в этом методе играют знак и число электрических зарядов, локализованных на R-гpyппах, концевой аминогруппе и концевой карбоксильной группе белков. Как и простые пептиды, полипептидные цепи белков характеризуются присущей им изоэлектрической точкой, которая определяется относительным числом кислых и основных R-гpyпп (табл. 6-5). При данном значении pH у одних из присутствующих в смеси белков суммарный заряд будет отрицательным, у других - положительным, а у третьих - нулевым. Если такую смесь белков поместить в электрическое поле, то белки с положительным зарядом будут перемещаться в сторону отрицательного электрода, белки с отрицательным зарядом - в сторону положительного электрода, а белки с нулевым зарядом останутся на месте. При этом белковые молекулы с более высокой плотностью заряда будут двигаться по направлению к соответствующему электроду быстрее, чем белки с более низкой плотностью заряда. Электрофорез часто проводят не в растворе, а на носителе, представляющем собой либо полоску бумаги, либо пленку ацетата целлюлозы, либо пластину гидрофильного геля, что позволяет сильно замедлить диффузию молекул фракционируемых белков в водной фазе (рис. 6-5)
Таблица 6-5. Изоэлектрические точки (pH1) некоторых белков
|
pH, |
|
|
Пепсин |
< 1,0 |
|
Яичный альбумин |
4,6 |
|
Сывороточный альбумин |
4,9 |
|
Уреаза |
5,0 |
|
ß-Лактоглобулин |
5,2 |
|
у1-Глобулин |
6,6 |
|
Гемоглобин |
6,8 |
|
Миоглобин |
7,0 |
|
Химотрипсиноген |
9,5 |
|
Цитохром с |
10,7 |
|
Лизоцим |
11,0 |
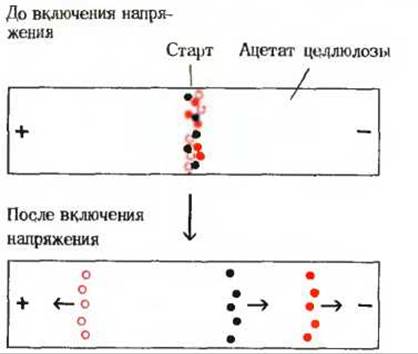
Рис. 6-5. Электрофорез смеси трех белков. Смесь белков наносят на полоску ацетата целлюлозы, смоченную буфером с заданным значением pH. Концы полоски опускают в кюветы с электродами. Ацетат целлюлозы служит носителем, предотвращающим беспорядочное перемещение молекул белка в результате диффузии. После нанесения смеси белков на середину полоски молекулы белков подвергают действию электрического поля, создаваемого разностью потенциалов между электродами. Каждый из трех белков перемещается в сторону положительного или отрицательного электрода с разной скоростью в зависимости от pH среды и кислотно - основных свойств каждого белка. По окончании электрофореза положение белков можно выявить при помощи красителей, связывающихся с белками.
Еще одним эффективным методом разделения белков является ионообменная хроматография, основанная большей частью на различиях в плотности и знаке заряда белков при данном значении pH. Таким образом, метод ионообменной хроматографии можно применять для разделения не только аминокислот (разд. 5.18) и пептидов (разд. 5 21), но и белков.
Чтобы выделить какой-то один специфический белок из смеси многих белков, нужно найти удобный способ определения концентрации этого белка, который бы контролировал каждую стадию разделения. Например, если мы ведем очистку фермента, то, измеряя его каталитическую активность, мы можем отличать его от всех других белков.