ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 3. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ - 2017
ЧАСТЬ III. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ
В клетке РНК содержится и в ядре, и в частицах цитоплазмы, и в качестве «растворимой» РНК в клеточном соке; многими специалистами было показано, что все эти три фракции РНК возобновляются по-разному. При любом обсуждении роли РНК в клетке важно представлять, что РНК крайне неоднородна с точки зрения ее метаболизма и, возможно, в связи с этим принадлежит более чем к одному типу.
— Фрэнсис Крин, статья в материалах Симпозиума Общества экспериментальной биологии, 1958
26. МЕТАБОЛИЗМ РНК
Экспрессия заложенной в гене информации обычно происходит через образование молекулы РНК, транскрибируемой с матрицы ДНК. Последовательности РНК и ДНК могут показаться, на первый взгляд, очень похожими, по химическому строению они различаются только тем, что в РНК урацил заменен на тимин, а у альдопентозы в положении 2' находится гидроксильная группа. Однако в отличие от ДНК большинство молекул РНК выполняет свои функции в виде одноцепочечных молекул, которые складываются различными способами и по сравнению с ДНК гораздо более разнообразны (см. гл. 8 в т. 1). Таким образом, РНК приспособлена к выполнению различных клеточных функций.
РНК — единственная известная макромолекула, которая участвует как в хранении, так и в передаче информации, а кроме того, и в катализе; это позволило выдвинуть гипотезу о ее участии в развитии жизни на нашей планете в качестве самого важного молекулярного предшественника. Открытие каталитических РНК, или рибозимов, изменило само представление о ферментах, функцию которых, как считалось ранее, могут выполнять только белки. Тем не менее белки необходимы для функционирования РНК. В современной клетке все нуклеиновые кислоты, включая молекулы РНК, связаны с белками. Некоторые из этих комплексов очень сложно устроены, и входящая в них РНК может совмещать структурную и каталитическую функции.
Все молекулы РНК, исключая геномные РНК некоторых вирусов, переносят информацию, которая постоянно хранится в форме ДНК. В ходе транскрипции ферментная система преобразует генетическую информацию на участке двухцепочечной ДНК в цепь РНК с последовательностью оснований, комплементарной одной из цепей ДНК. Образуется три основных типа РНК. Матричная РНК (мРНК) кодирует аминокислотную последовательность одного или нескольких полипептидов, определяемую геном или набором генов. Транспортная РНК (тРНК) считывает информацию, закодированную в мРНК, и переносит соответствующую аминокислоту на растущую полипептидную цепь в ходе синтеза белка. Рибосомная РНК (рРНК) входит в состав рибосом — сложных клеточных структур, осуществляющих синтез белков. Многие дополнительные специализированные молекулы РНК осуществляют регуляторные или каталитические функции, или являются предшественниками РНК трех выделенных выше типов. Эти РНК больше не рассматриваются в качестве минорных разновидностей в списке клеточных РНК. У позвоночных гораздо больше типов РНК, чем просто «классические» мРНК, тРНК или рРНК.
При репликации обычно копируется целая хромосома, транскрипция же более избирательна. Одномоментно транскрибируются только отдельные гены или группы генов, а некоторые части генома ДНК не транскрибируются никогда. Клетка ограничивает экспрессию генетической информации, благодаря чему образуются лишь те продукты генов, которые необходимы в данный момент. Специфические регуляторные последовательности отмечают начало и окончание транскрибируемых участков ДНК, а также то, какая цепь дуплексной ДНК должна использоваться в качестве матрицы. Подробно регуляция транскрипции описана в гл. 28.
Всю совокупность молекул РНК, производимых клеткой в определенных условиях, называют транскриптомом клетки. Учитывая, что только сравнительно небольшая часть генома человека кодирует белки, можно было бы ожидать, что транскрибируется лишь малая часть генома. Однако это не так. С помощью современных методов анализа транскрипции на микрочипах удалось установить, что значительная часть генома человека и других млекопитающих транскрибируется в РНК, причем основными продуктами являются не мРНК, тРНК или рРНК, а множество различных РНК со специфическими функциями. По-видимому, многие из них участвуют в регуляции экспрессии генов, однако роль большинства остается неизвестной.
В этой главе рассматривается процесс синтеза РНК на матрице ДНК, последующий процессинг и оборот молекул РНК. Обсуждаются многие специфические функции РНК, в том числе каталитические. Интересно, что субстратами для каталитических РНК часто служат другие молекулы РНК. Мы также рассмотрим системы, в которых молекула РНК служит матрицей, а ДНК — продуктом, а не наоборот. Информационные метаболические пути, таким образом, образуют полный цикл, демонстрируя, что синтез нуклеиновой кислоты на матрице происходит по стандартным правилам независимо от природы матрицы или продукта (РНК или ДНК). Обсуждение взаимных превращений ДНК и РНК в качестве носителей информации подводит к вопросу об эволюционном происхождении биологической информации.
26.1. ДНК-зависимый синтез РНК
Рассмотрение синтеза РНК мы начнем с сопоставления процессов транскрипции и репликации ДНК (гл. 25). Транскрипция похожа на репликацию своим основополагающим химическим механизмом, своей полярностью (направлением синтеза) и наличием матрицы. Подобно репликации, транскрипция состоит из этапов инициации, элонгации и терминации, хотя в литературе при описании транскрипции инициацию подразделяют на два самостоятельных этапа — связывание ДНК и инициацию синтеза РНК. Транскрипция отличается от репликации тем, что для нее не требуется праймер и, как правило, в ней участвуют только отдельные участки молекулы ДНК. Кроме того, матрицей для каждой конкретной молекулы РНК при транскрипции служит только одна цепь ДНК.
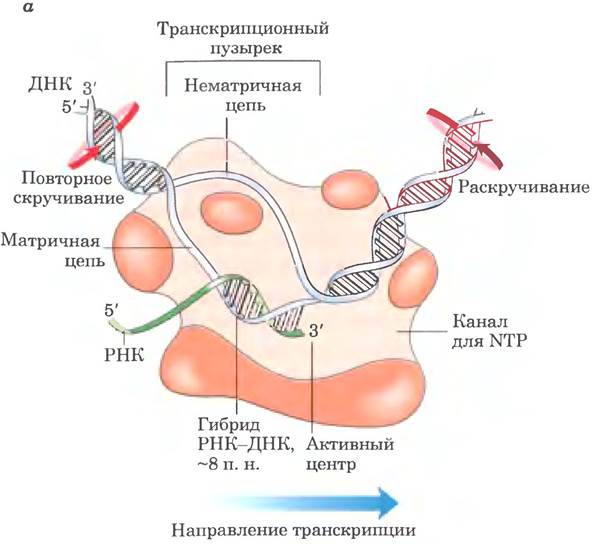
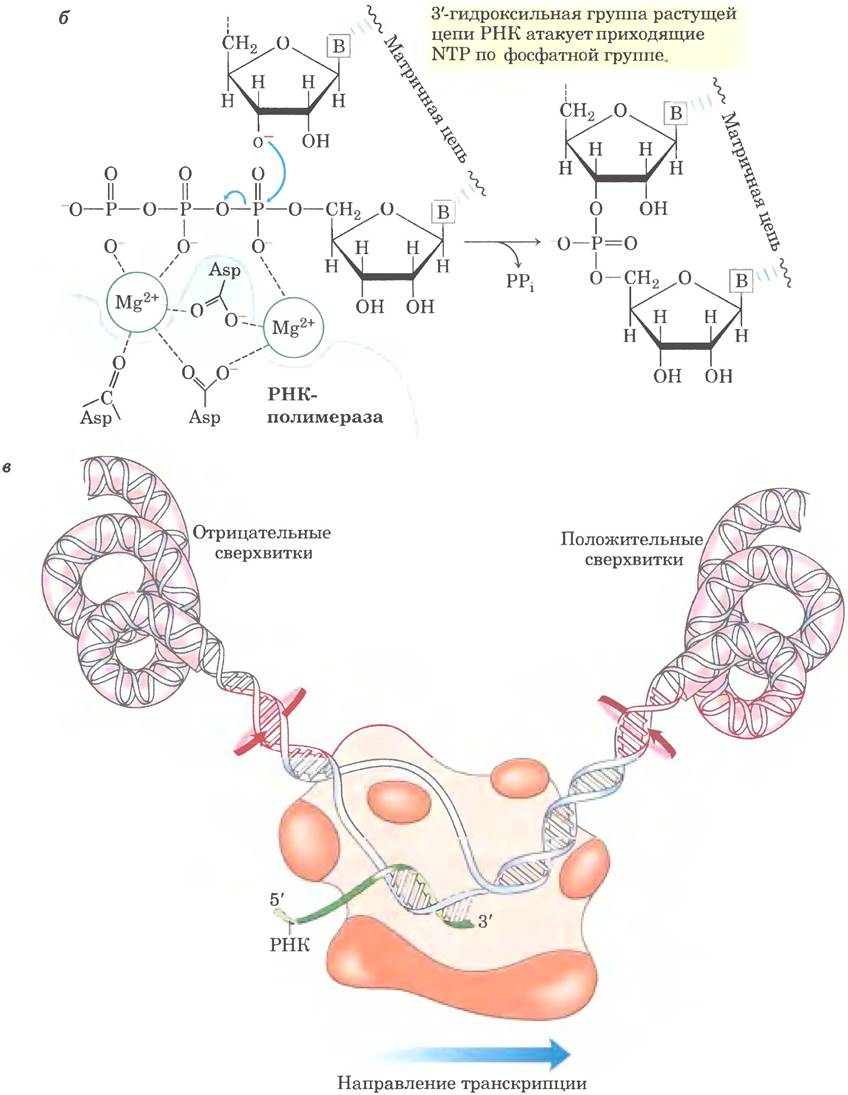
Рис. 26-1. Механизм реакции. Транскрипция у Е. coli, осуществляемая РНК-полимеразой. ДНК временно раскручивается для синтеза цепи РНК, комплементарной одной из двух цепей в двойной спирали, а — в любой момент времени в раскрученном состоянии находится участок длиной около 17 п. н. РНК-полимераза и транскрипционный пузырек по мере синтеза РНК двигаются слева направо вдоль ДНК, как показано на рисунке. Молекула ДНК раскручивается впереди и закручивается позади пузырька. Красные стрелки указывают направление, в котором ДНК должна вращаться для обеспечения этого процесса. После обратного закручивания ДНК гибрид РНК-ДНК распадается, и цепь РНК высвобождается. РНК-полимераза находится в тесном контакте с ДНК впереди транскрипционного пузырька, а также с разделенными цепями ДНК и РНК внутри и сразу за пузырьком. Через канал в белке к активному центру полимеразы поступают новые нуклеозидтрифосфаты (NTP). В процессе элонгации полимераза покрывает собой участок ДНК длиной около 35 п. н. б — механизм синтеза РНК с помощью РНК-полимеразы похож на механизм действия ДНК-полимеразы (см. рис. 25-5, б). В реакции принимают участие два иона Мg2+, координированных по фосфатным группам поступающего NTP и трем остаткам Asp (Asp460, Asp462 и Asp464 в (β'-субъединице РНК-полимеразы Е. coli), которые консервативны в РНК-полимеразах у всех видов. Один ион Мg2+ способствует присоединению 3'-гидроксила к α-фосфату NTP; другой Мg2+ обеспечивает уход пирофосфата; и тот и другой Мg2+ временно стабилизируют пятикоординационное состояние, в — при транскрипции происходит изменение суперскручивания ДНК. Движение РНК-полимеразы вдоль ДНК вызывает появление положительных сверхвитков (перекрученная ДНК) впереди транскрипционного пузырька и отрицательных сверхвитков (частично раскрученная ДНК) позади него. Топоизомеразы быстро удаляют положительные сверхвитки и регулируют отрицательное суперскручивание (гл. 24)
РНК синтезирует РНК-полимераза
Открытие ДНК-полимеразы, зависящей от матрицы ДНК, подстегнуло поиск фермента, синтезирующего молекулу РНК, комплементарную цепи ДНК. К 1960 г. четыре группы исследователей независимо друг от друга обнаружили в клеточных экстрактах фермент, который может формировать полимер РНК из рибонуклеозид-5'-трифосфатов. Последующее изучение очищенной РНК-полимеразы Escherichia coli помогло установить основные принципы транскрипции (рис. 26-1). Для ДНК- зависимой РНК-полимеразы необходимы, помимо матрицы ДНК, все четыре рибонуклеозид-5'- трифосфата (ATP, GTP UTP и СТР) в качестве нуклеотидных предшественников РНК, а также ионы Mg2+. Фермент, кроме того, связывает один катион Zn2+. По химической сути и механизму синтез РНК очень напоминают синтез ДНК ДНК-полимеразой (см. рис. 25-5). РНК-полимераза удлиняет цепь РНК, добавляя рибонуклеотидные звенья к 3'-гидроксильному концу и надстраивая РНК в направлении 5' —> 3'. Гидроксильная группа на 3'-конце действует как нуклеофил, атакуя α-фосфат поступающего рибонуклеозидтрифосфата (рис. 26-1, б) и высвобождая пирофосфат. В общем виде реакция выглядит следующим образом:
![]()
РНК-полимераза нуждается в ДНК, и ее активность максимальна при связывании с двухцепочечной ДНК. Выше отмечалось, что матрицей служит только одна цепь ДНК. Матричная цепь ДНК копируется в направлении 3' —> 5' (противоположном росту новой цепи РНК), как и при репликации ДНК. Каждый нуклеотид в новой РНК присоединяется по правилу Уотсона-Крика: остаток U в РНК встраивается в пару к остатку А в матрице ДНК, а остаток G — в пару к остатку С. При выборе пары может иметь значение геометрия пар оснований (см. рис. 25-6).
В отличие от ДНК-полимеразы РНК-полимераза не нуждается в праймере для инициации синтеза. Инициация происходит при связывании РНК-полимеразы со специфическими последовательностями ДНК — промоторами (описаны ниже). 5'-Трифосфатная группа первого остатка в синтезируемой молекуле РНК не расщепляется с высвобождением РРi, а сохраняется на протяжении всего процесса транскрипции. На стадии элонгации основания на растущем конце новой цепи РНК временно образуют пары с основаниями в матрице ДНК, что приводит к формированию короткого участка гибридной двойной спирали РНК-ДНК длиной около 8 п. н. (рис. 26-1, а). Вскоре после образования этой структуры РНК покидает дуплекс, и заново формируется дуплекс ДНК.
Чтобы РНК-полимераза могла синтезировать цепь РНК, комплементарную одной из двух цепей ДНК, ДНК-дуплекс на коротком участке расплетается, образуя транскрипционный «пузырек». В клетках Е. coli РНК-полимераза обычно оставляет раскрученными примерно 17 п. н., из них 8 п. н. образуют гибрид РНК-ДНК. Удлинение транскрипта РНК-полимеразой Е. coli происходит со скоростью от 50 до 90 нуклеотидов в секунду. Поскольку ДНК находится в виде спирали, для продвижения пузырька требуется поворот цепей молекул нуклеиновой кислоты. В большинстве молекул ДНК вращение цепи ограничивается ДНК-связывающими белками и другими структурными барьерами. В результате движущаяся РНК-полимераза генерирует серию положительных сверхвитков впереди транскрипционного пузырька и отрицательных сверхвитков позади него (рис. 26-1, в). Этот процесс происходит как in vitro, так и in vivo (у бактерий). В клетке топологические проблемы, связанные с транскрипцией, разрешаются благодаря действию топоизомераз (гл. 24).
Ключевые договоренности.
При транскрипции две комплементарные цепи ДНК выполняют разные функции. Цепь, которая служит матрицей для синтеза РНК, называется матричной цепью. Комплементарная ей нематричная, или кодирующая, цепь идентична по нуклеотидной последовательности, транскрибируемой с данного гена РНК, с тем лишь отличием, что РНКсодержит U вместо Т (рис. 26-2). Для конкретного гена кодирующей цепью может быть любая цепь данной хромосомы (как показано на рис. 26-3 для вируса). По договоренности, регуляторные последовательности, которые контролируют транскрипцию (описаны ниже в этой главе), обозначаются на кодирующей цепи. ■
Рис. 26-2. Матричная и нематричная (кодирующая) цепи ДНК. Две комплементарные цепи ДНК выполняют в ходе транскрипции разные функции. Транскрипт РНК, синтезированный на матричной цепи, идентичен последовательности нематричной, или кодирующей, цепи (с учетом замены Т на U).

Рис. 26-3. Кодирование информации в геноме аденовируса. Генетическая информация генома аденовируса (самый простой пример) закодирована в молекуле двухцепочечной ДНК размером 36 000 п. н., обе цепи которой кодируют белки. Информация о большинстве белков закодирована в верхней цепи по договоренности цепь ориентирована слева направо от 5'-конца к 3'-концу. Для этих транскриптов нижняя цепь играет роль матрицы. Однако некоторые белки кодируются нижней цепью ДНК, которая транскрибируется в противоположном направлении (для них матрицей служит верхняя цепь). В реальности синтез молекул мРНК аденовируса намного сложнее. Многие молекулы мРНК, показанные на верхней цепи, сначала синтезируются в виде единого длинного транскрипта (из 25 000 нуклеотидов), который затем подвергается процессингу, превращаясь в отдельные молекулы мРНК. Аденовирусы вызывают инфекции верхних дыхательных путей у некоторых позвоночных.
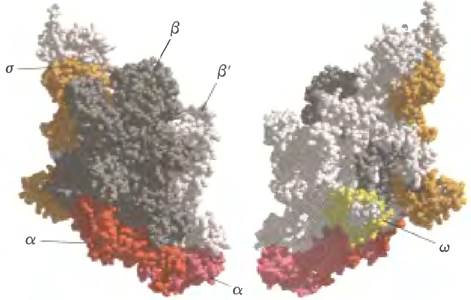
ДНК-зависимая РНК-полимераза Е. coli - большой сложный фермент, состоящий из пяти субъединиц α2ββ'ω (называется кор-частицей: Мr = 390 000) и шестой субъединицы о, имеющей различающиеся по размеру (по молекулярной массе) варианты. Субъединица о временно связывается с кор-частицей и направляет фермент к специфическому участку в молекуле ДНК (показано ниже). Эти шесть субъединиц составляют холофермент РНК-полимеразы (рис. 26-4). Холофермент РНК-полимеразы Е. coli существует, таким образом, в нескольких формах в зависимости от типа α-субъединицы. Обычно это субъединица σ70 (Мr = 70 000), и далее мы будем говорить именно об этом варианте холофермента РНК-полимеразы.
Рис. 26-4. Строение холофермента РНК-полимеразы бактерии Thermus aquaticus (на основании PDB ID 1IW7). В целом строение фермента очень напоминает структуру РНК-полимеразы Е. coli (здесь не показаны ни РНК, ни ДНК). β-Субъединица выделена темно-серым цветом, β'- субъединица светло-серым; две α-субъединицы показаны разными оттенками красного; ω-субъединица желтая; σ-субъединица бежевая. Изображение слева ориентировано так же, как на рис. 26-6. При повороте структуры на 180° вокруг оси у (справа) становится видна небольшая субъединица ω.
РНК-полимеразы не имеют независимой 3' —> 5'-экзонуклеазной активности для исправления ошибок (как многие ДНК-полимеразы), и частота ошибок при транскрипции выше, чем при репликации хромосомной ДНК — примерно одна ошибка на каждые 104-105 встроенных рибонуклеотидов. Поскольку с одного гена обычно образуется множество копий РНК, и все молекулы РНК в конечном итоге разрушаются и удаляются, ошибка в молекуле РНК не имеет для клетки столь серьезных последствий, как ошибки в ДНК — постоянном источнике информации. Многие РНК-полимеразы, в том числе бактериальная РНК-полимераза и эукариотическая РНК-полимераза II (обсуждается ниже), останавливаются, если в холе транскрипции добавляется неправильное основание, и могут удалять аномальные нуклеотиды с 3'-конца транскрипта благодаря реакции, обратной полимеразной реакции. Но пока неизвестно, является ли эта активность истинно корректирующей активностью и каков ее вклад в точность транскрипции.
Синтез РНК начинается с промоторов
Инициация синтеза РНК в случайных точках молекулы ДНК была бы недопустимой расточительностью. Поэтому РНК-полимераза связывается со специфическими последовательностями ДНК, называемыми промоторами, которые направляют транскрипцию прилежащих участков ДНК (генов). Последовательности ДНК для связывания РНК- полимераз достаточно разнообразны, идентификации этих последовательностей, определяющих функцию промотора, посвящены многие исследования.
Связывание РНК-полимеразы Е. coli происходит в области, начинающейся примерно за 70 п. н. до точки начала транскрипции и заканчивающейся через 30 п. н. после нее. По договоренности, пары оснований ДНК, соответствующие началу молекулы РНК, имеют положительную нумерацию, а расположенные выше точки начала транскрипции — отрицательную. Таким образом, область промотора расположена на участке между позициями -70 и +30. Сравнительный анализ бактериальных промоторов наиболее распространенного класса (распознаваемых холоферментом РНК-полимеразы, содержащим σ70) выявил характерные последовательности около позиций -10 и -35 (рис. 26-5). Эти последовательности важны для взаимодействия с субъединицей σ70. Хотя эти последовательности не идентичны для всех бактериальных промоторов данного класса, некоторые нуклеотиды, которые чаще всего встречаются в конкретной позиции, образуют консенсусную последовательность (вспомните последовательность оriС у Е. coli; см. рис. 25-11). Консенсусная последовательность в области - 10: (5') ТАТААТ (3'); консенсусная последовательность в области - 35: (5') TTGACA (3'). Третий, богатый основаниями АТ фрагмент называется UP-элементом (от англ, upstream promoter — выше промотора); он находится между позициями -40 и -60 в промоторах некоторых активно экспрессируемых генов. UP-элемент связывается с α-субъединицей РНК-полимеразы. Эффективность, с которой РНК-полимераза связывается с промотором и инициирует транскрипцию, в значительной степени определяется этими последовательностями, расстоянием между ними и их удаленностью от точки начала транскрипции.
Рис. 26-5. Типичные промоторы Е. coli, распознаваемые холоферментом РНК-полимеразы, содержащим σ70. Последовательности нематричной цепи представлены обычным способом (в направлении 5' —> 3'). Последовательности разных промоторов различаются, но при сравнении многих промоторов выявляется некоторое сходство, особенно в позициях -10 и -35. UP-элемент, имеющийся не во всех промоторах Е. coli, обнаружен в промоторе Р1 активно экспрессирующейся рРНК гена rrnВ. UP-элементы, обычно расположенные в области от -40 до -60, эффективно стимулируют транскрипцию с содержащих эти элементы промоторов. В промоторе rrnВ Р1 UP-элемент охватывает область от -38 до -59. Консенсусная последовательность для промоторов Е. coli, распознаваемая σ70, показана второй сверху. В промежуточных участках (спейсерах) слабо различающееся число нуклеотидов (N). Показан только первый нуклеотид последовательности, кодирующей транскрипт (позиция +1).

Дополнение 26-1. ПРАКТИЧЕСКАЯ БИОХИМИЯ. РНК-полимераза оставляет свой след на промоторе
Метод футпринтинга основан на принципах, применяемых при секвенировании ДНК, и позволяет идентифицировать последовательности ДНК. связанные с конкретным белком. Выделяют фрагмент ДНК, который предположительно содержит последовательности, распознаваемые ДНК-связывающим белком, и радиоактивно метят один конец одной из цепей (рис. 1). Затем с помощью химических реагентов или ферментов во фрагмент ДНК вносят несколько разрывов (в среднем один разрыв на молекулу). При разделении меченых продуктов расщепления (расщепленные фрагменты разной длины) методом электрофореза с высоким разрешением образуется «забор» радиоактивных полос. В отдельной пробирке повторяют такую же процедуру расщепления того же фрагмента ДНК, но в присутствии ДНК-связывающего белка. Затем два набора продуктов подвергают электрофорезу, нанося на соседние дорожки, и сравнивают полученные результаты. Пробел («футпринт») в серии радиоактивных полос в образце ДНК с белком соответствует фрагменту, защищенному ДНК-связывающим белком. Так можно определить последовательности, с которыми связывается белок.
Рис. 1. Метод футпринтинга для идентификации участка связывания полимеразы на фрагменте ДНК. Разделение проводят в присутствии (+) и в отсутствие (-) полимеразы.
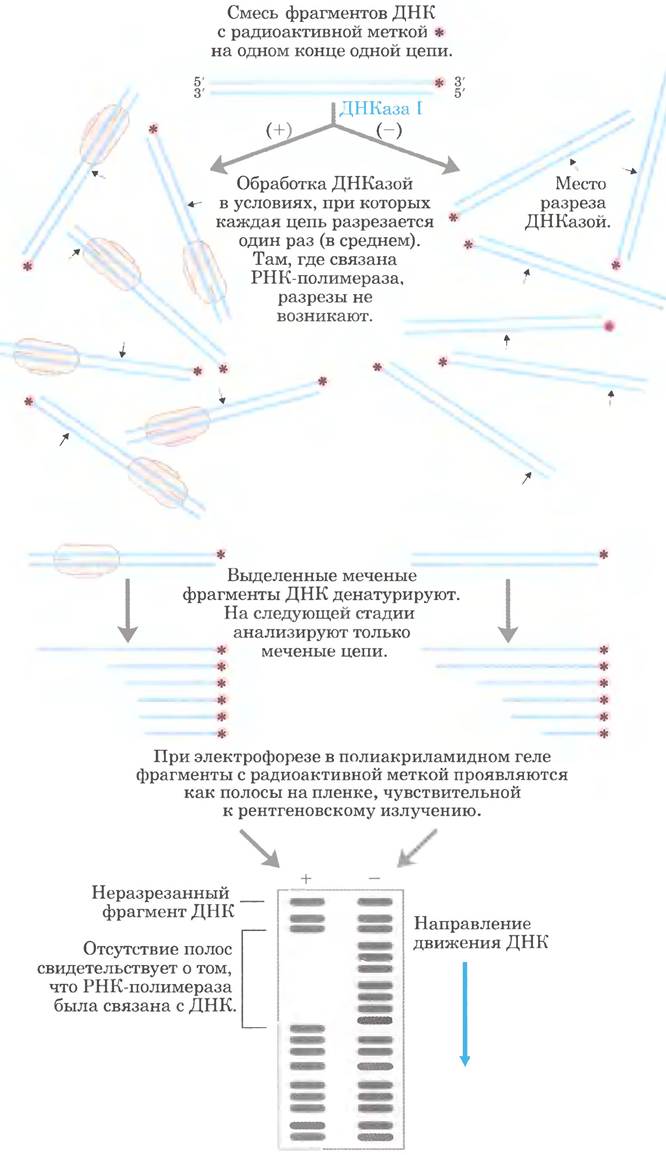
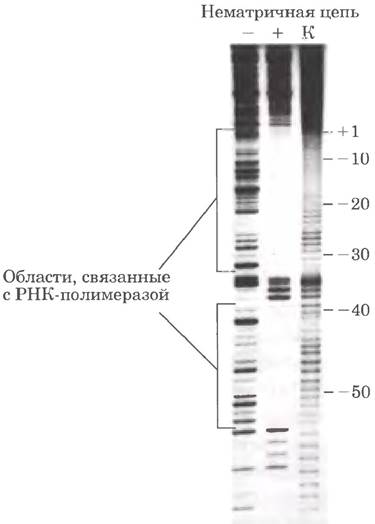
Точное положение участка связывания белка можно установить прямым секвенированием (рис. 8-34 в т. 1) того же фрагмента ДНК с последующим разделением продуктов в том же геле (не показано). На рис. 2 представлены результаты связывания РНК- полимеразы с фрагментом ДНК, содержащим промотор. Полимераза покрывает участок длиной от 60 до 80 п. н.; защищенными оказываются, в том числе, области -10 и -35.
Рис. 2. Определение участка связывания РНК-полимеразы с lас-промотором (см. рис. 26-5). В этом эксперименте 5'-конец нематричной цепи содержал радиоактивную метку. На дорожке К нанесен контроль, в котором меченую ДНК расщепляли химическим реагентом, что позволило получить картину с равномерным распределением полос.
Функциональное значение последовательностей в позициях -10 и -35 подтверждается множеством независимых доказательств, Мутации, вли
яющие на работу промотора, часто затрагивают основания из этих областей. Изменения в консенсусной последовательности также влияют на эффективность связывания РНК-полимеразы и инициацию транскрипции. Замена лишь одной пары оснований может снизить эффективность связывания на несколько порядков. Таким образом, промоторная последовательность задает базовый уровень экспрессии, который для разных генов Е. coli может существенно различаться. Метод изучения взаимодействия между РНК-полимеразой и промоторами обсуждается в доп. 26-1.
Постепенно проясняется механизм инициации транскрипции и роль σ-субъединицы (рис. 26-6, а). Процесс инициации состоит из двух основных этапов, связывания и собственно инициации, причем каждый этап осуществляется в несколько стадий. Сначала полимераза, направляемая фактором а. связывается с промотором, в результате чего последовательно образуются закрытый комплекс (в котором связанная ДНК остается интактной) и открытый комплекс (в котором связанная ДНК частично раскручивается около позиции - 10). Затем в комплексе начинается транскрипция, что приводит к конформационному изменению — комплекс переходит в форму, характерную для элонгации, после чего сдвигается с промотора (высвобождение промотора). Каждая из этих стадий зависит от специфической последовательности промотора. При переходе полимеразы к стадии элонгации субъединица о спонтанно диссоциирует. Участие РНК-полимеразы в элонгации схематично отражено на рис. 26-6, б. Белок NusA (Мr = 54 430) связывается с РНК-полимеразой, конкурируя с σ-субъединицей. После окончания транскрипции NusA отсоединяется от фермента, РНК-полимераза диссоциирует из комплекса с ДНК, а фактор σ (σ70 или другой) может связываться с ферментом, чтобы снова инициировать транскрипцию; этот цикл иногда называют σ-циклом (рис. 26-7).
Рис. 26-6. Инициация и элонгация транскрипции РНК-полимеразой Е. coli. а — инициация транскрипции обычно включает две основные стадии — связывание и инициацию. При связывании инициирующее взаимодействие РНК-полимеразы с промотором приводит к закрытому комплексу, в котором промоторная ДНК прочно связывается, но не раскручивается. Затем фрагмент ДНК размером 12-15 п. н. в области от -10 до +2 или +3 раскручивается, образуя открытый комплекс. На стадиях, предшествующих закрытому и открытому комплексам, были обнаружены дополнительные промежуточные соединения и несколько конформационных изменений белков (не показаны). При инициации транскрипции происходит высвобождение промотора. После синтеза первых 8 или 9 нуклеотидов новой РНК субъединица о высвобождается, полимераза покидает промотор и осуществляет элонгацию РНК. б — строение кор-частицы РНК-полимеразы Е. coli на стадии элонгации. Окраска субъединиц такая же, как на рис. 26-4: β- и β'-субъединицы — темно- и светло-серые; α-субъединицы красные; ω-субъединица в этом ракурсе не видна. σ-Субъединица отсутствует, так как она отделилась после инициации. Вверху показан комплекс в целом, с фрагментами ДНК и РНК. Активный центр транскрипции находится в щели между β- и β'- субъединицами. На среднем рисунке β-субъединица не показана, так что видны активный центр и область гибридизации ДНК-РНК. В активном центре находится ион Mgz+ (красная точка). На нижнем рисунке все белки удалены, чтобы показать, как ДНК и РНК протягиваются через комплекс.
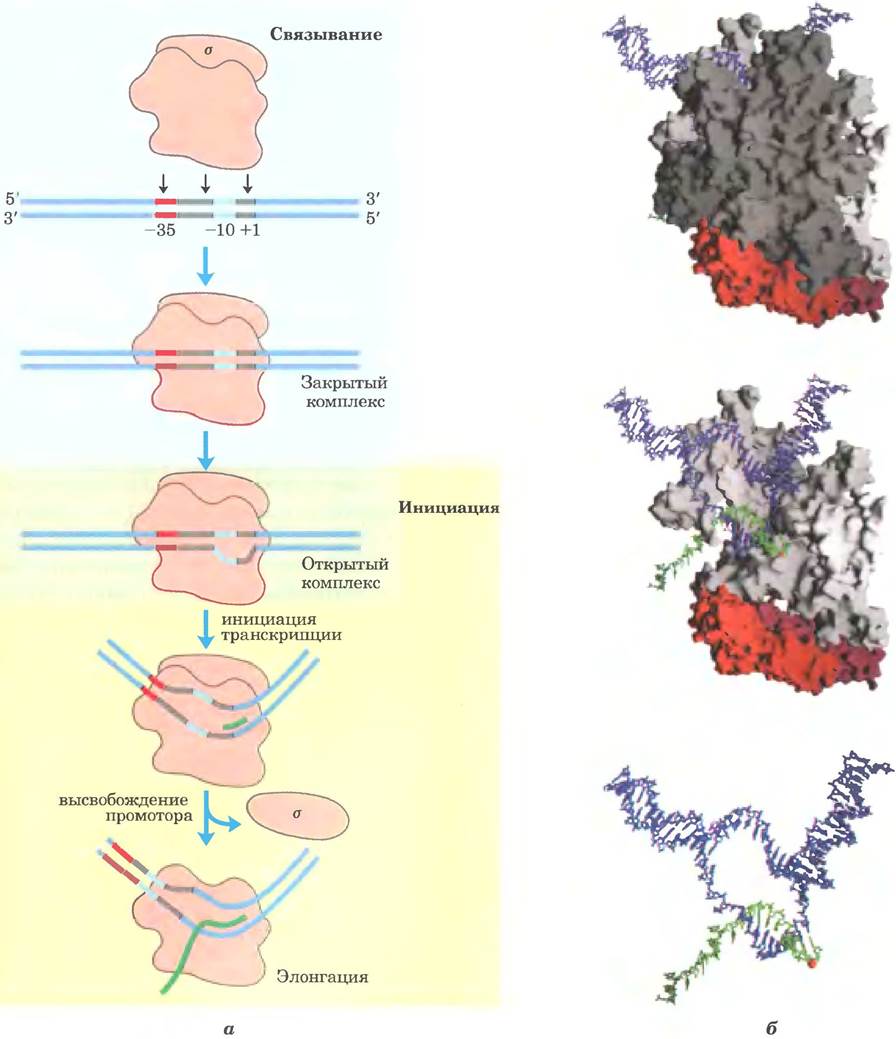
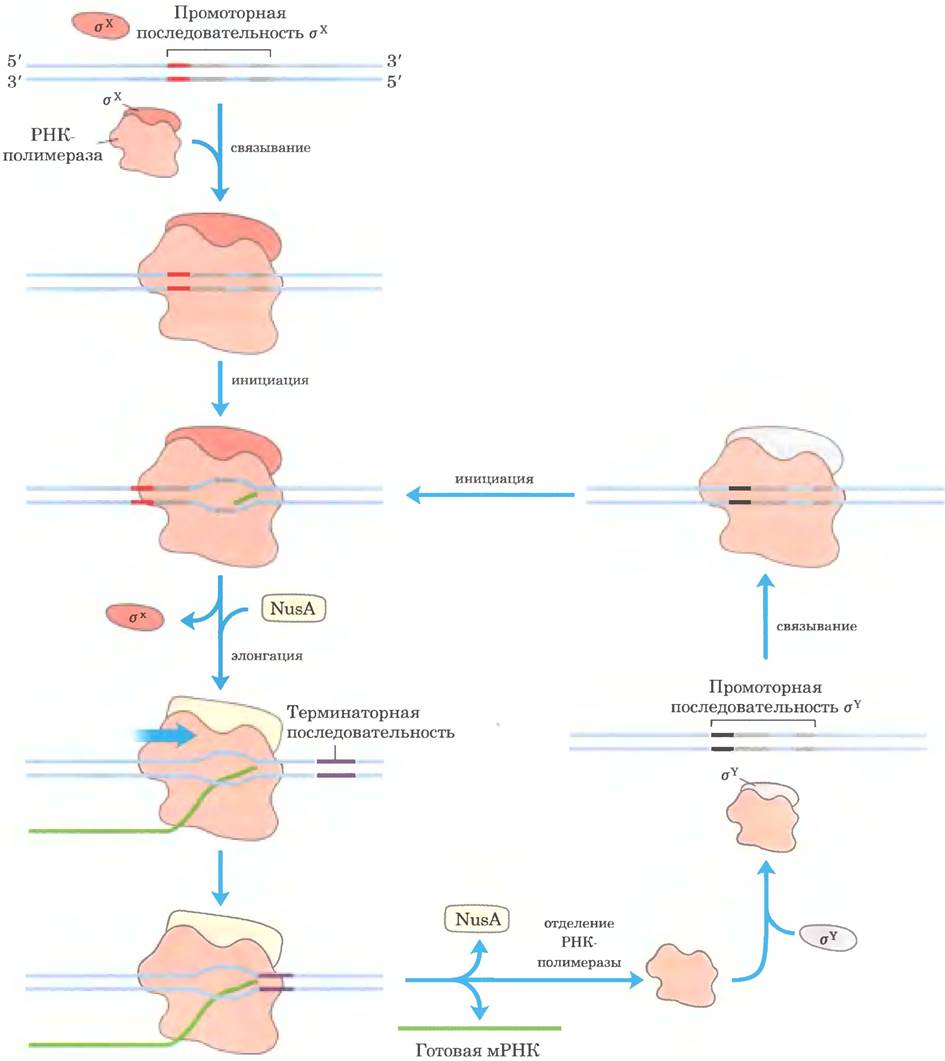
Рис. 26-7. Роль a-факторов в транскрипции. РНК-полимераза, направляемая связанной σ-субъединицей, связывается с ДНК в области промотора. Как только происходит инициация синтеза РНК, σ-субъединица отсоединяется и замещается белком NusA. Когда РНК-полимераза достигает терминирующей последовательности, синтез РНК прекращается, NusA высвобождается из комплекса с полимеразой, а РНК-полимераза отсоединяется от ДНК. Свободная полимераза может связаться с любой σ-субъединицей. Тип связанной субъединицы определяет, с каким промотором свяжется РНК-полимераза в следующем раунде синтеза.
В ДНК Е. coli есть и другие классы промоторов, с которыми связываются холоферменты РНК-полимеразы с другими σ-субъединицами (табл. 26-1), например, промоторы генов теплового шока. Продукты этих генов образуются в более высокой концентрации, если клетка подвергается сильному воздействию, такому как внезапное повышение температуры. РНК-полимераза связывается с промоторами этих генов, только когда субъединица σ70 заменяется субъединицей σ32 (Мr = 32 000), специфичной к промоторам белков теплового шока (см. рис, 28-3). С помощью различных σ-субъединиц клетка может координировать экспрессию, что позволяет ей значительно изменять свое физиологическое состояние. Какой именно набор генов будет экспрессироваться, зависит от доступности различных σ-субъединиц, что в свою очередь определяется рядом факторов: регулируемой скоростью синтеза и деградации, постсинтетическими модификациями, переводящими отдельные σ-субъединипы из активной формы в неактивную и обратно, а также специализированным классом анти-σ-белков, связывающихся с определенным типом σ-субъединиц и делающих их недоступными для инициации транскрипции.
Таблица 26-1. Семь типов субъединиц σ у Escherichia coli
Субъединица σ |
Kd(нмоль/л) |
Число молекул на клетку* |
Доля этого холофермента (%)* |
Функция |
σ70 |
0,26 |
700 |
78 |
Гены домашнего хозяйства |
σ54 |
0,30 |
110 |
8 |
Регуляция уровня азота в клетке |
σ38 |
4,26 |
<1 |
0 |
Гены стационарной фазы |
σ32 |
1,24 |
<10 |
0 |
Гены теплового шока |
σ28 |
0,74 |
370 |
14 |
Гены жгутика и хемотаксиса |
σ24 |
2,43 |
<10 |
0 |
Внецитоплазматические функции; участие в реакции на тепловой шок |
σ18 |
1,73 |
<1 |
0 |
Внецитоплазматические функции, включая транспорт цитрата железа |
* Приблизительное число σ-субъединиц каждого типа в клетке, а также доля холофермента РНК-полимеразы, образующего комплекс с этой σ-субъединицей в экспоненциальной фазе роста. Эти значения зависят от условий роста Доля молекул РНК-полимеразы, образующих комплекс с каждой σ-субъединицей, отражает как количество субъединиц этого типа, так и их сродство к ферменту.
Транскрипция регулируется на нескольких уровнях
Потребности в продуктах любых генов изменяются в зависимости от состояния клетки и стадии развития, и транскрипция каждого гена строго регулируется, чтобы обеспечить синтез конкретного продукта в строго определенном количестве. Регуляция может происходить на любой стадии транскрипции, включая элонгацию и терминацию. Однако часто регуляции подвергаются стадии связывания полимеразы и инициации транскрипции, изображенные на рис. 26-6, а. Один из примеров
многоуровневого контроля — наличие промоторов с различными последовательностями.
Связывание белков с последовательностями вблизи и вдали от промотора также оказывает влияние на уровень экспрессии генов. Связывание белка может активировать транскрипцию, облегчая связывание РНК-полимеразы, или подавлять транскрипцию, блокируя активность полимеразы. У Е. coli одним из активирующих транскрипцию белков является сАМР-рецепторный белок (CRP), который при отсутствии глюкозы в среде роста усиливает транскрипцию генов, кодирующих ферменты метаболизма отличных от глюкозы сахаров. Белки-репрессоры блокируют синтез РНК специфических генов. Например, Lac-репрессор (гл. 28) блокирует транскрипцию генов ферментов, участвующих в метаболизме лактозы, когда лактоза недоступна.
Транскрипция — первая стадия в сложном и энергозатратном процессе синтеза белка, поэтому регуляция концентрации белков как у бактерий, так и у эукариот часто осуществляется на уровне транскрипции, особенно на ее ранних стадиях. В гл. 28 рассмотрены различные механизмы, с помощью которых осуществляется такая регуляция.
Специфические последовательности подают сигнал прекращения синтеза РНК
Синтез РНК происходит с высокой процессивностью (см. с. 50), поскольку, если РНК-полимераза высвободит транскрипт РНК преждевременно, она не сможет закончить синтез, и ей придется начинать заново. Однако наличие определенных последовательностей ДНК вызывает остановку, а иногда и прекращение (терминацию) синтеза РНК. Механизм терминации у эукариот еще не до конца изучен, поэтому мы обратимся к бактериям. Клетки Е. coli имеют по меньшей мере два типа сигналов терминации: один связан с белковым фактором р, другой р-независимый.
Большинство p-независимых терминаторов отличаются двумя свойствами. Во-первых, они содержат последовательность, транскрипт которой имеет комплементарные участки, образующие структуры в виде шпильки (см. рис. 8-19, а вт. 1), расположенные па расстоянии 15-20 нуклеотидов от дальнего конца цепи РНК. Во-вторых, их матричная цепь содержит консервативную последовательность из трех остатков А, которые при транскрипции превращаются в остатки U вблизи 3'-конца шпильки. Когда полимераза достигает сайта терминации, который содержит эту структуру, она останавливается (рис. 26-8). При формировании шпильки в РНК разрывается несколько пар оснований A = U в гибриде РНК-ДНК и нарушаются важные контакты между РНК и РНК-полимеразой, что облегчает диссоциацию транскрипта.
Рис. 26-8. Модель p-независимой терминации транскрипции в клетках Е. coli. РНК-полимераза останавливается в разных участках последовательности ДНК, в том числе в терминаторах. Это может приводить к двум результатам: либо полимераза обходит препятствие и продолжает движение, либо комплекс претерпевает конформационные изменения и изомеризуется. В последнем случае спаривание внутримолекулярных комплементарных участков в только что синтезированном транскрипте может приводить к образованию шпильки, разрушающей РНК-ДНК-гибрид и/или взаимодействию между РНК и полимеразой, что вызывает изомеризацию. Нестабильным является AUU-гибридный участок на 3'-конце нового транскрипта, и РНК полностью выходит из комплекса, что приводит к терминации транскрипции. Именно это обычно происходит при встрече РНК-полимеразы с терминаторами. После изомеризации комплекс может продолжить синтез РНК в других участках.
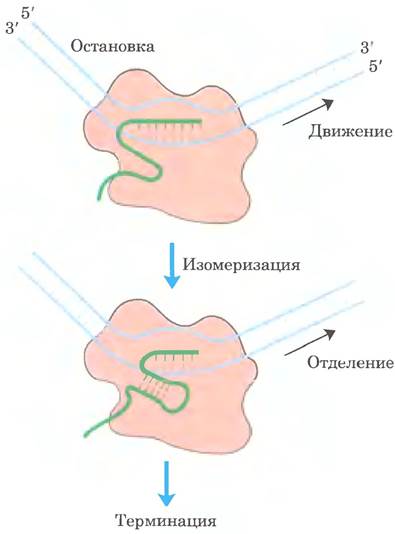
В p-зависимых терминаторах нет повторяющихся остатков А в матричной цепи, но обычно присутствует СА-богатая последовательность, называемая rut-элементом (от англ. rho utilization — «ро»-использующая последовательность). Белок р связывается со специфическим участком РНК и перемещается в направлении 5' —> 3' до тех пор, пока не достигнет транскрипционного комплекса, остановившегося на сайте терминации. Здесь он способствует высвобождению РНК-транскрипта. Белок р обладает ATP-зависимой РНК-ДНК-хеликазной активностью, которая способствует перемещению белка вдоль РНК; при терминации р-белок осуществляет гидролиз АТР. Детальный механизм, посредством которого этот белок способствует высвобождению РНК-транскрипта, пока неизвестен.
В клетках эукариот содержатся РНК-полимеразы трех типов
Механизм транскрипции в ядрах эукариотических клеток намного сложнее, чем у бактерий. Эукариоты имеют три РНК-полимеразы (I, II и III), которые различаются составом комплекса, но имеют некоторые общие субъединицы. Каждая полимераза выполняет особую функцию и присоединяется к специфической промоторной последовательности.
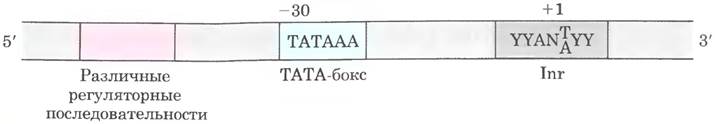
РНК-полимераза I (PolI) отвечает за синтез только одного типа РНК — прерибосомной РНК (пре-рРНК), которая содержит предшественников 18S, 5,8S и 28S рРHК (см. рис. 26-25). Последовательности промоторов Pol I существенно различаются у разных видов. Важная функция РНК- полимеразы II (Pol II) — синтез молекул мРНК и некоторых специализированных молекул РНК. Этот фермент распознает тысячи промоторов с сильно различающимися последовательностями. Многие промоторы Pol II обладают несколькими общими свойствами, в том числе содержат ТАТА- бокс (эукариотическая консенсусная последовательность ТАТААА) вблизи позиции -30 и Inr- последователыюсть (инициатор) вблизи точки начала синтеза РНК в позиции +1 (рис. 26-9).
Рис. 26-9. Распространенные последовательности промоторов, распознаваемые эукариотической РНК-полимеразой II. Точкой сборки белков преинициаторных комплексов Pol II является ТАТА-бокс. ДНК в инициаторной последовательности (Inr) расплетается, а точка начала транскрипции обычно находится в этой последовательности или в непосредственной близости от нее. В представленной здесь консенсусной последовательности Inr N обозначает любой нуклеотид, a Y — пиримидиновый нуклеотид. Многие дополнительные последовательности служат участками связывания для большого числа белков, влияющих на активность Pol II. Эти последовательности важны для регуляции промоторов Pol II и значительно различаются по типу и количеству; как правило, промоторы эукариот намного сложнее, чем показано здесь (см. рис. 15-23 в т. 2). Многие последовательности расположены на расстоянии нескольких сотен пар оснований от ТАТА-бокса с 5'-стороны, другие могут быть удалены на тысячи пар оснований. Представленные здесь консенсусные последовательности эукариотических промоторов Pol П различаются намного сильнее, чем в промоторах Е. coli (см. рис. 26-5). Во многих промоторах Pol П отсутствует либо ТАТА-бокс или элемент Inr, либо обе последовательности. Один или несколько транскрипционных факторов распознают дополнительные последовательности около ТАТА-бокса или ниже по последовательности (справа в данном случае).
РНК-полимераза III (Pol III) образует молекулы тРНК, 5S рРНК и некоторые другие небольшие специализированные молекулы РНК. Промоторы, распознаваемые Pol III, хорошо охарактеризованы. Интересно, что некоторые последовательности, необходимые полимеразе III для осуществления регулируемой инициации транскрипции, расположены в самом гене, а другие локализованы более традиционно выше точки начала транскрипции (гл. 28).
Для проявления активности РНК-полимеразы II требуются другие белковые факторы
РНК-полимераза II играет ведущую роль в экспрессии эукариотических генов и поэтому активно изучалась. Хотя эта полимераза значительно сложнее своего бактериального аналога, за сложностью скрывается удивительная консервативность структуры, функции и механизма действия. Фермент Pol II из дрожжей имеет гигантский размер и состоит из 12 субъединиц. Самая крупная субъединица RBP1 обладает значительной гомологией с β′-субъединицей бактериальной РНК-полимеразы. Другая субъединица RBP2 по структуре похожа на бактериальную β-субъединицу, еще две субъединицы RBP3 и RP11 имеют некоторую структурную гомологию с двумя бактериальными α-субъединицами. Полимеразе Pol II приходится действовать в гораздо более сложных геномах и взаимодействовать с гораздо более сложно упакованными молекулами ДНК, чем у бактерий. Дополнительная сложность полимеразы эукариот объясняется необходимостью ориентироваться в лабиринте из множества белковых факторов и вступать с ними в белок-белковые взаимодействия.
Самая крупная субъединица Pol II обладает необычным свойством: на С-конце она имеет длинную аминокислотную последовательность, состоящую из многократно повторяющейся консенсусной последовательности семи аминокислот -YSPTSPS-. В ферменте дрожжей содержится 27 таких повторов (18 из них в точности соответствуют консенсусной последовательности), а в ферментах мыши и человека — по 52 повтора (21 точный). Этот С-концевой домен CTD (от англ. carboxyl-terminal domain) отделен от основного тела фермента неструктурированной линкерной последовательностью. Как показано ниже, CTD необходим для выполнения множества функций Pol II.
Таблица 26-2. Белки, необходимые для инициации транскрипции с промоторов РНК-полимеразы II (Pol II) у эукариот
Белок |
Количествосубъединиц |
Мr субъединиц |
Функции |
Инициация Pol II |
12 |
10 000-220 000 |
Катализирует синтез РНК |
ТВР (ТАТА- связывающий белок) |
1 |
38 000 |
Распознает ТАТА-бокс |
TFIIA |
3 |
12 000.19 000, 35 000 |
Стабилизирует связывание TFIIB и ТВР с промотором |
TFIIB |
1 |
35 000 |
Связывается с ТВР; собирает комплекс Pol II-TFIIF |
TFIIE |
2 |
34 000, 57 000 |
Собирает TFIIH; обладает АТРазной и хеликазной активностями |
TFIIF |
2 |
30 000, 74 000 |
Прочно связывается с Pol II; связывается с TFIIB и препятствует неспецифическому связыванию Pol II с ДНК |
TFIIH |
12 |
35 000-89 000 |
Раскручивает ДНК у промотора (хеликазная активность); фосфорилирует Pol II (в CTD); собирает белки эксцизионной репарации |
Элонгацияa ELLб |
1 |
80 000 |
|
pTEFb |
2 |
43 000, 124 000 |
Фосфорилирует Pol II (в CTD) |
SII (TFIIS) |
1 |
38 000 |
|
Элонгин (SIII) |
3 |
15 000, 18 000, 110 000 |
а Функция всех факторов элонгации заключается в преодолении остановки или прекращения транскрипции комплексом Pol II-TFIIF.
б Сокращение от англ. eleven-nineteen lysine-rich leukemia. Ген ELL часто подвергается рекомбинации при остром миелоидном лейкозе.
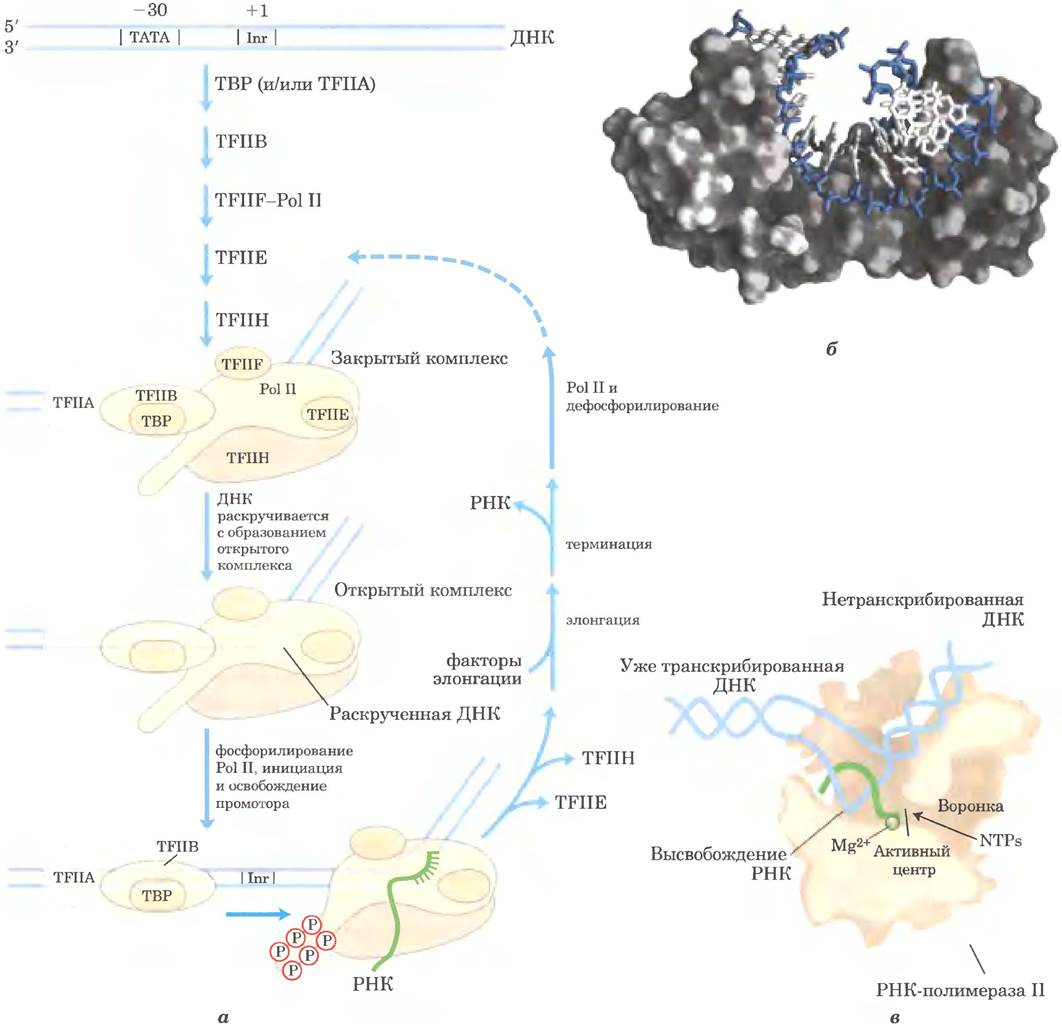
Для формирования активного транскрипционного комплекса РНК-полимераза II нуждается в ряде других белков, называемых факторами транскрипции. Основные факторы транскрипции для каждого промотора Pol II (обычно обозначаются TFII с дополнительной идентификацией) достаточно консервативны у всех эукариот (табл. 26-2). В процессе транскрипции под действием фермента Pol II можно выделить несколько стадий: сборка, инициация, элонгация, терминация; на каждой стадии участвуют определенные белки (рис. 26-10). Шаг за шагом описанный ниже процесс приводит к активной транскрипции in vitro. В клетке многие белки могут присутствовать в виде более крупных предварительно организованных комплексов, облегчая сборку комплексов на промоторах. Факторы, участвующие в трансляции, перечислены на рис. 26-10 и в табл. 26-2.
Рис. 26-10. Транскрипция с промоторов РНК-полимеразы II. а — последовательное присоединение ТВР (часто вместе с TFIIA), TFIIB, TFIIF, затем Pol II, TFIIE и TFIIH приводит к формированию закрытого комплекса. Внутри комплекса происходит раскручивание ДНК в области Inr за счет активности TFIIH и, возможно, TFIIE, что приводит к открытию комплекса. С-концевой домен самой крупной субъединицы Pol II фосфорилируется под действием TFIIH, затем полимераза оставляет промотор и начинает транскрипцию. Элонгация сопровождается высвобождением многих факторов транскрипции и усиливается факторами элонгации (см. табл. 26-2). После терминации Pol II высвобождается, дефосфорилируется и может участвовать в новом синтезе. б — ТВР человека (серый цвет) связан с ДНК (синий и голубой цвета) (PDB ID 1TGH). в — схема элонгации транскрипции, катализируемой корферментом полимеразы II.
Сборка РНК-полимеразы и факторов транскрипции на промоторе.
Образование закрытого комплекса начинается с взаимодействия ТАТА- связывающего белка (ТВР) с ТАТА-боксом (рис. 26-10, б). В свою очередь ТВР связывается с фактором транскрипции TFIIB, который тоже связывается с ДНК с обеих сторон от ТВР. Связывание TFIIA не всегда существенно, но может стабилизировать комплекс TFIIB-TBP на ДНК, что может иметь большое значение на неконсенсусных промоторах, где связывание ДНК с ТВР сравнительно слабое. Затем комплекс TFIIB-TBP соединяется с другим комплексом, состоящим из TFIIF и Pol II. Фактор TFIIF помогает точной стыковке Pol II с промотором, как путем взаимодействия с TFIIB, так и путем ослабления связывания полимеразы с неспецифическим участками ДНК. Наконец, присоединяются TFIIE и TFIIH, и образуется закрытый комплекс. Фактор TFIIH обладает ДНК-хеликазной активностью и начинает раскручивание ДНК вблизи точки начала транскрипции РНК (процесс нуждается в гидролизе АТР), создавая открытый комплекс. С учетом всех субъединиц разных факторов (не считая TFIIA), этот минимальный активный комплекс состоит из 30 или более полипептидов. Структурные исследования, выполненные Роджером Корнбергом и его сотрудниками, позволили более детально изучить строение корфермента РНК полимеразы II при элонгации (рис. 26-10, б).
Инициация цепи РНК и высвобождение промотора.
На стадии инициации TFIIH выполняет дополнительную функцию. Киназная активность одной из его субъединиц фосфорилирует последовательность CTD в Pol II во многих местах (рис. 26-10, а). Несколько других протеинкиназ, включая CDK9 (циклин-зависимая киназа 9), которая является частью комплекса pTEFb (от англ. positive transcription elongation factor b — положительный фактор транскрипции и элонгации b), также фосфорилируют CTD, особенно остатки серина. Это приводит к конформационным изменениям всего комплекса и инициирует транскрипцию. Фосфорилирование CTD также имеет большое значение для следующей стадии элонгации, причем степень фосфорилирования CTD изменяется по мере продвижения транскрипции. Эти изменения влияют на взаимодействия между транскрипционным комплексом и другими ферментами, так что при инициации транскрипции в комплексе связаны другие белки, нежели на более поздних стадиях. Некоторые из этих белков участвуют в процессинге транскрипта (как описано ниже).
По мере синтеза первых 60-70 нуклеотидов сначала из комплекса выходит TFIIE, потом TFIIH, и Pol II начинает стадию элонгации.
Элонгация, терминация и высвобождение.
На стадии элонгации TFIIF остается связанным с Pol II. На этой стадии активность полимеразы значительно усиливается белками, называемыми факторами элонгации (табл. 26-2). Факторы элонгации, некоторые из них связаны с фосфорилированным CTD, препятствуют остановке транскрипции, а также координируют взаимодействия между белковыми комплексами, вовлеченными в посттранскрипционный процессинг молекул мРНК. Как только синтез транскрипта РНК завершен, транскрипция прекращается. Полимераза II дефосфорилируется, после чего она готова инициировать транскрипцию другого участка (рис. 26-10, а).
Регуляция активности РНК-полимеразы II.
Регуляция транскрипции под действием Pol II достаточно сложна. Она включает взаимодействие широкого круга белков с прединициаторным комплексом. Некоторые из этих регуляторных белков взаимодействуют с факторами транскрипции, другие - с самой Pol II. Регуляция транскрипции более подробно рассматривается в гл. 28.
Различные функции TFIIH.
У эукариот репарация поврежденной ДНК (см. табл. 25-5) более эффективна в активно транскрибируемых генах, чем в других поврежденных участках ДНК, и матричная цепь репарируется эффективнее нематричной цепи. Эти удивительные наблюдения объясняются тем, что субъединицы TFIIH выполняют и другие функции. Фактор TFIIH не только принимает участие в формировании закрытого комплекса в ходе сборки транскрипционного комплекса (как описано выше), но некоторые из его субъединиц также выступают важными компонентами независимого эксцизионного репарационного комплекса (см. рис. 25-26).
Когда транскрипция под действием полимеразы II приостанавливается из-за повреждения ДНК, TFIIH может связаться с поврежденным участком и собрать вокруг себя целый экснизионный репарационный комплекс. У человека генетический дефект некоторых субъединиц TFIIH может привести к развитию заболеваний, например, к пигментной ксеродерме (см. доп. 25-1) и синдрому Коккейна, которые характеризуются прекращением роста, повышенной светочувствительностью и неврологическими расстройствами. ■
Возможно селективное ингибирование ДНК-зависимой РНК-полимеразы
Элонгация цепей РНК под действием РНК-полимеразы и у бактерий, и у эукариот ингибируется антибиотиком актиномицином D (рис. 26-11).
Рис. 26-11. Ингибиторы транскрипции ДНК актиномицин D и акридин, а — обведенная рамкой часть молекулы актиномицина D плоская и встраивается между двумя последовательно расположенными парами оснований G = C в дуплексной ДНК. Две циклические пептидные структуры актиномицина D связываются с малой бороздкой двойной спирали. Саркозин (Sar) — это N-метилглицин; meVal — метилвалин. Акридин также встраивается в ДНК. б — комплекс актиномицина D с ДНК (PDB ID 1DSC). Остов ДНК показан синим цветом, основания — серым, встроившаяся часть актиномицина (обведена рамкой на рис. а) — оранжевым цветом, оставшаяся часть актиномицина — красным. ДНК изогнута в результате связывания актиномицина.
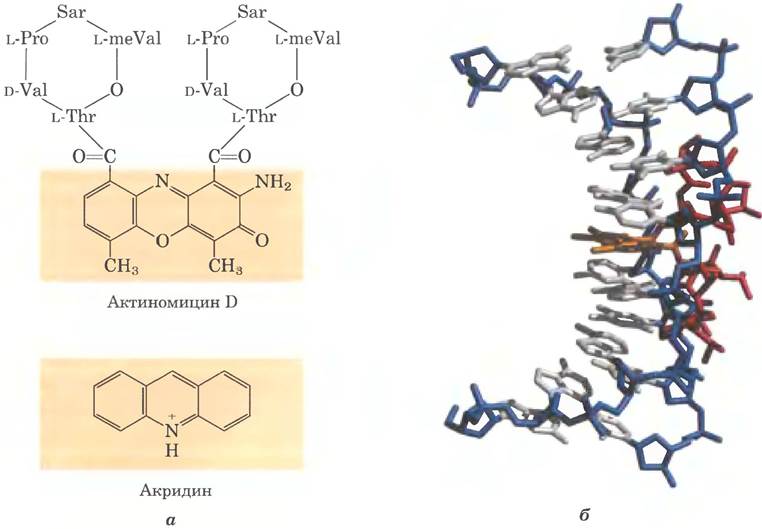
Плоская часть этой молекулы встраивается (интеркалирует) в двойную спираль ДНК между расположенными друг за другом парами оснований G = C, вызывая деформацию ДНК. Это препятствует движению полимеразы вдоль матрицы. Поскольку актиномицин D ингибирует элонгацию РНК в интактных клетках, а также в клеточных экстрактах, его используют для идентификации клеточных процессов, связанных с синтезом РНК. Акридин ингибирует синтез РНК сходным образом (рис. 26-11).
Рифампицин подавляет синтез бактериальной РНК, связываясь с β-субъединицей бактериальных РНК-полимераз, препятствуя высвобождению промотора при транкрипции (рис. 26-6). Иногда его используют в качестве антибиотика.
Бледная поганка (Amanita phalloides) обладает очень эффективным механизмом защиты от животных. Она синтезирует α-аманитин, который прерывает образование мРНК в клетках животных, блокируя Pol II, а в высоких концентрациях и Pol III. Ни Pol I, ни бактериальная РНК- полимераза нечувствительны к α-аманитину, но главное, к нему нечувствительна PHК-полимераза II самого гриба A. phalloides!
Краткое содержание раздела 26.1 ДНК-зависимый синтез РНК
■ Транскрипцию катализируют ДНК-зависимые РНК-полимеразы, которые используют рибонуклеозид-5'-трифосфаты для синтеза молекул РНК, комплементарных матричной цепи ДНК-дуплекса. Транскрипция осуществляется в несколько этапов: связывание РНК-полимеразы с промоторным участком ДНК, инициация синтеза транскрипта, элонгация и терминация.
■ Для распознавания промотора бактериальная РНК-полимераза нуждается в специальной субъединице. Связывание РНК-полимеразы с промотором и инициация транскрипции тесно взаимосвязаны и составляют первый этап транскрипции. Транскрипция прекращается на последовательностях ДНК, называемых терминаторами.
■ В эукариотических клетках есть три типа РНК-полимераз. Для связывания РНК-полимеразы II с ее промоторами необходимы белковые факторы транскрипции. Факторы элонгации участвуют в фазе элонгации. Длинный С-концевой домен самой крупной субъединицы Pol II фосфорилирован на стадиях инициации и элонгации.