ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 3. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ - 2017
ЧАСТЬ III. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ
26. МЕТАБОЛИЗМ РНК
26.3. РНК-зависимый синтез РНК и ДНК
До сих пор при обсуждении синтеза ДНК и РНК мы рассматривали в роли матрицы исключительно молекулы ДНК. Однако некоторые ферменты для синтеза нуклеиновых кислот используют матрицу РНК. За очень важным исключением, касающимся вирусов с геномом из РНК, эти ферменты играют в информационных путях лишь скромную роль. Именно РНК-содержащие вирусы являются источником большинства известных к настоящему времени РНК-зависимых полимераз.
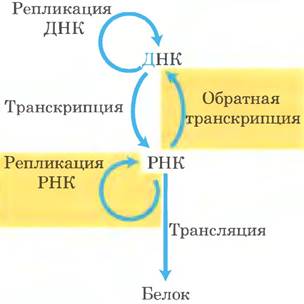
Существование репликации РНК требует пересмотра основной догмы молекулярной биологии (рис. 26-32; сравните с диаграммой на с. 5). Ферменты, участвующие в репликации РНК, помогают пролить свет на природу самореплицирующихся молекул, которые могли существовать в пребиотические времена.
Рис. 26-32. Расширение основной догмы молекулярной биологии с учетом РНК-зависимого синтеза РНК и ДНК.
Обратная транскриптаза синтезирует ДНК с матрицы вирусной РНК
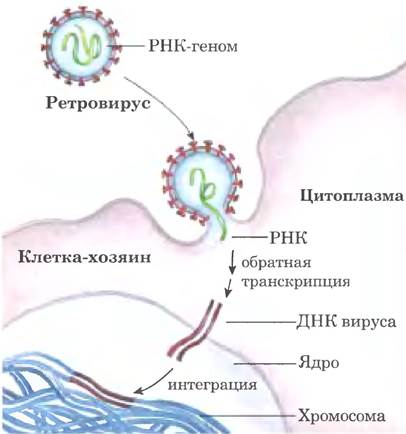
Некоторые РНК-содержащие вирусы, инфицирующие клетки животных, содержат в вирусных частицах РНК-зависимую ДНК-полимеразу, называемую обратной транскриптазой. При инфицировании фермент попадает в клетку хозяина вместе с одноцепочечным вирусным РНК-геномом (~10 000 нуклеотидов). Обратная транскриптаза сначала катализирует синтез цени ДНК, комплементарной вирусной РНК (рис. 26-33), затем разрушает цепь РНК в гибриде РНК-ДНК и заменяет ее на ДНК. Образовавшаяся двухцепочечная ДНК часто встраивается в геном клетки хозяина. Такие интегрированные (и молчащие) вирусные гены могут активироваться и транскрибироваться, а продукты этих генов - вирусные белки, а также сам PHК-геном вируса могут упаковываться в новые вирусные частицы. РНК-вирусы, содержащие обратные транскриптазы, называют ретровирусами (лат. приставка retro означает «обратно»).
Рис. 26-33. Ретровирусная инфекция в клетке млекопитающего и интеграция ретровируса в хромосому хозяина. Вирусные частицы, проникающие в клетку хозяина, несут вирусную обратную транскриптазу и клеточную тРНК (захваченную из предыдущей клетки-хозяина) уже в паре с вирусной РНК. Молекулы тРНК опосредуют немедленное превращение вирусной РНК в двухцепочечную ДНК при участии обратной транскриптазы, как описано в тексте. Двухцепочечная ДНК проникает в ядро и встраивается в геном хозяина. Интеграцию катализирует вирусная интег- раза. Механизм интеграции ДНК вируса в ДНК хозяина напоминает механизм встраивания транспозонов в бактериальные хромосомы (см. рис. 25-45). Например, на участке интеграции несколько пар оснований ДНК хозяина удваиваются, формируя короткие повторы из 4-6 п. н. с обеих сторон от вставки ретровирусной ДНК (не показано).
Существование обратных транскриптаз РНК- содержащих вирусов в 1962 г. предсказал Говард Темин, и в 1970 г. эти ферменты были обнаружены Теминым и независимо Дейвидом Балтимором. Открытие привлекло большое внимание, поскольку пошатнуло основную догму и показало, что генетическая информация может переходить «назад» от РНК к ДНК.

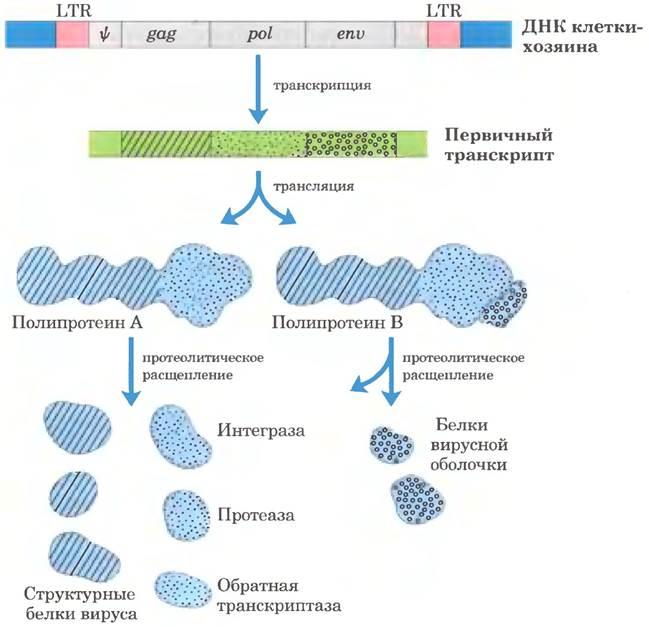
Ретровирусы обычно несут три гена: gag (от исторически сложившегося англ., названия group associated antigen — групповые ассоциированные антигены), pol и env (рис. 26-34). Транскрипт, содержащий gag и pol, транслируется в длинный «полипротеин» полипептид, который расщепляется на шесть белков с различными функциями. Белки, кодируемые геном gag, образуют сердцевину вирусной частицы. Ген pol кодирует протеазу, расщепляющую длинный полипептид, интегразу, которая встраивает вирусную ДНК в хромосому хозяина, и обратную транскриптазу. Многие обратные транскриптазы состоят из двух субъединиц α и β. Ген pol кодирует β-субъединицу (Мr = 90 000), а α-субъединица (Мr = 65 000) — это протеолитический фрагмент β-субъединицы. Ген еnv кодирует белки вирусной оболочки. На каждом конце линейного РНК-генома находятся длинные концевые повторы (LTR), состоящие из нескольких сотен нуклеотидов. Транскрибированные в двухцепочечную ДНК, эти последовательности облегчают интеграцию вирусной хромосомы в ДНК хозяина и содержат промоторы для экспрессии генов вируса.
Рис. 26-34. Структура и продукты интегрированного ретровирусного генома. Длинные концевые повторы (LTR) содержат последовательности, необходимые для регуляции и инициации транскрипции. Последовательность Ψ нужна для упаковки молекул ретровирусной РНК в зрелые вирусные частицы. Транскрипция ретровирусной ДНК приводит к образованию первичного транскрипта, включающего гены gag, pol и env. В результате трансляции (гл. 27) образуется длинный полипротеин — полипептид, кодируемый генами дад и pol, который расщепляется на шесть белков с различными функциями. После сплайсинга первичного транскрипта, синтезируемого на основе гена env, образуется мРНК, которая также транслируется в полипротеин, расщепляющийся затем с образованием белков вирусной оболочки.
Обратные транскриптазы катализируют три разные реакции: (1) РНК-зависимый синтез ДНК, (2) расщепление РНК и (3) ДНК-зависимый синтез ДНК. Подобно многим ДНК- и РНК-полимера- зам, обратные транскриптазы содержат Zn2+. Любая транскриптаза наиболее активна с РНК собственного вируса, но все они могут применяться в эксперименте для получения молекул ДНК, комплементарных разнообразным молекулам РНК. В синтезе ДНК и РНК и в расщеплении РНК задействованы разные активные центры белка. Для начала синтеза ДНК обратной транскриптазе нужен праймер, клеточная тРНК, захваченная у предыдущего хозяина и переносимая в составе вирусной частицы. 3'-Конец этой тРНК спарен с комплементарной последовательностью вирусной РНК. Новая цепь ДНК синтезируется в направлении 5' —> 3', как во
всех реакциях с участием РНК- и ДНК-полимераз. Обратные транскриптазы, как и РНК-полимеразы, не имеют корректирующей экзонуклеазной активности в направлении 3' —> 5'. Частота ошибок, допускаемых этими ферментами, составляет примерно 1 на 20 000 присоединенных нуклеотидов. Такая высокая частота ошибок совершенно необычна для репликации ДНК и, вероятно, свойственна большинству ферментов, реплицирующих геномы РНК-содержащих вирусов. Результатом является большая частота мутаций и высокий темп эволюции вирусов, что приводит к частому появлению новых болезнетворных штаммов ретровирусов.
Обратные транскриптазы стали важными инструментами в изучении взаимодействий между ДНК и РНК, а также в методах клонирования ДНК. Они позволяют синтезировать ДНК, комплементарную матрице мРНК; приготовленная таким способом синтетическая ДНК называется комплементарной ДНК (кДНК) и может использоваться для клонирования клеточных генов (см. рис. 9-14 в т. 1).
Некоторые ретровирусы вызывают рак и СПИД
■ Изучение ретровирусов позволило сильно продвинуться в понимании молекулярной природы рака. Большинство ретровирусов не убивают хозяйские клетки, а остаются встроенными в клеточную ДНК и реплицируются при делении клетки. Некоторые ретровирусы, относящиеся к РHК-содержащим опухолевым вирусам, содержат онкоген, который может вызвать неконтролируемый рост клеток. Первым изученным вирусом этого типа был вирус саркомы Рауса (другое название - вирус саркомы птиц; рис. 26-35), названный в честь Ф. Пейтона Рауса, который изучал опухоли кур, вызываемые этим вирусом. После открытия Харолдом Вармусом и Майклом Бишопом онкогенов в ретровирусах были обнаружены десятки таких генов.
Рис. 26-35. Геном вируса саркомы Рауса. Ген src кодирует тирозинкиназу, относящуюся к классу ферментов, влияющих на клеточное деление, межклеточные взаимодействия и передачу внутриклеточных сигналов (гл. 12 в т. 1). Этот же ген обнаружен в ДНК кур (обычный хозяин данного вируса) и в геномах многих эукариот, включая человека. Под воздействием вируса саркомы Рауса этот онкоген начинает активно экспрессироваться, способствуя неконтролируемому клеточному делению и возникновению рака.
![]()
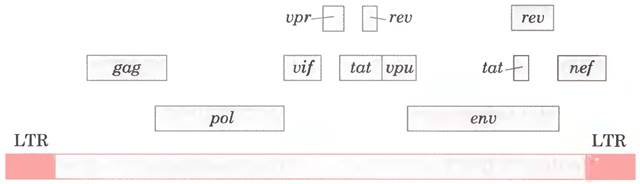
Вирус иммунодефицита человека (ВИЧ), вызывающий синдром приобретенного иммунного дефицита (СПИД), тоже относится к ретровирусам. Вирус иммунодефицита человека, идентифицированный в 1983 г., имеет PHК-геном со стандартным набором ретровирусных генов наряду с некоторыми необычными генам (рис. 26-36). В отличие от многих других ретровирусов ВИЧ чаще убивает инфицированные им клетки (главным образом Т-лимфоциты), чем вызывает формирование опухолей. Это постепенно приводит к подавлению иммунной системы хозяина. Обратная транскриптаза ВИЧ допускает еще больше ошибок, чем другие известные обратные транскриптазы, — в 10 или более раз, что приводит к высокой частоте мутаций вируса. При каждой репликации генома вируса ВИЧ обычно появляется одна или несколько ошибок, поэтому любые две молекулы РНК этого вируса могут различаться между собой.
Рис. 26-36. Геном ВИЧ. Помимо типичных генов ретровирусов ВИЧ содержит несколько небольших генов с различными функциями (не все они идентифицированы и здесь не рассматриваются). Некоторые из этих генов перекрываются (см. с. 175). В результате альтернативного сплайсинга из этого маленького генома (9,7 • 103 нуклеотидов) образуется много разных белков.
Многие современные вакцины, эффективные в отношении вирусных инфекций, состоят из одного или нескольких белков оболочки вируса: их получают способами, описанными в гл. 9 (в т. 1). Сами эти белки не вызывают заражения, но они стимулируют иммунную систему и помогают ей распознать вирус при возможной инфекции и справиться с ним (гл. 5 в т. 1). Из-за высокой частоты ошибок в реакции обратной транскриптазы ген еnv ВИЧ (и весь геном) очень быстро мутирует, что затрудняет создание эффективной вакцины. Однако для распространения ВИЧ-инфекции необходимы повторные циклы заражения клеток и репликация, поэтому самый эффективный современный способ лечения основан на ингибировании вирусных ферментов. ВИЧ-протеаза является мишенью для лекарственных препаратов, называемых ингибиторами протеазы (см. доп. 6-3 в т. 1). Обратная транскриптаза является мишенью для некоторых других лекарств, широко применяемых для лечения ВИЧ-инфицированных (см. доп. 26-2). ■
Дополнение 26-2. МЕДИЦИНА. Борьба со СПИДОМ с помощью ингибиторов обратной транскриптазы
Жизненный цикл и структура вируса иммунодефицита человека (ВИЧ) были установлены в результате изучения химии зависимого от матрицы биосинтеза нуклеиновых кислот современными методами молекулярной биологии. Через несколько лет после выделения ВИЧ эти исследования позволили создать лекарства, продлевающие жизнь людей, инфицированных этим вирусом.
Первый препарат, допущенный к клиническим испытаниям — азидотимидин (AZT) — структурный аналог дезокситимидина. Впервые AZT был синтезирован в 1964 г. Джеромом Хорвицем. В 1985 г. выяснилось, что это неудачное противоопухолевое средство (препарат был создан для борьбы с раком) может оказаться полезным для лечения больных СПИДом. Наиболее чувствительные к ВИЧ-инфекции клетки иммунной системы Т-лимфоциты захватывают AZT и преобразуют его в AZT-трифосфат. (Непосредственное введение AZT-трифосфата неэффективно, поскольку это соединение не может проходить через плазматическую мембрану.) Обратная транскриптаза ВИЧ обладает повышенным сродством к AZT- трифосфату по сравнению с dTTP. и связывание AZT- трифосфата с ферментом конкурентно ингибирует связывание dTTP. Когда к 3'-концу растущей цепи ДНК присоединяется AZT, отсутствие 3'-гидроксильной группы приводит к тому, что синтез вирусной ДНК прерывается.
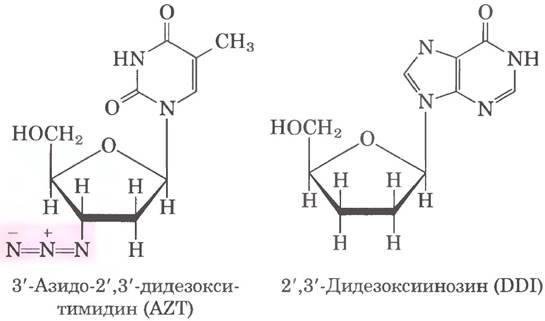
AZT-трифосфат нетоксичен для самих Т-лимфоцитов, поскольку клеточная ДНК-полимераза имеет пониженное сродство к этому соединению по сравнению с dTTP. В концентрации 1-5 мкмоль AZT воздействует на обратную транскрипцию ВИЧ, но не влияет на репликацию клеточной ДНК. К сожалению. AZT оказался токсичным для клеток костного мозга - предшественников эритроцитов, поэтому у многих пациентов, принимающих AZT, развивается анемия. Применение AZT может увеличить время жизни людей с хронической формой ВИЧ-инфекции примерно на год и заметно отодвигает проявления симптомов СПИДа у пациентов на ранней стадии инфицирования ВИЧ. Некоторые другие средства против ВИЧ-инфекции, например, дидезоксиинозин (DDI), имеют схожий механизм действия. Более современные лекарственные средства инактивируют ВИЧ-протеазу. Из-за высокой степени ошибок обратной транскриптазы и связанной с этим быстрой эволюцией вируса большинство эффективных способов лечения основано на комбинации лекарственных средств, подавляющих и протеазу, и обратную транскриптазу.
Многие транспозоны, ретровирусы и интроны могут иметь общее эволюционное происхождение
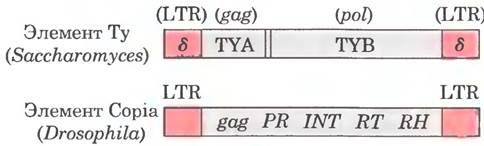
Структура некоторые хорошо изученных транспозонов из столь разных источников, как дрожжи и дрозофила, очень напоминает структуру ретро- вирусов; иногда их называют ретротранспозонами (рис. 26-37). Ретротранспозоны кодируют фермент, гомологичный ретровирусной обратной транскриптазе, и их кодирующие области фланкированы последовательностями LTR. Они переносятся внутри клеточного генома из одного положения в другое с помощью РНК-посредника, используя обратную транскриптазу для создания ДНК-копии РНК с последующей интеграцией ДНК в новый сайт. Большинство транспозонов эукариот для транспозиции использует этот механизм, что отличает их от транспозонов бактерий. которые перемещаются непосредственно в виде фрагментов ДНК из одного участка хромосомы в другой (см. рис. 25-45).
Рис. 26-37. Транспозоны эукариот. Ту-элемент дрожжей Saccharomyces и copia-элемент плодовой мухи Drosophila — примеры транспозонов эукариот со структурой, напоминающей ретровирусы, но утратившие ген env. Последовательности δ элемента Ту — функциональный эквивалент ретровирусных последовательностей LTR. В copia-элементе последовательности INT и RT гомологичны участкам интегразы и обратной транскриптазы в составе гена pol.
Ретротранспозоны утратили ген еnvи не могут образовывать вирусные частицы. Поэтому их следует рассматривать как дефектные вирусы, оказавшиеся в клетке, как в ловушке. Сравнение ретровирусов с эукариотическими транспозонами показывает, что обратная транскриптаза - очень древний фермент, появившийся до возникновения многоклеточных организмов.
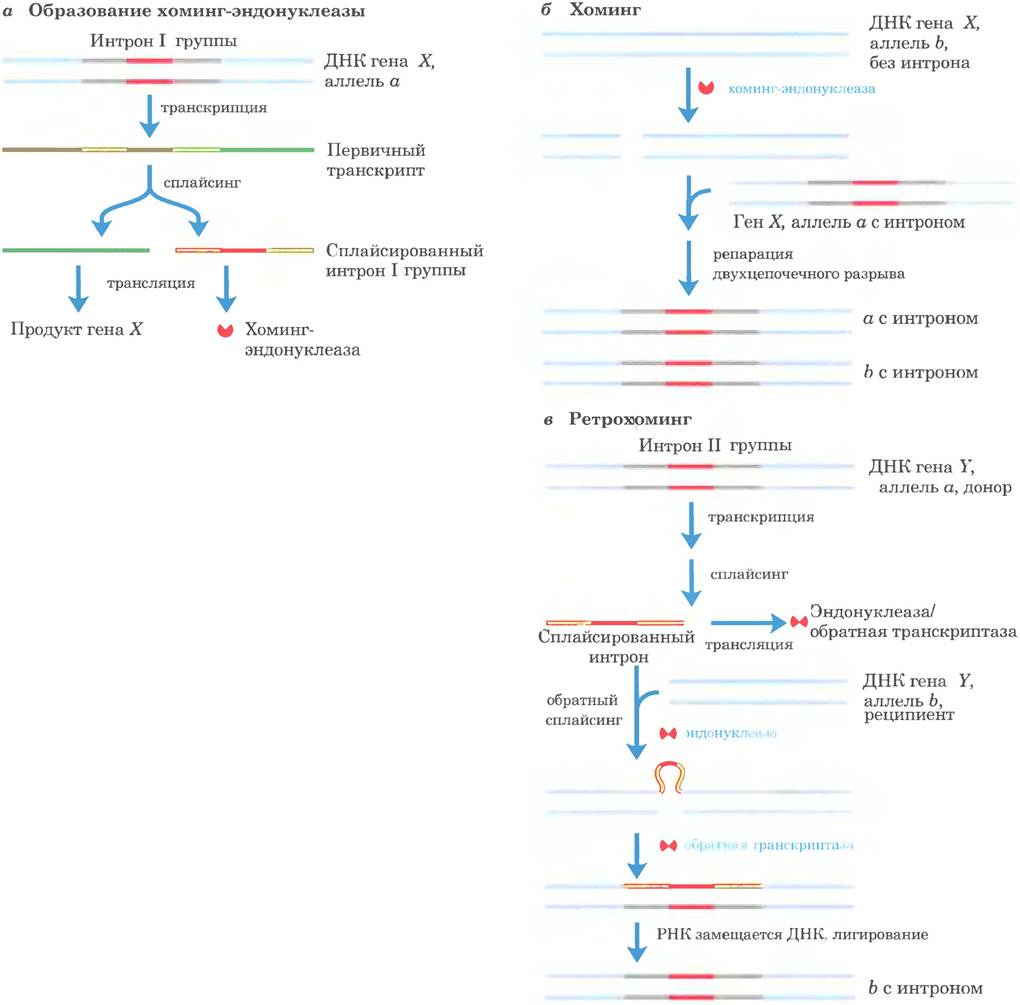
Интересно, что многие интроны групп I и II тоже являются подвижными генетическими элементами. Они не только способны осуществлять аутосплайсинг, но и кодируют эндонуклеазы ДНК, способствующие их перемещению. В процессе обмена генами между клетками одного вида или при внедрении в клетку ДНК под действием паразитов или иным способом эти эндонуклеазы способствуют встраиванию нитрона в идентичный участок в другой копии ДНК гомологичного гена, который не содержит этого интрона. Данный процесс называется хомингом (рис. 26-38). Хоминг нитронов группы I осуществляется на основе ДНК, тогда как хоминг нитронов группы II — через РНК-посредника. Эндонуклеазы нитронов группы II обладают также активностью обратной транскриптазы. Эти белки могут образовывать комплексы с РНК нитронов после того, как интроны вырезаны из первичных транскриптов. Поскольку процесс хоминга включает встраивание РНК интрона в ДНК и обратную транскрипцию интрона, перемещение этих нитронов называют ретрохомингом. В популяции каждая копия конкретного гена со временем может приобрести нитрон. Гораздо реже нитрон самостоятельно встраивается в новое место в неродственном гене. Если при этом хозяйская клетка не погибает, это может быть началом эволюционных изменений и привести к распространению интрона в новом месте. Структуры подвижных нитронов и механизмы их распространения подтверждают предположение, что по крайней мере некоторые из них возникли как молекулярные паразиты, чья эволюция восходит к ретровирусам и транспозонам.
Рис. 26-38. Подвижные интроны: хоминг и ретрохоминг. Некоторые интроны содержат ген (красный) фермента, который активирует хоминг (некоторые интроны I группы) или ретрохоминг (некоторые интроны II группы). а — ген внутри вырезаемого интрона связывается рибосомой и транслируется. Хоминг-интроны I группы кодируют сайт-специфическую эндонуклеазу, называемую хоминг-эндонуклеазой. Ретрохоминг-интроны II группы кодируют белок с активностью эндонуклеазы и обратной транскриптазы одновременно. б — хоминг. Аллель а гена X, содержащего хоминг-интрон I группы, присутствует в клетке, содержащей аллель b того же гена, но без интрона. Хоминг-эндонуклеаза, образованная а, расщепляет b в положении, соответствующем интрону в а, а затем в результате репарации двухцепочечного разрыва (рекомбинация с аллелем а; см. рис. 25-31, а) возникает новая копия интрона в b.в — ретрохоминг. Аллель а гена Y содержит ретрохоминг-интрон II группы; аллель b не имеет интрона. Вырезанный интрон встраивается в кодирующую цепь b в реакции, обратной реакции сплайсинга, когда интрон вырезается из первичного транскрипта (см. рис. 26-15); однако здесь происходит встраивание в ДНК, а не в РНК. Некодирующая цепь ДНК в аллеле Ь расщепляется закодированной в интроне эндонуклеазой/ обратной транскриптазой. Этот же фермент использует встроенную РНК в качестве матрицы для синтеза комплементарной цепи ДНК. Затем РНК разрушается клеточными рибонуклеазами и заменяется на ДНК.
Теломераза — специализированная обратная транскриптаза
Теломеры — структуры на концах линейных хромосом эукариот (см. рис. 24-9); обычно они состоят из многих тандемных повторов короткой олигонуклеотидной последовательности. Эта последовательность, как правило, имеет вид ТхСу в одной цепи и СyAx в комплементарной цепи, где значения x и y колеблются от 1 до 4 (с. 13). Теломеры различаются по длине от нескольких десятков пар оснований у некоторых ресничных простейших до десятков тысяч пар оснований у млекопитающих. Цепь ТС длиннее, чем комплементарная ей цепь, поэтому на 3'-конце имеется участок одноцепочечной ДНК длиной до нескольких сотен нуклеотидов.
Репликация концов линейной хромосомы клеточными ДПК-полимеразами — процесс достаточно сложный. Для репликации ДНК нужны матрица и праймер, а за пределами линейной молекулы ДНК нет матрицы для посадки РНК- праймера. Без специального механизма репликации концов хромосомы становились бы короче и короче с каждым клеточным делением. Фермент теломераза решает эту проблему, добавляя к концам хромосомы теломеры.
Существование такого фермента, возможно, не вызывает удивления, но механизм его действия весьма необычен. Теломераза, подобно некоторым другим ферментам, описанным в этой главе, состоит из РНК и белка. Длина РНК-компонента составляет примерно 150 нуклеотидов, и в нем содержится около 1,5 копий теломерного повтора СуАх. Эта область РНК действует как матрица для синтеза цепи ТxСу в теломере. Теломераза, таким образом, выступает в клетке в роли обратной транскриптазы, в активном центре которой происходит РНК-зависимый синтез ДНК. В отличие от обратной транскриптазы ретровирусов теломераза копирует только маленький участок РНК, который она содержит внутри самой себя. Для синтеза теломеры в качестве праймера используется 3'-конец хромосомы; синтез протекает в обычном направлении 5' —> 3'. Синтезировав одну копию повтора, фермент перемещается, чтобы продолжить удлинение теломеры (рис. 26-39, я).
Рис. 26-39. Цепь TG и Т-петля в теломерах. а — собственная РНК-матрица теломеразы связывается и образует пары оснований с TG-праймером ДНК. ①Теломераза присоединяет к TG-праймеру дополнительные остатки Т и G, затем ② перемещает собственную матрицу РНК, чтобы ③ продолжить присоединение оснований Т и G. Комплементарная цепь синтезируется клеточными ДНК-полимеразами (не показано). б — предполагаемая структура Т-петель в теломерах. Одноцепочечный «хвост», синтезированный теломеразой, загибается назад и спаривается с комплементарной последовательностью двухцепочечного участка. Теломера связывается с несколькими белками, включая TRF1 и TRF2 (от англ. telomere repeat binding factors — факторы связывания теломерных повторов), в — электронная микрофотография Т-петли на конце хромосомы, выделенной из гепатоцитов мыши. Длина черного отрезка внизу фотографии соответствует 5000 п. н.
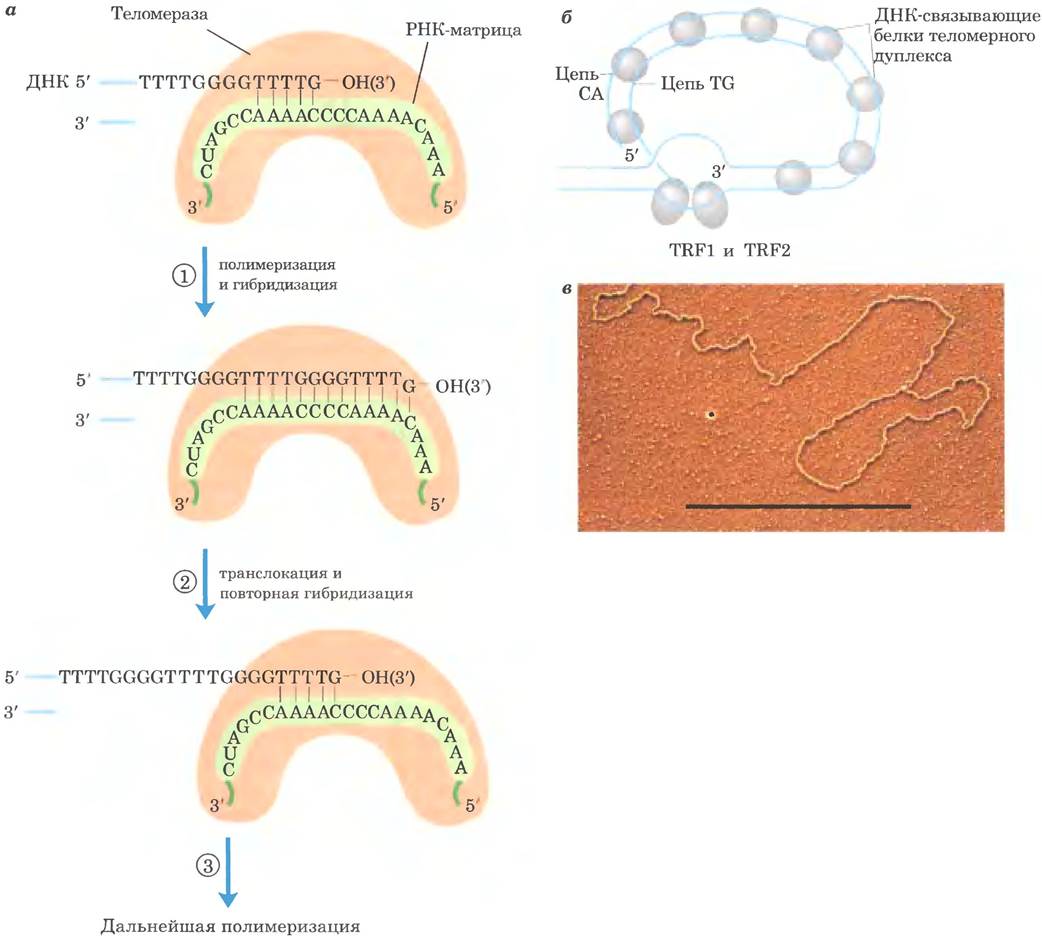
После продления теломеразой цепи ТxGy комплементарная ей цепь СуАх синтезируется клеточными ДНК-полимеразами, начиная с праймера РНК (см. рис. 25-13). У многих низших эукариот, особенно тех видов, теломеры которых содержат не больше нескольких сотен пар оснований, одноцепочечную область защищают специальные связывающие белки. У высших эукариот (включая млекопитающих) с теломерами длиной в несколько тысяч пар оснований одноцепочечный конец образует особую структуру, называемую Т-петлей (рис. 26-39, б). Одноцепочечный конец загибается назад и спаривается с комплементарным участком в двухцепочечной части теломеры. При образовании Т-петли 3'-конец одноцепочечной теломеры внедряется в ДНК-дуплекс, возможно, по механизму, аналогичному механизму инициации гомологичной генетической рекомбинации (см. рис. 25-33). У млекопитающих петля ДНК связана с двумя белками TRF1 и TRF2, причем последний белок участвует в формировании Т-петли. Т-петли защищают 3'-концы хромосом, делая их недоступными для нуклеаз и ферментов репарации двухцепочечных разрывов.
У простейших (таких как Tetrahymena) потеря теломеразной активности приводит к постепенному укорачиванию теломер при каждом клеточном делении и неизбежно заканчивается гибелью клеточной линии. Похожая связь между длиной теломер и старением клеток (прекращением клеточного деления) наблюдается и у человека. В линиях зародышевых клеток, обладающих теломеразной активностью, теломеры имеют постоянную длину; в соматических клетках, утративших теломеразу, теломеры укорачиваются. Существует обратная линейная зависимость между длиной теломер в культивируемых фибробластах и возрастом людей, у которых эти фибробласты были взяты: чем старше человек, тем короче теломеры в его соматических клетках. Если в условиях in vitro в соматические клетки человека ввести теломеразную обратную транскриптазу, теломеразная активность восстанавливается, а продолжительность жизни клеток значительно увеличивается.
Является ли постепенное укорочение теломер ключом к пониманию процесса старения? Определяет ли длина теломер при рождении продолжительность нашей жизни? Дальнейшие исследования в этой области могут привести к удивительным открытиям.
Некоторые вирусные РНК реплицируются РНК-зависимой РНК-полимеразой
Некоторые бактериофаги Е. coli, включая f2, MS2, R17 и Qβ, а также некоторые вирусы эукариот (в том числе вирус гриппа и вирус Синдбис, вызывающий одну из форм энцефалита) имеют РНК- геномы. Хромосомы этих вирусов представляют собой одноцепочечные молекулы РНК и функционируют также в качестве мРНК для синтеза вирусных белков; они реплицируются в клетках хозяина с помощью РНК -зависимой РНК -полимеразы (РНК-репликазы). Все РНК-содержащие вирусы, за исключением ретровирусов, должны кодировать белок с активностью РНК-зависимой РНК-полимеразы, поскольку клетки хозяина не образуют этот фермент.
РНК-репликаза большинства РНК-содержащих бактериофагов состоит из четырех субъединиц и имеет молекулярную массу около 210 000. Одна субъединица (Мr = 65 000) — продукт гена репликазы, содержащегося в вирусной РНК; она содержит активный центр для репликации. Другие три субъединицы — это белки хозяина, обычно участвующие в синтезе клеточных белков: факторы элонгации Е. coli Tu (Мr = 30 000) и Ts (Мr = 45 000) (которые доставляют молекулы аминоацил-тРНК к рибосомам) и белок S1 (часть рибосомной субъединицы 30S). Эти три белка, хозяина помогают РНК-репликазе связаться с 3'-концами молекул вирусных РНК.
РНК-репликаза из клеток Е. coli, инфицированных Qβ, катализирует образование РНК, комплементарной вирусной РНК, по реакции, аналогичной реакции ДНК-зависимых РНК-полимераз. Синтез новых цепей РНК происходит в направлении 5' —> 3'; механизм идентичен механизму всех других реакций синтеза нуклеиновых кислот на матрице. РНК-репликаза использует в качестве матрицы РНК и не работает с ДНК. Она не имеет независимой корректирующей эндонуклеазной активности и допускает примерно столько же ошибок, сколько и РНК-полимераза. В отличие от ДНК- и РНК-полимераз РНК-репликазы специфичны к РНК из собственного вируса и обычно не реплицируют РНК клетки-хозяина. Вот почему в хозяйских клетках, содержащих много других молекул РНК, предпочтительно реплицируются именно РНК-содержащие вирусы.
Синтез РНК открывает важный подход к изучению биохимической эволюции
Сложность строения и высокая организация — вот, что отличает живые организмы от неживых систем, и это же главное в проявлении жизненных процессов. Поддержание жизни требует, чтобы определенные химические превращения происходили очень быстро — особенно те, которые используют внешние источники энергии для синтеза сложных и специализированных клеточных макромолекул. Жизнь зависит от мощных и избирательных катализаторов (ферментов) и от информационных систем, способных надежно сохранять копии этих ферментов и точно их воспроизводить для передачи из поколения в поколение. Хромосомы кодируют не модель клетки, а модели ферментов, которые создают и поддерживают клетку. Одновременная потребность в информации и в катализе — прямо-таки классическая головоломка на тему: что было сначала информация, для которой нужна специфическая структура, или ферменты, необходимые для поддержания и передачи информации?
Разгадка структурной и функциональной сложности РНК привела в 1960-х гг. Карла Вёзе, Френсиса Крика и Лесли Оргела к заключению, что макромолекулы могут быть и носителями информации, и катализаторами. Открытие каталитических молекул РНК перевело это утверждение из разряда догадок в разряд гипотез и послужило причиной широкого распространения теории о том, что «мир РНК» мог иметь большое значение для перехода от пребиотической химии к жизни (см. рис. 1-34 вт. 1). Предком всех живых существ на нашей планете, который мог воспроизводить себя через поколения от самого зарождения жизни до настоящего времени, могла быть самореплицирующаяся РНК или же другой полимер с эквивалентными химическими характеристиками.

Как такой самореплицирующийся полимер мог возникнуть? Как он мог сохраниться во внешней среде, в которой не было в изобилии предшественников для его синтеза? Как, начав с такого полимера, эволюция могла создать современный ДНК-белковый мир? Для ответа на такие сложные вопросы нужны очень тщательные эксперименты, которые, возможно, позволят понять, как на планете Земля зародилась и эволюционировала жизнь.
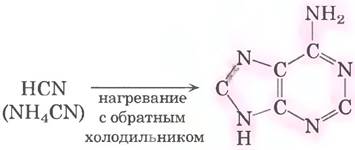
Предполагаемое происхождение пуриновых и пиримидиновых оснований подтверждается экспериментами, разработанными для проверки гипотез о химическом составе пребиотического мира (с. 55-56 в т. 1). Начиная с простых молекул, которые могли присутствовать в древней атмосфере нашей планеты (СН4, NН3, Н2O, Н2), под действием электрических разрядов (например, молнии) возникали более реакционноспособные молекулы, такие как НСN и альдегиды, а затем совокупность аминокислот и органических кислот (см. рис. 1-33 вт. 1). По-видимому, когда появилось много таких молекул, как НСN, начали синтезироваться пурины и пиримидины. Ведь уже через несколько суток в концентрированном растворе цианида аммония, нагреваемого в сосуде с обратным холодильником, образуется до 0,5% аденина (рис. 26-40). Аденин мог быть первым и преобладающим нуклеотидным компонентом, появившимся на Земле. Интересно, что большинство кофакторов ферментов содержат в своем составе аденозин, хотя он напрямую не участвует в их функционировании (см. рис. 8-38 вт. 1). Возможно, этот простой синтез аденина из цианида подтверждает глубокие эволюционные связи.
Рис. 26-40. Возможная реакция синтеза аденина из цианида аммония в пребиотической атмосфере. Аденин образуется из пяти молекул цианида (выделены розовым цветом).
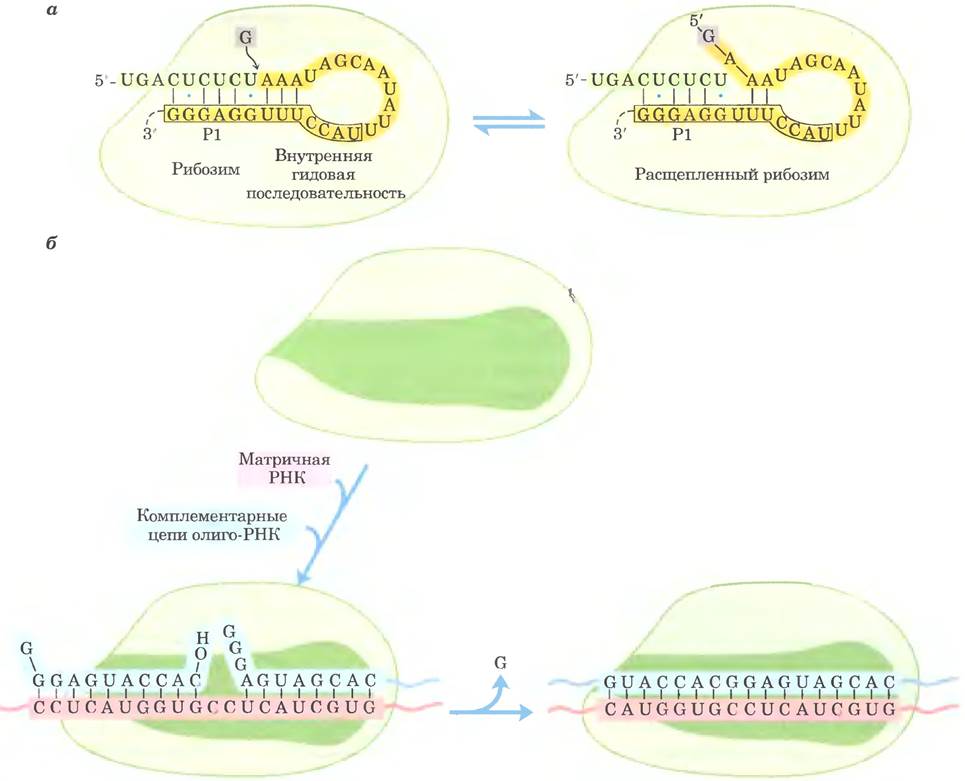
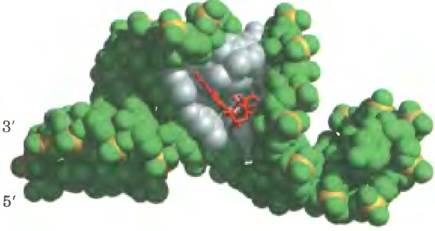
Гипотеза «мира РНК» предполагает, что нуклеотидный полимер способен сам себя воспроизводить. Может ли рибозим осуществлять свой собственный синтез на матрице? Аутосплайсирующийся интрон из рРНК Теtrahymena (рис. 26-30) катализирует обратимую атаку остатка гуанозина на фосфодиэфирную связь в 5'-сайте сплайсинга (рис. 26-41). Если 5'-сайт сплайсинга и внутренняя адаптерная последовательность удаляются из интрона, остаток интрона может связывать цепи РНК, спаренные с короткими олигонуклеотидами. Часть оставшегося интактного интрона аффективно действует в качестве матрицы для выравнивания и легирования коротких олигонуклеотидов. По сути, это реакция, обратная атаке гуанозина на 5'-сайт сплайсинга, но ее результат — синтез коротких РНК-последовательностей по матрице.
Рис. 26-41. РНК-зависимый синтез полимера РНК из олигонуклеотидных предшественников. а — на первой стадии удаления аутосплайсирующегося интрона группы I из предшественника рРНК у Tetrahymena происходит обратимая атака остатка гуанозина на 5'-сайт сплайсинга. Детально изображена только область Р1, включающая в себя внутреннюю адаптерную (гидовую или направляющую) последовательность (в рамке) и 5'-сайт сплайсинга; остальная часть рибозима изображена в виде серо-зеленой глобулы. Полная вторичная структура рибозима представлена на рис. 26-30. б — если область Р1 удаляется (что показано в виде темно-зеленой полости), рибозим сохраняет как свою трехмерную структуру, так и каталитическую способность. Новая молекула РНК, внесенная in vitro, может связываться с рибозимом таким же образом, как внутренняя адаптерная последовательность Р1 на рис. а. Это обеспечивает матрицу для дальнейших реакций полимеризации РНК, в которых происходит спаривание внесенной РНК и комплементарных ей олигонуклеотидов. Рибозим может связывать эти олигонуклеотиды в реакции, обратной той, что показана на рис. а. На рис. б показана только одна такая реакция, но повторяющиеся акты связывания и катализа могут привести к РНК-зависимому синтезу длинных полимеров РНК.
Дополнение 26-3. ПРАКТИЧЕСКАЯ БИОХИМИЯ. Метод SELEX для получения РНК с заданными свойствами
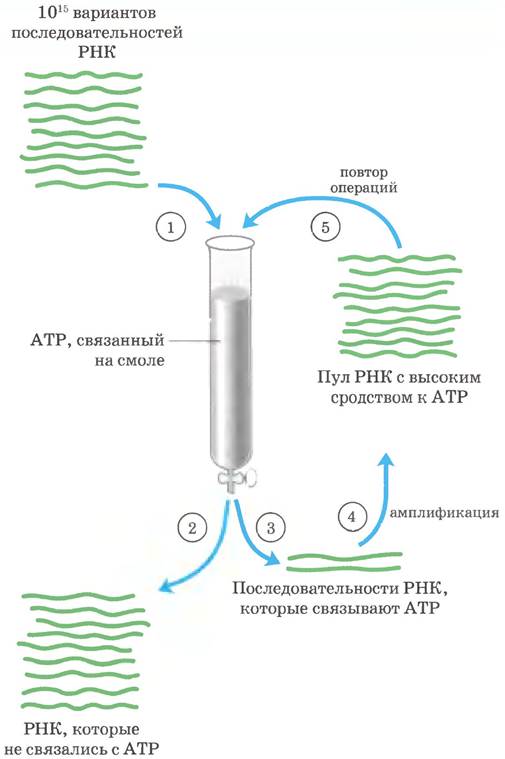
Метод SELEX (от англ. systematic evolution of ligands by exponential enrichment — систематическая эволюция лигандов путем экспоненциального обогащения) используется для отбора аптамеров - олигинуклеотидных последовательностей, которые прочно связываются со специфической молекулярной мишенью. С помощью этой технологии при работе в автоматическом режиме удается идентифицировать один или несколько аптамеров с желаемой специфичностью связывания.
На рис. 1 показано, как по технологии SELEX произвести отбор РНК-последовательностей, которые связываются с АТР. На стадии ① случайную смесь РНК-последовательностей подвергают «искусственному отбору», пропуская через смолу со связанным на ней АТР На практике работают со смесью, содержащей примерно 1015 разных последовательностей, что соответствует полному набору последовательностей из 25 нуклеотидов (425 ≈ 1015). В случае более длинных молекул РНК используемый пул РНК не всегда содержит все возможные РНК-последовательности. ② РНК, которые не связываются на колонке, отбрасывают; ③ молекулы, которые связываются с АТР, смывают с колонки солевым раствором и собирают. ④ Отобранные РНК амплифииируют с помощью обратной транскриптазы, получая большое количество комплементарных молекул ДНК, а затем с помощью РНК-полимеразы синтезируют РНК, комплементарные полученным молекулам ДНК. ⑤ Новый пул РНК подвергают той же процедуре отбора, и весь цикл операций повторяется 10 и более раз. В конце остается лишь несколько аптамеров (РНК-последовательности с выраженным сродством к АТР).
Рис. 1. Метод SELEX.
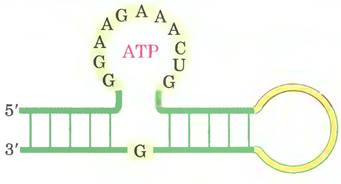
Структурные элементы, которые необходимы для связывания с АТР, показаны на рис 2. Такие молекулы связываются с АТР (и с другими аденозиновыми нуклеотидами). Кd <50 мкмоль. На рис. 3 приведена трехмерная структура комплекса аптамера из 36 нуклеотидов сАМР, полученного методом SELEX. Схема на рис. 2 как раз и соответствует этому антамеру РНК
Рис. 2. Схема строения аптамера РНК, обладающего сродством к АТР. Нуклеотиды, обозначенные буквами, необходимы для связывания РНК с АТР.
Помимо исследований функций РНК метод SELEX имеет важное практическое значение при идентификации коротких молекул РНК фармацевтического назначения. Разумеется, нельзя получить аптамеры, специфически связывающиеся со всеми потенциальными мишенями. Но эта технология быстрого отбора и амплификации специфических олигонуклеотидных последовательностей из очень сложного пула дает возможность получения новых эффективных терапевтических средств. Например, можно отобрать РНК, которые прочно связываются с рецептором белка, выступающего над поверхностью клеточных мембран, в частности над клетками опухолей. Блокируя активность рецептора или направляя в клетку опухоли токсин, который связывается с аптамером, можно уничтожить клетки опухоли. Метод SЕLЕХ был использован для отбора аптамеров ДНК при обнаружении спор сибирской язвы. Изучаются и другие интересные применения этой технологии. ■
Рис. 3. (Взято из РDВ ID 1RAW). Комплекс РНК-аптамера с АМР. В консервативных нуклеотидных последовательностях (формирующих полость, где и связывается АМР) основания показаны серым цветом, красный — связанный АМР.
Самореплецирующиеся макромолекулы быстро расходуют предшественников, которые в условиях пребиотической атмосферы поставлялись медленными процессами. Таким образом, для эффективного синтеза предшественников уже на ранних стадиях эволюции требовались метаболические пути, где катализаторами, возможно, были рибозимы. Известные сейчас рибозимы имеют ограниченные функции, и от тех «древних» рибозимов, существование которых можно только предполагать, сейчас не осталось и следа. Чтобы глубже исследовать гипотезу «мира РНК», мы должны понять, способна ли РНК катализировать реакции, которые происходили в примитивных метаболических путях.
Обнаружению молекул РНК с новыми каталитическими функциями помог метод быстрого скрининга, позволяющий находить и выделять в смеси олигонуклеотидов последовательности, которые обладают определенными активностями. Этот метод известен как SELEX-технология - ускоренная эволюция в пробирке (см. доп. 26-3). Метод использовали для получения молекул РНК, которые связываются с аминокислотами, органическими красителями, нуклеотидами, цианокобаламином и другими молекулами. Исследователи выделили рибозимы, катализирующие образование сложноэфирной и амидной связей, протекание SN2-реакций, а также металлирование порфиринов (введение в молекулы ионов металла) и образование углерод-углеродных связей. Благодаря эволюции кофакторов ферментов с нуклеотидной «ручкой», что облегчает связывание с рибозимом, спектр доступных для изучения химических процессов, протекание которых предполагается в примитивных системах, расширился.
Как мы увидим в следующей главе, синтез пептидных связей катализируют некоторые природные молекулы РНК; поэтому, по- видимому, вполне справедливо утверждение о том, что мир РНК изменился благодаря высокому каталитическому потенциалу белков. Синтез белков мог стать прорывом в эволюции мира РНК, но мог и ускорить его гибель. Роль носителя информации могла перейти от РНК к ДНК, поскольку ДНК химически более стабильна. РНК-репликаза и обратная транскриптаза, возможно, это сегодняшние версии ферментов, которые когда-то играли важную роль в осуществлении перехода к современной биосистеме, основанной на ДНК.
Молекулярные паразиты тоже могли прийти из мира РНК. С появлением первых неэффективных самореплицирующихся молекул транспозиция оказалась потенциально возможной альтернативой репликации в качестве стратегии для успешного воспроизводства и выживания. Древние молекулы паразитической РНК могли просто встроиться в самореплицирующуюся молекулу путем каталитической трансэтерификации, а затем пассивно подвергаться репликации. Естественный отбор мог привести к тому, что транспозиция стала сайт-специфической и затрагивала последовательности, которые не влияли на каталитическую активность РНК хозяина. Репликаторы и РНК-транспозоны могли существовать в примитивной симбиотической взаимосвязи, причем одни способствовали эволюции других. Современные интроны, ретровирусы и транспозоны могут быть рудиментами этого «путешествия на чужом горбу» древних паразитических молекул РНК. И сейчас эти элементы продолжают влиять на эволюцию своих хозяев.
Дополнение 26-4. Расширяющийся мир РНК, или транскрипты с неизвестной функцией
В книге многократно приводились современные оценочные данные относительно количества генов в геноме человека и многих других организмов. Эти оценки предполагают, что ученые знают о существовании гена, если они его «видят» на основании современных представлений о ДНК, РНК и белках. Но насколько справедлив такой подход?
Как отмечалось в гл. 9, по-видимому, менее 2% генома человека кодирует белки. Даже с учетом интронов получается, что лишь небольшая часть генома транскрибируется в РНК, главным образом мРНК, кодирующую эти белки. Остальную часть генома иногда называют мусорной ДНК. Однако определение «мусорная» указывает лишь на недостаточность наших знаний, поскольку в настоящее время мы постепенно начинаем понимать, что большая часть генома полностью функциональна.
В попытках точнее определить размеры человеческого транскриптома ученые изобрели новые инструменты, позволяющие с высокой точностью идентифицировать последовательности генома, которые транскрибируются в РНК. Результаты исследований оказались неожиданными. Выяснилось, что транскрибируется значительно большая часть нашего генома, чем считали ранее. Большая часть образующейся РНК, по-видимому, не кодирует белков. Многие виды РНК не имеют базовых структурных элементов (например, 3'-поли(А)-последовательности), характеризующих мРНК. Зачем же нужна эта РНК?
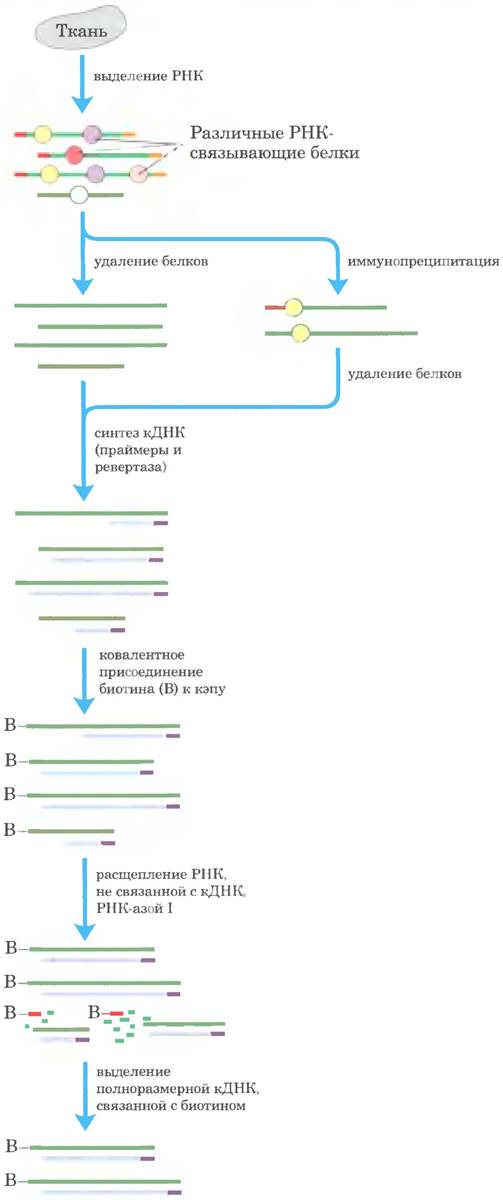
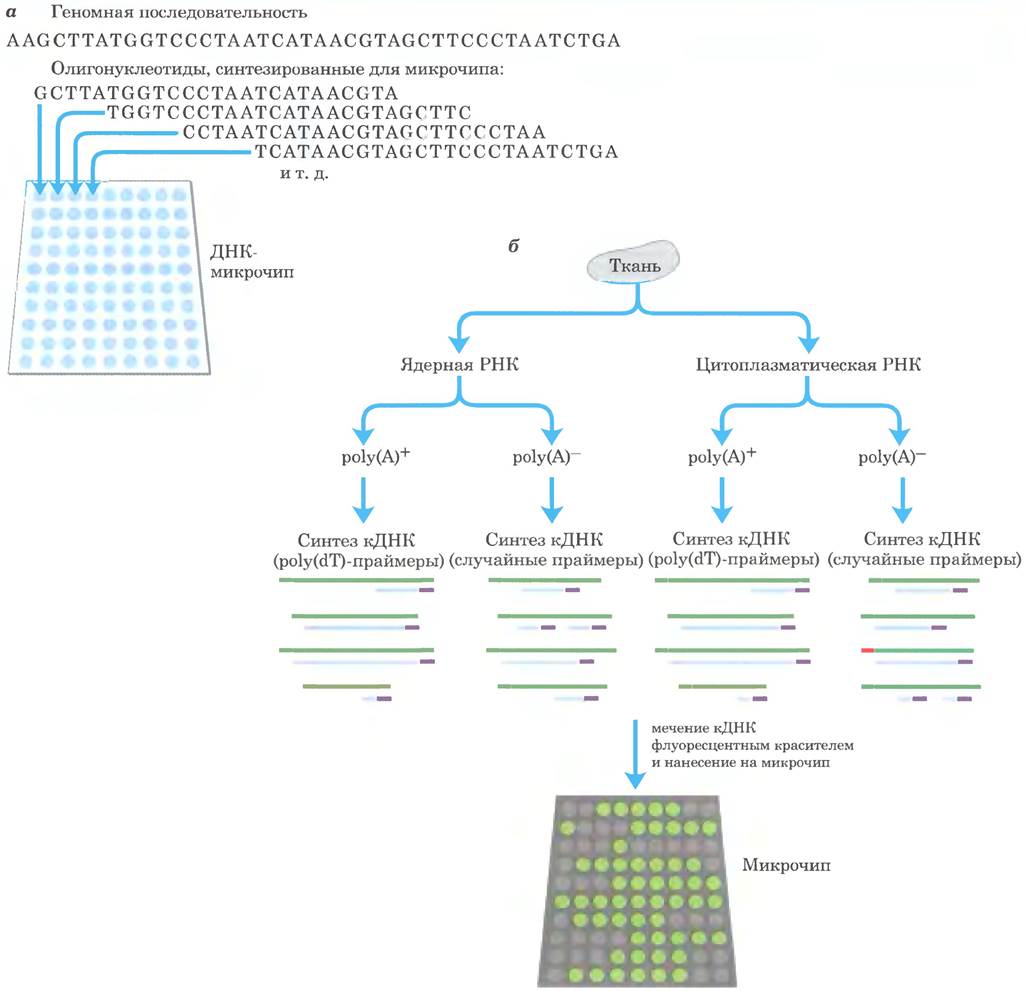
Большую часть методов, применяемых для решения таких задач, можно отнести к одной из двух крупных категорий: клонирование кДНК и анализ на микрочипах. Создание библиотек кДНК для изучения транскрибируемых генов какого-либо эукариотического генома описано в гл. 9 (см. рис. 9-14 в т. 1). Однако классические методы получения кДНК часто приводят к клонированию только части последовательности определенного транскрипта. Поскольку обратная транскриптаза может останавливаться в участках с определенной вторичной структурой мРНК или просто диссоциировать, обычно полноразмерные ДНК составляют не более 20% клонов в библиотеке кДНК. Это затрудняет использование таких библиотек для построения карт участков начала транскрипции (TSS — от англ. transcription start sites) и для изучения тех частей генов, которые кодируют N-концевые последовательности белков. На рис. 1 проиллюстрирован один из многочисленных методов, разработанных для преодоления этих ограничений. Усовершенствованные методы позволяют создавать такие библиотеки кДНК, в которых полноразмерные клоны составляют более 95%. что значительно расширяет возможности получения информации о составе клеточной РНК Однако кДНК обычно создаются на основе транскриптов РНК, содержащих поли ( А)-последовательности. Применение методов анализа на микрочипах в сочетании с методами приготовления кДНК, не связанными с наличием поли(А)-последовательностей (рис. 2), показало, что значительная часть РНК в клетках эукариот не имеет характерных концевых структур.
Рис. 1. Стратегия клонирования полноразмерных кДНК. Из образца ткани изолируют пул мРНК. В некоторых случаях мРНК, связанную с определенным белком, можно получить путем иммунопреципитации этого белка с последующим выделением связанной мРНК. Например, биотин ковалентно связывается с 5'-концом молекул мРНК, используя особые свойства 5'-кэпа. Чтобы запустить обратную транскрипцию молекул мРНК, применяют праймер поли (dT). РНКаза I расщепляет РНК, не входящую в состав гибридов ДНК-РНК, таким образом, уничтожаются неполные пары кДНК-РНК. Полноразмерные гибриды кДНК-РНК выделяют с помощью стрептавидиновых шариков (которые связываются с биотином), превращают в двухцепочечные ДНК и клонируют.
Полная картина еще не ясна, однако уже можно сделать некоторые выводы. Если исключить повторяющиеся последовательности (например, транспозоны), составляющие до половины генома млекопитающих, не менее 40% (а, возможно, и подавляющая часть) оставшейся геномной ДНК транскрибируется в РНК. По-видимому, существует больше видов РНК без поли(А)-«хвоста», чем видов РНК, имеющих эту последовательность. Большая часть таких РНК не транспортируется в цитоплазму, а концентрируется исключительно в ядре. Многие участки генома транскрибируются с обеих цепей: один транскрипт комплементарен другому (такие последовательности называют антисмысловыми). Часто антисмысловые РНК бывают задействованы в регуляции тех РНК, с которыми они спариваются. Многие виды РНК образуются лишь в одной или нескольких тканях, причем при анализе новых тканей каждый раз выявляются новые транскрипты. Таким образом, на настоящий момент еще не описан полный транскриптом ни одного организма. Более того, часто новые виды РНК транскрибируются с таких последовательностей генома (как те, что проиллюстрированы на рис. 9-20), которые расположены одинаково у нескольких организмов (так называемая синтения — связь генов с определенными хромосомами). Такая эволюционная консервативность указывает на важную функцию этих РНК.
Среди новых видов РНК, о существовании которых стало известно лишь в последние 20 лет, можно назвать мякРНК, мяРНК и микроРНК. Были открыты новые TSS. Появляются новые классы молекул РНК. Обнаружены новые варианты альтернативного сплайсинга. И все эти открытия изменяют наши представления о генах. В геномах человека и мыши даже количество кодирующих белки транскриптов мРНК может оказаться гораздо больше, чем считалось до сих пор, и число идентифицированных генов белков тоже может возрасти. Однако функции большинства недавно обнаруженных транскриптов остаются неизвестными, их называют просто транскриптами с неизвестной функцией (TUF — от англ. transcripts of unknown function). Открытие целого мира этих новых РНК позволяет надеяться, что мы сможем лучше понять механизмы работы эукариотической клетки и, возможно, лучше представить себе мир РНК, существовавший в далеком прошлом.
Рис. 2. Анализ транскриптома на микрочипах, а — на основе неповторяющихся участков генома синтезированы геномные микрочипы. Соседние олигонуклеотиды на микрочипе перекрываются по своим последовательностям, так что любой из нуклеотидов (например, Т, выделенный синим цветом) может быть представлен многократно, б — образец ткани фракционировали для разделения ядер и цитоплазмы, и из каждой фракции выделяли РНК. Образцы РНК, содержащие поли(А)-«хвост», отделяли от образцов, не имеющих этой последовательности, пропуская РНК через колонку со связанным поли(dТ). РНК с поли(А)-«хвостом» превращали в кДНК (рис. 1). Используя случайные праймеры, РНК без поли(А)-«хвоста» также превращали в кДНК. Не все образующиеся фрагменты ДНК по длине соответствуют тем РНК, на основе которых они были получены, однако общий набор ДНК содержит большую часть последовательностей исходных РНК. Затем кДНК метили и использовали в качестве зондов в микрочипах. Флуоресцентные метки на микрочипе позволяют определить транскрибированные РНК-последовательности.
«Мир РНК» — все еще гипотеза, в которой многое требует объяснения, однако экспериментальные доказательства подтверждают растущий список ключевых положений этой теории. Последующие эксперименты расширят наше понимание мироустройства. Важные недостающие фрагменты этой мозаики будут получены в области фундаментальной химии, в исследованиях живых клеток, возможно, даже на других планетах. Тем временем мир РНК продолжает расширяться (доп. 26-4).
Краткое содержание раздела 26.3 РНК-зависимый синтез РНК и ДНК
■ РНК-зависимая ДНК-полимераза (обратная транскриптаза) была впервые обнаружена у ретровирусов, которые в процессе своего жизненного цикла должны превращать свой РНК-геном в двухцепочечную ДНК. Эти ферменты транскрибируют вирусную РНК в ДНК; данный процесс применяется для получения комплементарной ДНК.
■ Многие эукариотические транспозоны родственны ретровирусам, и их транспозиция проходит через стадию образования РНК.
■ Теломераза — фермент, который синтезирует теломерные концы линейных хромосом, — специализированная обратная транскриптаза, содержащая внутреннюю матрицу РНК.
■ РНК-зависимые РНК-полимеразы, такие как репликазы РНК бактериофагов, специфичны по отношению к вирусной РНК, которую используют в качестве матрицы.
■ Открытие молекул каталитической РНК и метаболических путей взаимного превращения РНК и ДНК позволило предположить, что важным этапом эволюции было появление РНК (или равнозначного полимера), способной катализировать собственную репликацию. Биохимический потенциал молекул РНК можно изучать методом SЕLЕХ, позволяющим быстро отбирать последовательности РНК со специфическим сродством или определенными каталитическими свойствами.