Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Окислительное фосфорилирование и транспортные системы митохондрий
Механизм окислительного фосфорилирования
Для объяснения механизма сопряжения окисления и фосфорилирования были выдвинуты две принципиальные гипотезы. Химическая гипотеза постулирует прямое химическое сопряжение на всех стадиях процесса, как при образовании АТР в процессе гликолиза. Предполагается, что существует интермедиат, богатый энергией (I — X), связывающий процессы окисления и фосфорилирования. Поскольку такое соединение до сих пор не было обнаружено, эта гипотеза в известной мере дискредитирована и в дальнейшем не будет рассматриваться (подробно об этом вопросе можно прочесть в обзоре: Harper, Rodwell and Mayes, 1979). Хемиосмотическая теория постулирует, что при окислении компонентов дыхательной цепи генерируются ионы водорода, которые выходят на наружную сторону сопрягающей митохондриальной мембраны. Возникающая в результате асимметричного распределения ионов водорода (протонов, Н+) разность электрохимических потенциалов используется для приведения в действие механизма образования АТР.
Были выдвинуты и другие гипотезы; согласно одной из них, энергия окисления запасается в форме изменения конформации молекул, а затем используется для генерирования богатых энергией фосфатных связей.
Хемиосмотическая теория
Согласно Митчеллу, первичным событием в окислительном фосфорилировании является транслокация протонов (Н+) на наружную сторону сопрягающей мембраны (внутренней митохондриальной мембраны), осуществляемая за счет процесса окисления в дыхательной цепи. При этом предполагается, что мембрана непроницаема для ионов вообще, особенно для протонов, которые накапливаются на наружной стороне мембраны, создавая по обе стороны мембраны разность электрохимических потенциалов (∆μн). Она складывается из химического потенциала (разность pH) и электрического потенциала. Разность электрохимических потенциалов обеспечивает действие локализованной в мембране АТР-синтазы (или обращение процесса, катализируемого локализованной в мембране АТР-гидролазой). которая в присутствии Рi + АDP синтезирует АТР (рис. 13.9). Таким образом, нет необходимости в высокоэнергетическом промежуточном соединении, общем для процессов окисления и фосфорилирования, как это постулирует химическая гипотеза.
Предполагается, что дыхательная цепь в мембране уложена в виде трех окислительно-восстановительных (о/в) петель, которые образованы комплексами I, III и IV соответственно. Идеализированная петля, состоящая из переносчиков водорода и переносчика электронов, показана на рис. 13.10. Возможная конфигурация дыхательной цепи, уложенной в три функциональные о/в петли, показана на рис. 13.11.
Согласно этой схеме, перенос каждой пары электронов от NADH на кислород сопровождается транслокацией 6 протонов с внутренней на наружную сторону митохондриальной мембраны. Сначала NADH отдает один протон и два электрона, которые вместе с еще одним протоном из матрикса митохондрии восстанавливают FMN в FMNH2. FMN является частью большого белкового комплекса, пронизывающего всю толщу мембраны, что позволяет ему высвободить два протона на наружной стороне мембраны, а затем возвратить два электрона на внутреннюю сторону при участии FeS-белков, которые при этом восстанавливаются. Каждый восстановленный FeS-комплекс отдает один электрон молекуле убихинона (Q), которая, принимая протоны с внутренней стороны мембраны, превращается в QH2, QH2, будучи липидрастворимой небольшой молекулой, легко перемещается к наружной стороне мембраны, где освобождает пару протонов, а два электрона передает следующему переносчику дыхательной цепи — цитохрому b. Этот переносчик (в виде комплекса цитохромов b566 и b562) также, как полагают, пронизывает митохондриальную мембрану; это позволяет ему передавать электроны другой молекуле убихинона, которая одновременно присоединяет еще два протона из матрикса. QH2 совершает еще один челночный рейс на наружную поверхность, где освобождаются два протона, а два электрона передаются двум молекулам цитохрома с. Недавно постулированный Q-цикл, в пользу которого получены убедительные данные (рис. 13.11), предполагает, что семихинон QH2 является Н-переносящим компонентом двух о/в петель. Далее электроны проходят оставшуюся часть цитохромной цепи по мембране до цитохрома а3, находящегося на внутренней стороне мембраны. Здесь два электрона соединяются с двумя протонами (Н+) из матрикса и атомом кислорода, образуя воду.
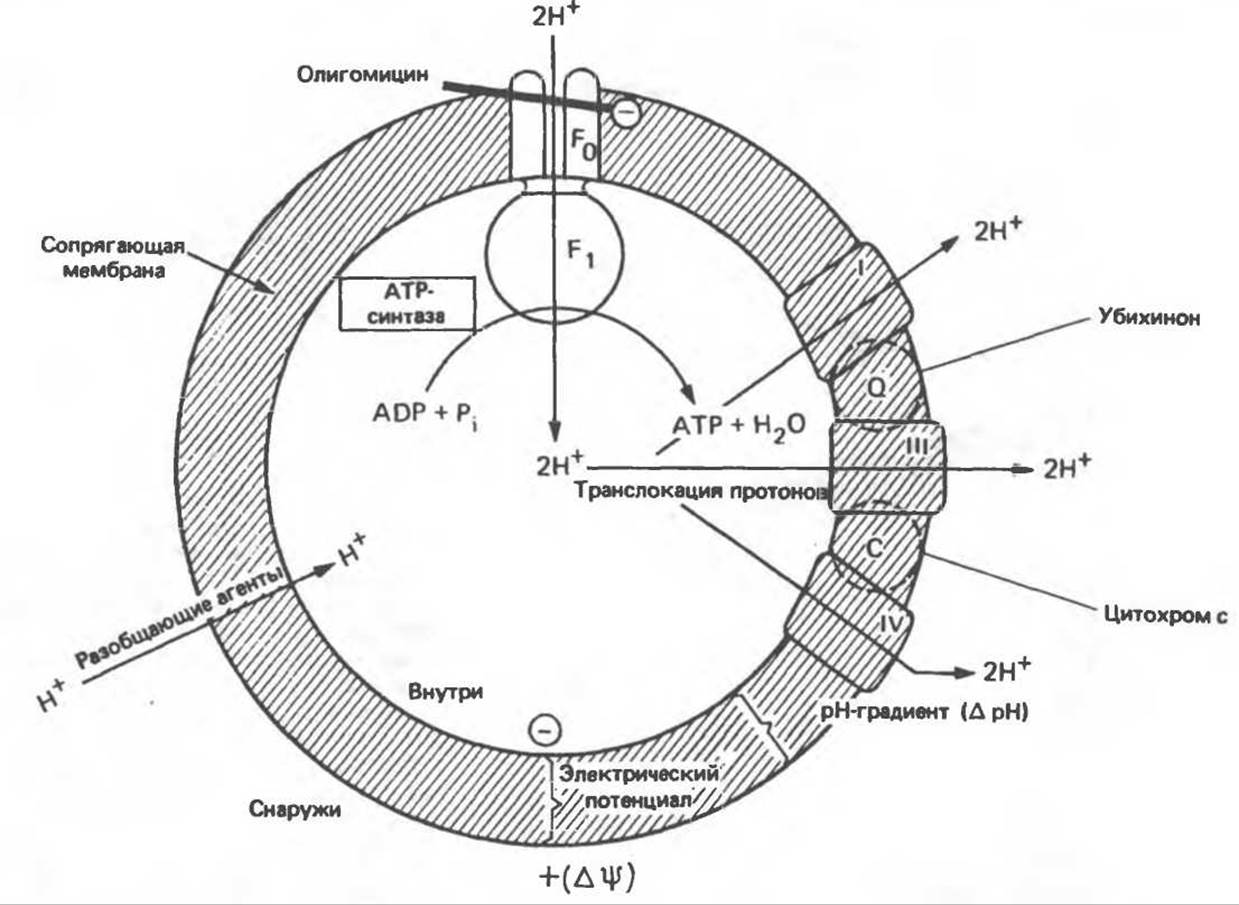
Рис. 13.9. Принципы, лежащие в основе хемиосмотической теории окислительного фосфорилирования, F1 и F0 — белковые субъединицы, ответственные за фосфорилирование. Основной поток протонов создается сопряжением окисления с транслокацией протонов, переносимых с внутренней на наружную сторону мембраны; эта транслокация осуществляется комплексами дыхательной цепи I, III и IV. каждый из которых действует как протонная помпа. Разобщители, например динитрофенол, вызывают утечку Н+ через мембрану, сильно снижая электрохимический протонный градиент. Олигомицин специфически блокирует поток протонов через F0.
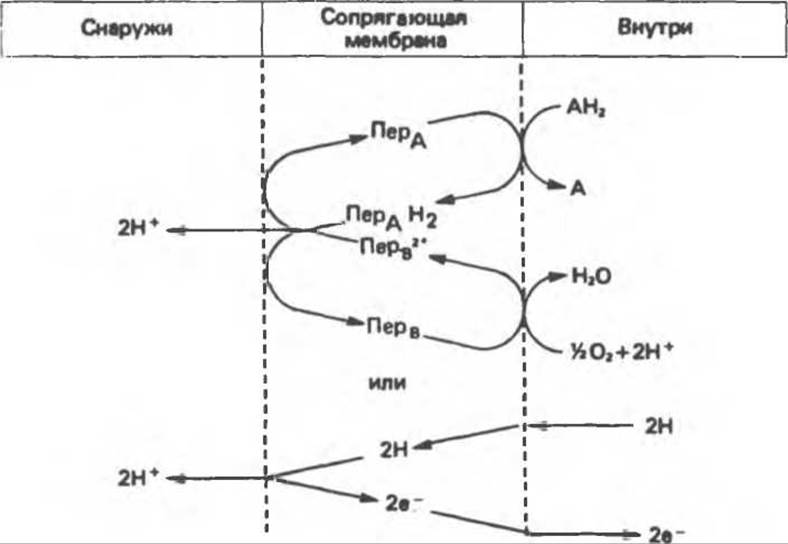
Рис.13.10. Окислительно-восстановительная (о/в) петля переноса протонов (хемиосмотическая теория); Пер — переносчик.
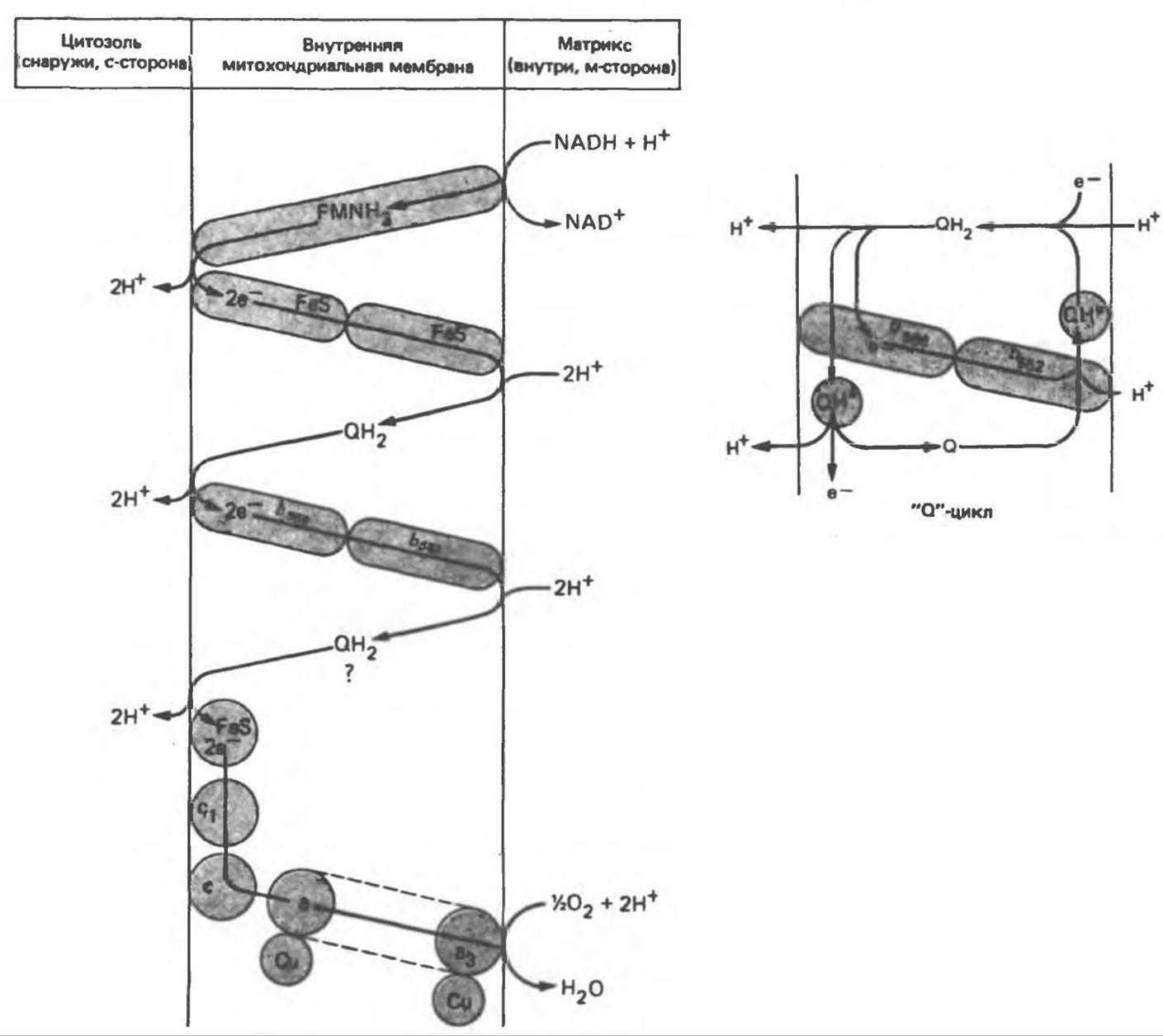
Рис. 13.11. Возможная конфигурация о/в петель в дыхательной цепи (хемиосмотическая теория). Схема в значительной мерe имеет предположительный характер; это особенно относится к области, где происходит взаимодействие Q с цитохромом b, поскольку природа интермедиатов и их относительное расположение точно не известны. Возможно, что в данном случае функционирует «Q-цикл», обеспечивающий транслокацию протонов, с участием семихинона (отмечен звездочкой), как указано на рисунке справа. На обеих сторонах мембраны семихинон фиксируется Q-связывающими белками, тогда как QH2 и Q являются мобильными. Цитохромы расположены в последовательности b, с1, с, а, а3 (последний является частью цитохрома аа3, пронизывающего мембрану). FeS — железо-серный белок. Недавно полученные данные свидетельствуют о том, что цитохром с-оксидоредуктаза работает как протонная помпа (см. рис. 13.9).
Внутренняя Мембрана содержит ряд белков — ферментов дыхательной цепи, уложенных в мембране по соседству друг с другом, как показано на рис. 13.11. При этом на поверхности внутренней мембраны находятся фосфорилирующие субъединицы, ответственные за образование АТР (рис. 13.12). Они состоят из нескольких белков, в совокупности образующих Е1-субъединицу; последняя выступает в матрикс и представляет собой ATP-синтазу (рис. 13.9). F1-субъединицы с помощью «стебелька» связаны с мембранной белковой субъединицей F0, пронизывающей, вероятно, всю мембрану (рис. 13.9). При прохождении через (F0—F1)-комплекс пары протонов из ADP и Рi образуется одна молекула АТР. Интересно, что сходные фосфорилирующие субъединицы находятся на внутренней стороне плазматической мембраны бактерий и на наружной стороне тилакоидной мембраны хлоропластов. Важно отметить, что в митохондриях и бактериях градиент протонов направлен снаружи внутрь, тогда как в хлоропластах он имеет противоположное направление.
Представления о механизме сопряжения транслокации протонов с синтезом АТР анизотропной (векторной) ATP-синтазной системой имеют в значительной мере предположительный характер. Модель, предложенная Митчеллом, показана на рис. 13.13. Пара протонов атакует один из атомов кислорода молекулы Pi, при этом образуются Н2O и активная форма Pi, которая сразу же соединяется с ADP, образуя АТР. Согласно данным представлениям, синтез АТР не является главной энергопотребляющей стадией; скорее такой стадией является освобождение АТР из активного центра, которое, вероятно, связано с конформационными изменениями субъединицы F1.
В пользу хемиосмотической теории говорят следующие экспериментальные данные:
1. Добавление протонов в среду, в которой находятся митохондрии, приводит к образованию АТР.
2. Окислительное фосфорилирование не происходит в растворимых системах, в которых не может функционировать векторная ATP-синтаза. Для протекания окислительного фосфорилирования необходима замкнутая мембранная система (рис. 13.9).
3. Компоненты дыхательной цепи уложены в мембране упорядоченно, «бок о бок», поперек мембраны, как предусматривается хемиосмотической теорией (рис. 13.11).
4. Коэффициент Р:Н+ для ATP-синтазы равен 1:2, а коэффициент Н+ : О для окисления сукцината и 3-гидроксибутирата 4 и 6 соответственно; это примерно согласуется с ожидаемыми соотношениями. Эти данные коррелируют с наличием трех о/в петель дыхательной цепи.
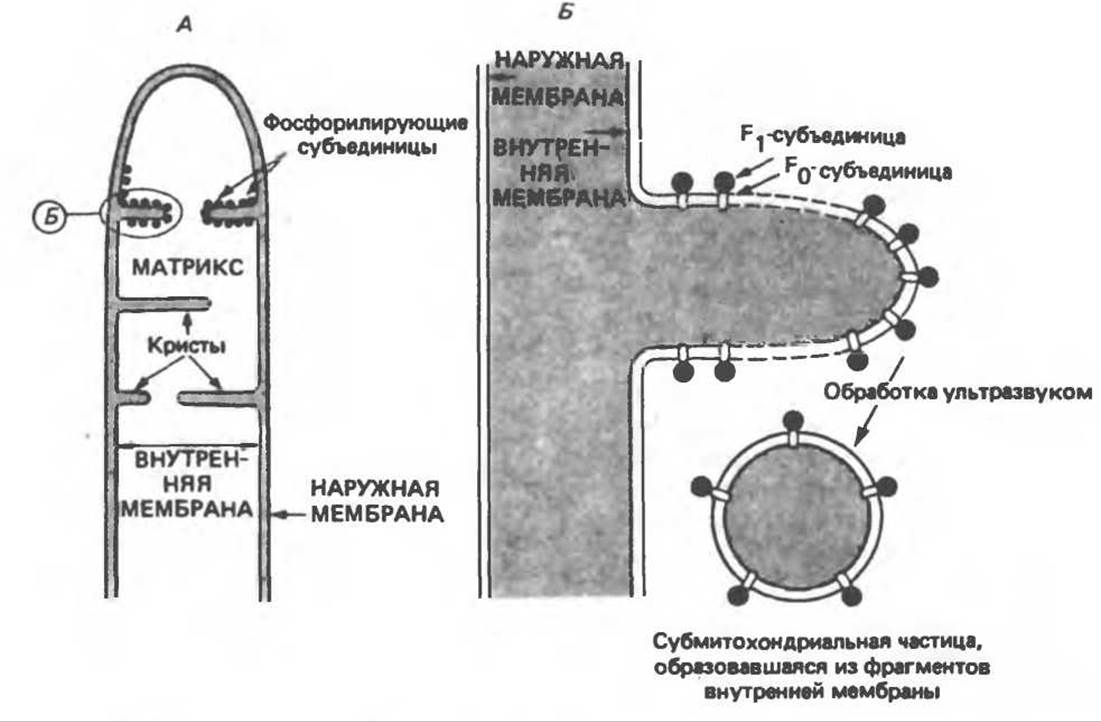
Рис. 13.12. Структура митохондриальных мембран. Субмитохондриальные частицы «вывернуты наружу» и позволяют изучать замкнутые мембранные системы, у которых фосфорилирующие субъединицы оказываются снаружи, а градиент протонов имеет «обратное» направление.
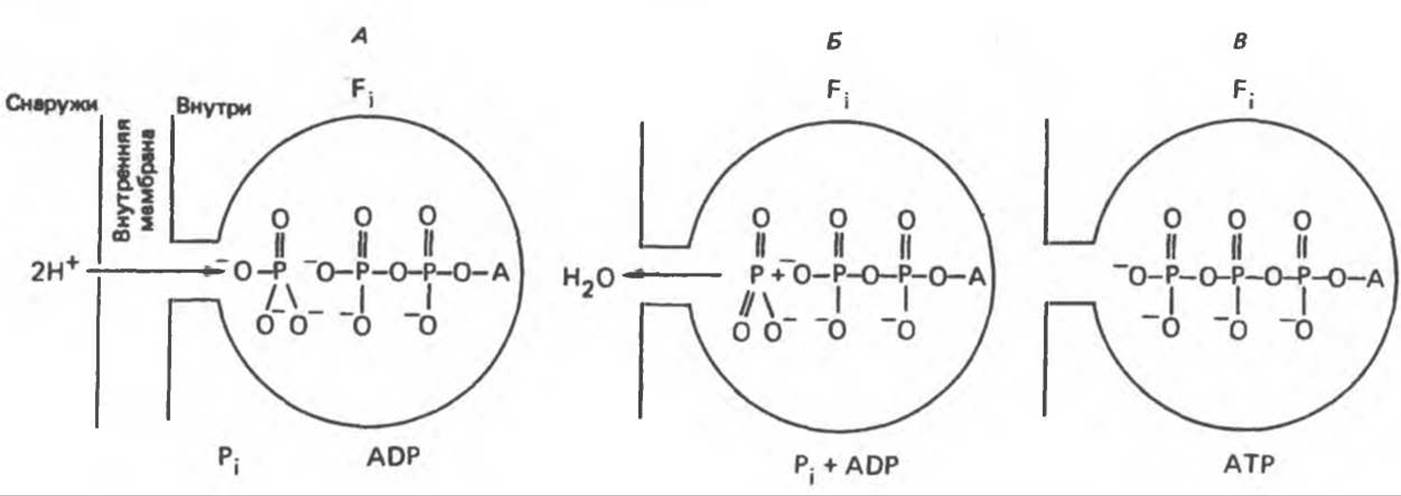
Рис. 13.13. Перенос протонов при участии ATP-синтазной системы (по Митчеллу).
Хемиосмотическая теория позволяет объяснить следующие феномены:
1. Феномен дыхательного контроля. Разность электрохимических потенциалов по обе стороны мембраны, возникающая вследствие транслокации протонов, ингибирует дальнейший транспорт восстановительных эквивалентов по дыхательной цепи до тех пор, пока не произойдет обратная транслокация протонов через мембранную векторную АТР-синтазу. Этот процесс в свою очередь зависит от наличия ADP и Рi.
2. Действие разобщителей. Эти соединения (например, динитрофенол) являются амфипатическими (см. с. 164) и повышают проницаемость мембраны для протонов (рис. 13.9), тем самым понижая электрохимический потенциал и выключая АТР-синтазу по типу короткого замыкания. В этом случае окисление может происходить без фосфорилирования.
3. Функционирование митохондриальных систем обменного транспорта (см. ниже). Этот феномен можно рассматривать как условие функционирования сопрягающей мембраны, которая должна быть непроницаема для протонов и других ионов для того, чтобы поддерживать электрохимический градиент. В мембране работают также системы диффузионного обмена анионов на ионы ОН и катионов на ионы Н+. Такие системы необходимы для ввода и вывода ионизированных метаболитов при сохранении электрической и осмотической нейтральности.