Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Регуляция метаболизма углеводов
Метаболический контроль ферментативных реакций
Гипотетический путь метаболизма, включающий стадии А, В, С, D, показан на рис. 22.1, на этом пути реакции А ↔ В и С ↔ D являются равновесными, а реакция В ↔ С — неравновесной. Скорость потока в таком метаболическом пути может регулироваться доступностью субстрата А. Это зависит от его поступления из крови, что в свою очередь зависит от количества пищи, поступившей в кишечник, или же от скоростей некоторых ключевых реакций, в результате которых основные субстраты высвобождаются и поступают в кровь, где их концентрация поддерживается на определенном уровне. Примерами могут служить пусковая реакция, катализируемая фосфорилазой печени, которая обеспечивает кровь глюкозой, а также реакция, катализируемая гормонзависимой липазой жировой ткани, поставляющая свободные жирные кислоты. Скорость процесса зависит также от способности субстрата А проникать через клеточные мембраны, от эффективности удаления конечного продукта D и от доступности косубстратов или кофакторов, обозначенных X и Y на рис. 22.1.
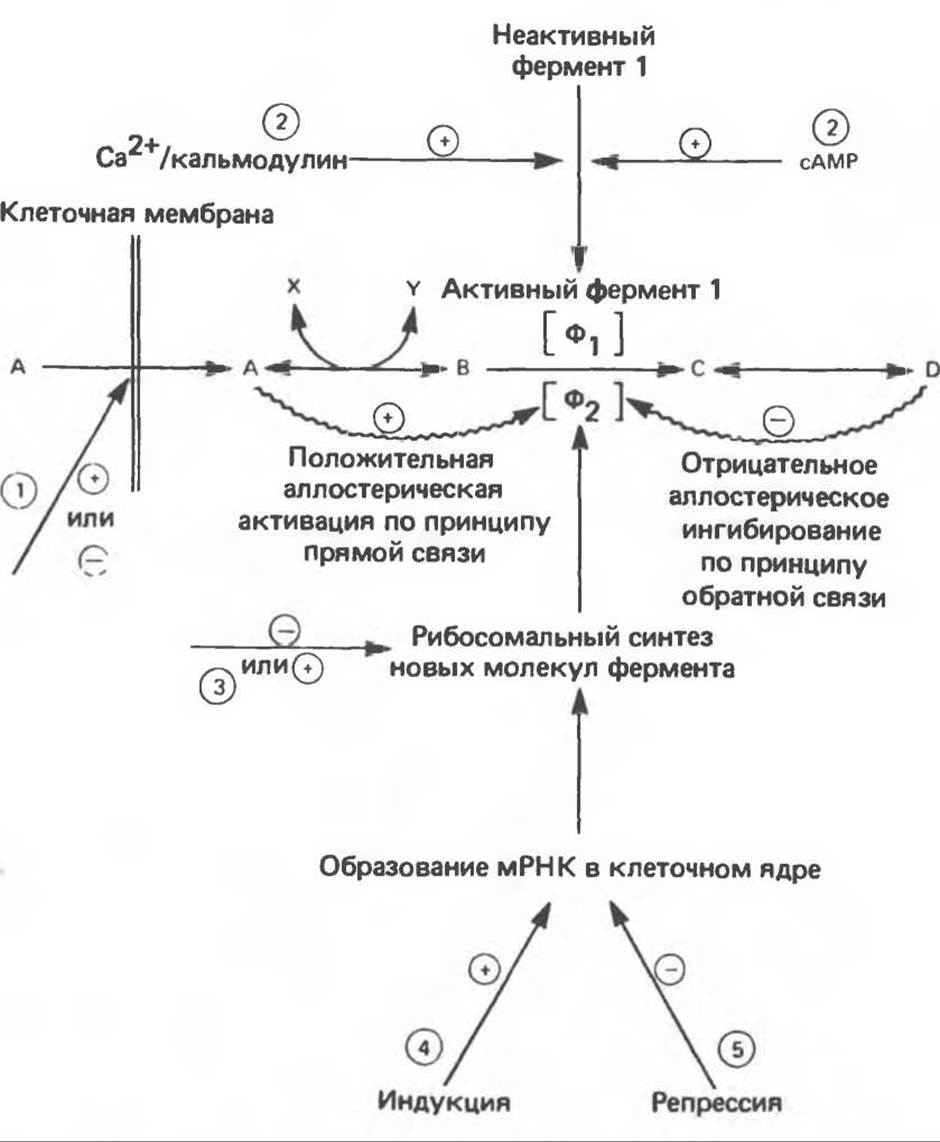
Рис. 22.1. Механизмы регуляции ферментативных реакций. Цифры, заключенные в кружки, указывают вероятные участки действия гормонов. 1 — изменение проницаемости мембраны; 2 — переход фермента из неактивной формы в активную; 3 — изменение скорости трансляции мРНК на рибосомальном уровне; 4 — индукция образования новой мРНК; 5 — репрессия образования мРНК.
Ферменты, катализирующие неравновесные реакции, чаще всего являются аллостерическими, и их регуляция быстро осуществляется по принципу «обратной связи» или «прямой связи» под действием аллостерических модуляторов в ответ на потребности клетки (см. гл. 9). Другие механизмы регуляции, связанные с действием гормонов, обеспечивают потребности организма в целом. Гормональная регуляция осуществляется с помощью нескольких механизмов (см. гл. 43), одним из которых является ковалентная модификация фермента путем фосфорилирования и дефосфорилирования. Этот процесс протекает быстро; одной из промежуточных стадий часто является образование сАМР, который в свою очередь стимулирует переход фермента из одной (например, неактивной) формы в другую. В процессе участвуют далее сАМР-зависимая протеинкиназа, которая катализирует фосфорилирование фермента, или специфические фосфатазы, катализирующие его дефосфорилирование. Активной формой может быть либо фосфорилированный фермент, как в случае ферментов, катализирующих пути катаболизма (например, фосфорилаза а), или дефосфорилированный фермент, как в случае ферментов, катализирующих процессы биосинтеза (например, гликогенсинтаза а).
Фосфорилирование некоторых регуляторных ферментов может осуществляться без участия сАМР и сАМР-зависимой протеинкиназы. Фосфорилирование этих ферментов зависит от таких метаболических сигналов, как изменение соотношения [ATP]/[ADP] (пример — пируватдегидрогеназа; рис. 22.3) или активность Са2+/кальмодулинзависимых протеинкиназ (пример — киназа фосфорилазы; рис. 19.5)
Синтез ферментов, контролирующих скорость метаболических путей, может изменяться под действием гормонов. Поскольку в этом случае происходит синтез новых белковых молекул, изменение активности происходит сравнительно медленно и чаще всего в ответ на изменение количества и состава поступающей пищи. Гормоны могут действовать как индукторы или репрессоры синтеза мРНК в ядре или как стимуляторы стадии трансляции белкового синтеза на уровне рибосом (гл. 41 и 43).