Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Транспорт и запасание липидов
Метаболизм липопротеинов плазмы крови - Катаболизм хиломикронов и липопротеинов очень низкой плотности
Меченые хиломикроны быстро исчезают из крови. У мелких животных (например, крыс) период полувыведения хиломикронов составляет всего нескольку минут; у крупных животных, а также у человека он больше, но не превышает 1 ч. Более крупные частицы катаболизируют быстрее, чем мелкие. При внутривенном введении хиломикронов, содержащих меченые по жирным кислотам триацилглицеролы, около 80% метки обнаруживается в жировой ткани, сердце и мышцах и примерно 20% в печени. Поскольку методом перфузии было показано, что лишь незначительные количества нативных хиломикронов и ЛПОНП подвергаются катаболическим превращениям в печени, то метка, обнаруживаемая в ней, должна иметь вторичное происхождение, т. е. она обусловлена метаболическими превращениями хиломикронов во внепеченочных тканях.
Роль липопротеинлипазы
Имеется выраженная корреляция между способностью ткани включать жирные кислоты триацилглицеролов, находящихся в составе липопротеинов, и активностью фермента липопротеинлипазы. Последний локализован на стенках капилляров, к которым он «прикрепляется» протеогликановыми цепями гепарансульфата. Этот фермент обнаружен в экстрактах из сердца, жировой ткани, селезенки, легких, мозгового слоя почек, аорты, диафрагмы и лактирующей молочной железы. Он практически отсутствует в крови, однако после инъекции гепарина гепарансульфатная связь перестает удерживать липопротеинлипазу и она поступает в кровяное русло, где катализирует гидролиз триацилглицеролов, находящихся в крови. При введении больших количеств гепарина из печени высвобождается другая липаза гeпapин-освобождаемая липаза печени). Этот фермент по своим свойствам отличается от липопротеинлипазы и менее эффективно атакует хиломикроны. Роль этого фермента до конца не ясна, но показано, что он участвует в метаболизме ЛПВП2 в печени (рис. 26.6) и в превращении остатков хиломикронов и ЛПОНП (см. ниже).
Как фосфолипиды, так и апобелок С-II являются кофакторами липопротеинлипазы. Апо-С-II имеет специфический участок связывания фосфолипидов, которым он присоединяется к липопрoтеину. Таким образом, хиломикроны и ЛПОНП обеспечивают фермент, катализирующий их метаболизм, как субстратом, так и кофакторами. Гидролиз триацилглицеролов происходит при контакте липопротеинов с ферментом, связанным с эндотелием. В процессе гидролиза триацилглицерол превращается сначала в диацилглицерол, а затем в моноацилглицерол, который расщепляется на свободную жирную кислоту и глицерол. Часть высвобождаемых жирных кислот поступает в кровоток, где они связываются сывороточным альбумином, а основная масса свободных жирных кислот транспортируется в ткани (рис. 24.6 и 24.5). Липопротеинлипаза сердца характеризуется низким значением Км по триацилглицеролу, а у липопротеинлипазы жировой ткани соответствующее значение Км на порядок выше. При переходе от сытого состояния к голодному концентрация триацилглицеролов в плазме крови уменьшается; при этом липопротеинлипаза сердца остается насыщенной субстратом, а насыщенность фермента жировой ткани снижается; это приводит к перераспределению потребления субстрата в пользу ткани сердца. Подобное перераспределение наблюдается также в период лактации, во время которого активность фермента в жировой ткани уменьшается, а активность фермента в молочной железе возрастает и за счет этого увеличивается потребление поставляемых липопротеинами длинноцепочечных жирных кислот, необходимых для биосинтеза молочного жира.
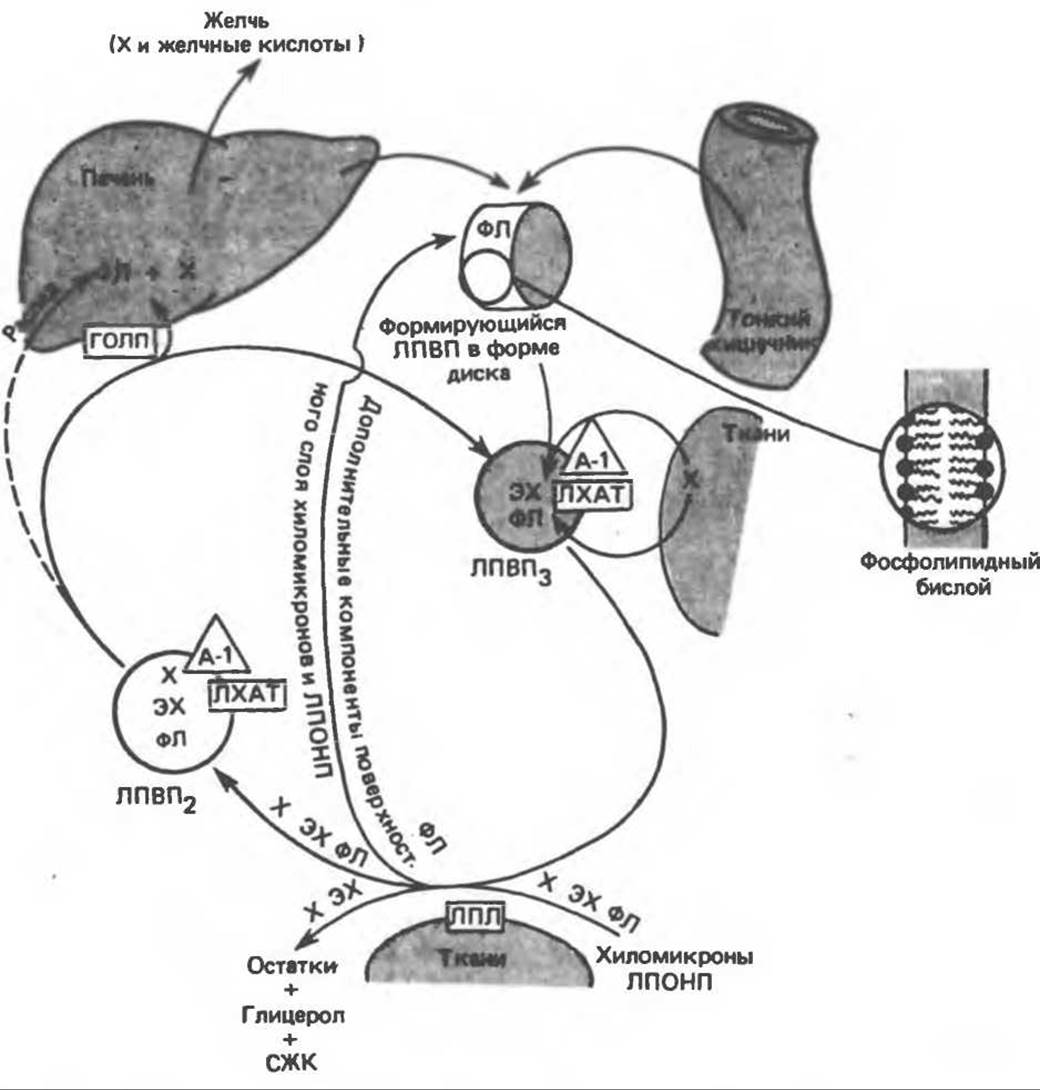
Рис. 26.6. Метаболизм липопротеинов высокой плотности (ЛПВП). ГОЛП — гепарин-осаждаемая липаза печени: ЛХАТ — лецитин: холестeролацилтрансфераза; ЛПЛ — липопротеинлипаза; X — холестерол: ХЭ — эфир холестерола; ФЛ — фосфолипид; СЖК — свободные жирные кислоты; А-I — апобелок А-I. На рисунке показана роль трех ферментов: ГОЛП, ЛХАТ и ЛПЛ в постулируемом цикле ЛПВП, в результате которого происходит перенос холестерола из различных тканей в печень. ЛПВП2 и ЛПВП3 — см. табл. 26.2. ГОЛП катализирует гидролиз фосфолипида на поверхности ЛПВП2, высвобождая холестерол который поступает в печень.
Образование «остатков» липопротеинов
Хиломикроны под действием липопротеинлипазы теряют около 90% триацилглицеролов, а также апобелок С, который возвращается на ЛПВП, при этом апобелок Е остается. Образующийся остаток хиломикрона имеет диаметр в два раза меньший, чем исходный хиломикрон; содержание в нем холестерола и его эфиров увеличивается (за счет убыли триацилглицеролов). Подобному превращению подвергаются ЛПОНП, в результате образуются остатки ЛПОНП, которые называют также липопротеинами средней плотности (ЛПСП).
Роль печени
Остатки хиломикронов поглощаются клетками печени, где происходит гидролиз эфиров холестерола и триацилглицеролов. Поглощение остатков осуществляется, по-видимому, с участием специфических рецепторов апобелка Е (рис. 26.4). Приблизительно 50% остатков ЛПОНП поступают в печень по этому пути, а остальные 50% превращаются в ЛПНП.
Эксперименты с ЛПОНП, меченными по апобелку В, показали, что ЛПОНП являются предшественниками ЛПСП, которые в свою очередь являются предшественниками ЛПНП. Как показали расчеты, каждый из этих липопротеинов содержит одну или две молекулы апобелка В-100, которые сохраняются в процессе превращений. Каждая частица ЛПНП образуется из одной частицы ЛПОНП (рис. 26.5). Роль печени в данном процессе выяснена не до конца. У крыс большая часть апобелка В из ЛПОНП обнаруживается в печени и только небольшая доля — в ЛПНП. Это, по-видимому, связано с тем, что ЛПОНП у крыс наряду с апобелком В-100 содержат также апобелок В-48. Если рецепторы апобелка Е на поверхности клеток печени более специфичны к апобелку В-48, чем к апобелку В-100, то можно объяснить, почему у крыс большая часть ЛПСП поглощается клетками печени и образование ЛПНП происходит в ограниченном размере.