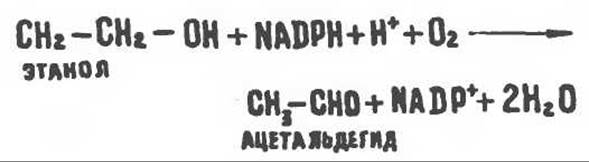Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Транспорт и запасание липидов
Метаболизм липопротеинов плазмы крови - Синтез триацилглицеролов и образование ЛПОНП (рис. 26.7)
Сравнительные исследования, проведенные на гепатэктомированных и контрольных животных, показали, что печень является основным источником липопротеинов плазмы крови, образующихся из эндогенных источников. Триацилглицеролы, образующиеся в печени, являются непосредственными предшественниками триацилглицеролов, входящих в состав ЛПОНП. Жирные кислоты, необходимые для биосинтеза этих триацилглицеролов, либо синтезируются в печени из ацетил-СоА, образующегося главным образом из углеводов, либо поступают в виде свободных жирных кислот из кровотока. При хорошем питании преобладает первый путь, в этом случае процесс биосинтеза жирных кислот протекает активно, а уровень свободных жирных кислот в крови низок. Поскольку в норме при этих условиях триацилглицеролы не накапливаются в печени, можно сделать вывод о том, что сразу же после образования они транспортируются из печени в составе ЛПОНП. С другой стороны, при голодании, при приеме пищи, богатой жирами, или при сахарном диабете уровень свободных жирных кислот в крови повышается и большее количество этих кислот поглощается печенью. В этих условиях липогенез ингибируется, и свободные жирные кислоты являются основным источником жирных кислот, входящих в состав триацилглицеролов печени и ЛПОНП. Реакции биосинтеза триацилглицеролов и фосфолипидов описаны выше (см. гл. 25). Образование триацилглицеролов и секреция ЛПОНП печенью увеличивается в следующих условиях: 1) при потреблении богатой углеводами пищи (в особенности пищи, содержащей большое количество сахарозы или фруктозы), 2) при высоком содержании свободных жирных кислот в крови, 3) при потреблении этанола и 4) при высоких концентрациях инсулина и низких концентрациях глюкагона.
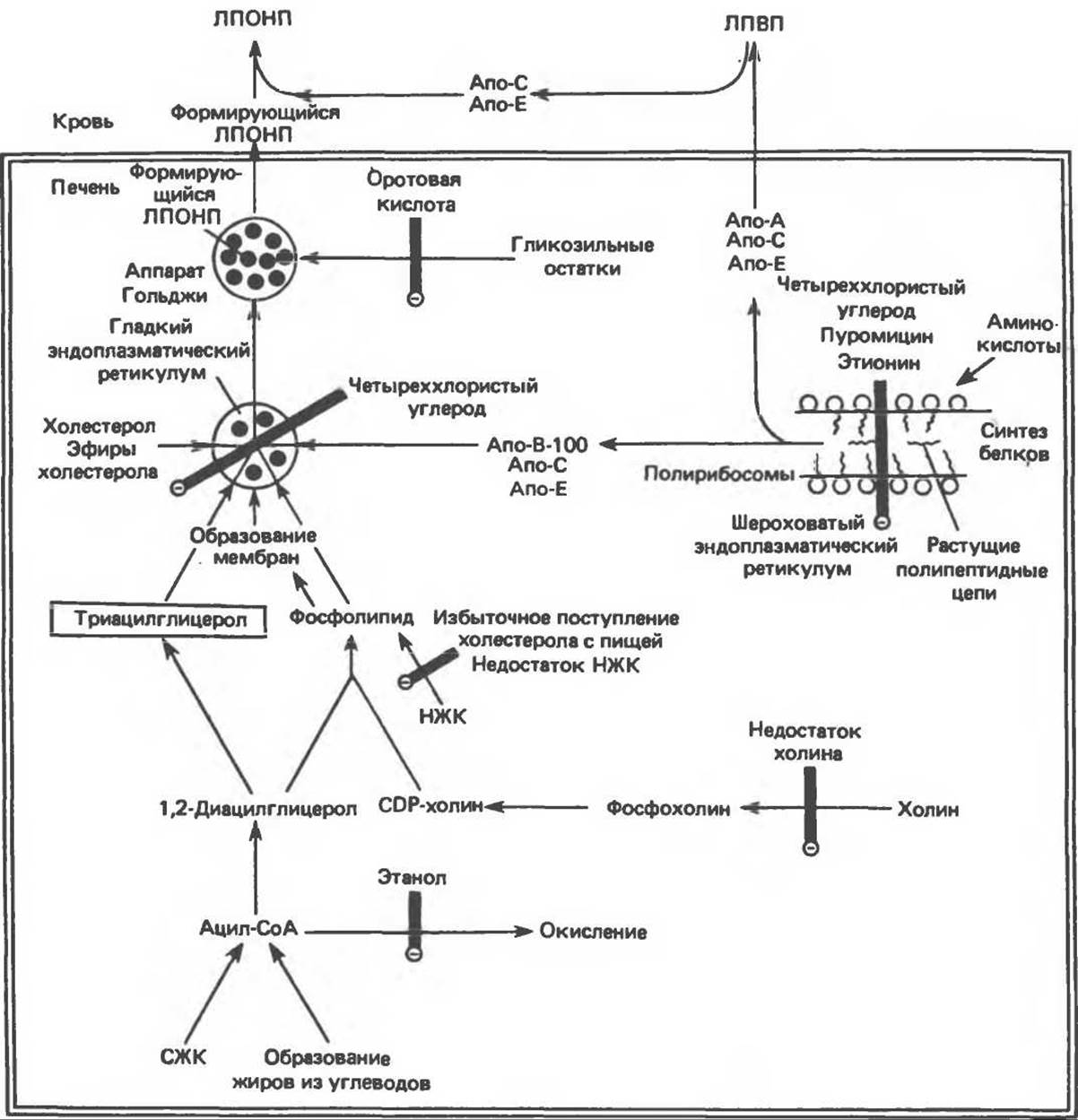
Рис. 26.7. Синтез липопротеинов очень низкой плотности (ЛПОПП) и возможные места действия факторов, вызывающих накопление триацилглицеролов в печени и ее жировое перерождение. ИЖК — незаменимые жирные кислоты: СЖК — свободные жирные кислоты: ЛПВП — липопротеины высокой плотности: Апо-А — апобелок А; Апо-В — апобелок В; Апо-С — апобелок С; Апо-Е — апобелок Е. Указанные пути лежат в основе процессов, схематично показанных на рис. 26.3. Б
Жировое перерождение печени (рис. 26.7)
По различным причинам липиды, главным образом триацилглицеролы, могут накапливаться в печени. Избыточное накопление жира рассматривается как патологическое состояние. Когда накопление жира в печени становится хроническим, в клетках печени происходят фиброзные изменения, приводящие к циррозу печени и нарушению ее функций.
Наблюдаются два основных типа жирового перерождения печени. 1. Жировое перерождение первого типа возникает в результате увеличения содержания свободных жирных кислот в плазме крови, обусловленного либо мобилизацией жиров из жировой ткани, либо гидролизом триацилглицеролов, входящих в состав липопротеинов или хиломикронов внепеченочной липопротеинлипазой. Возрастает поглощение и эстерификация свободных жирных кислот клетками печени. Образующегося в печени количества липопротеинов оказывается недостаточно для утилизации поступающих жирных кислот, и последние накапливаются в печени в виде триацилглицеролов, вызывая ее жировое перерождение. Содержание триацилглицеролов в печени значительно увеличивается при голодании и при длительном потреблении пищи, богатой жирами. Во многих случаях (например, при голодании) нарушается также способность печени секретировать ЛПОНП. При неконтролируемом сахарном диабете, токсикозе беременности у овец и кетозе у крупного рогатого скота жировая инфильтрация клеток печени может быть столь значительной, что печень увеличивается и имеет бледную окраску.
2. Жировое перерождение печени второго типа обычно обусловлено метаболическим блоком образования липопротеинов плазмы крови, в результате чего происходит накопление триацилглицеролов. Это нарушение может быть вызвано а) блокированием синтеза белковой части липопротеинов, б) блокированием образования липопротеинов из липидов и апобелков, в) недостаточным поступлением фосфолипидов, входящих в состав липопротеинов, г) нарушением собственно секреторного механизма.
Детально было изучено жировое перерождение печени у крыс, развивающееся при недостатке холина, который в связи с этим получил название липотропного фактора. Поскольку синтез холина происходит путем переноса подвижных метильных групп от метионина в процессе трансметилирования (см. гл. 31 и 32), причиной недостатка холина может стать нехватка подвижных метильных групп, переносимых от метионина. Предложено несколько механизмов, объясняющих действие холина в качестве липотропного фактора, в том числе снижение синтеза фосфолипидов, необходимых для образования липопротеинов.
Антибиотик пуромицин ингибирует синтез белков и вызывает жировое перерождение печени и значительное снижение концентрации ЛПОНП у крыс. Подобным же образом действуют и такие вещества, как этионин (а-амино-β-меркаптомасляная кислота), четыреххлористый углерод, хлороформ, фосфор, свинец и мышьяк. Холин не способен защитить организм от действия этих веществ, но, по-видимому, способствует выздоровлению. Весьма вероятно, что четыреххлористый углерод вызывает либо нарушение собственно механизма секреции липопротеинов, либо процесса взаимодействия липидов с апобелками при образовании липопротеинов. Действие четыреххлористого углерода является непосредственным, оно связано с трансформацией его молекулы. При этом, по-видимому, образуются свободные радикалы, которые вызывают образование пероксидов липидов, разрушающих липидные мембраны эндоплазматического ретикулума. Некоторый защитный эффект при индуцированных четыреххлористым углеродом процессах пероксидации оказывает введение в рацион витамина Е. Действие этионина обусловлено, как полагают, уменьшением доступности АТР. Так, при замене метионина в S-аденозилметионине этионином часть аденина оказывается связанной, что ограничивает синтез АТР. Оротовая кислота также вызывает жировое перерождение печени. Поскольку при этом в аппарате Гольджи накапливаются ЛПОНП, считают, что оротовая кислота нарушает процесс гликозилирования липопротеинов и таким образом ингибирует их высвобождение; это приводит к значительному уменьшению в плазме крови количества липопротеинов, содержащих апобелок В.
При недостатке витамина Е возрастает число некротических участков в печени при ее жировом перерождении, вызванном недостатком холина. Защитное действие при этом оказывает прием витамина Е или селен-содержащих соединений. Жировое перерождение печени может возникать при недостатке белков, а также незаменимых жирных кислот и витаминов (например, пиридоксина и пантотеновой кислоты). При недостатке незаменимых жирных кислот тормозится синтез фосфолипидов; поэтому жировое перерождение печени могут вызывать такие вещества, как холестерол, конкурирующие за доступные свободные жирные кислоты, участвующие в их эстерификации.
Путь превращения этанола
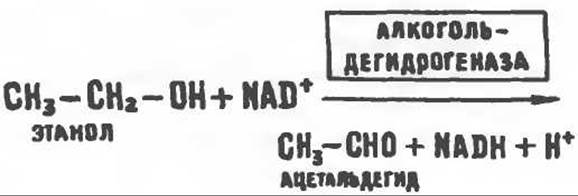
При алкоголизме также происходит накопление жира в печени, развивается гиперлипидемия, приводящая в конечном счете к циррозу печени. Точный механизм действия алкоголя при длительном его употреблении до конца не выяснен. Играет ли какую-либо роль в накоплении жира дополнительная мобилизация свободных жирных кислот, пока не ясно, но, как показано в ряде исследований, у крыс после введения одной токсичной дозы алкоголя происходит повышение уровня свободных жирных кислот. Однако при длительном употреблении алкоголя в печени накапливаются свободные жирные кислоты, поступившие не из жировой ткани, а образовавшиеся в результате эндогенного биосинтеза. После потребления алкоголя не наблюдается нарушения синтеза белков в печени. Имеются убедительные данные о том, что усиливается синтез триацилглицеролов в печени, уменьшается окисление жирных кислот и снижается активность цикла лимонной кислоты. Полагают, что это обусловлено окислением этанола в цитозоле клеток печени при участии алкогольдегидрогеназы и образованием избыточного количества NADH.
Образовавшийся NADH конкурирует за дыхательную цепь с восстанавливающими эквивалентами других соединений, ингибируя их окисление. При увеличении соотношения [NADH]/[NAD+] происходит сдвиг влево в равновесии малат ⇄ оксалоацетат; это может снизить активность цикла лимонной кислоты. Суммарным результатом ингибирования окисления жирных кислот является усиление эстерификации жирных кислот с образованием триацилглицеролов, что, по-видимому, и является причиной жирового перерождения печени. При окислении этанола образуется ацетальдегид, который затем окисляется в митохондриях при участии альдегиддегидрогеназы (конечным продуктом является ацетат). Другие аспекты действия алкоголя — усиление липогенеза и синтез холестерола из ацетил-СоА. Увеличение соотношения [NADH]/[NAD+] приводит также к увеличению соотношения [лактат]/[пируват], в результате чего развивается гиперлактатемия, которая в свою очередь снижает способность почек экскретировать мочевую кислоту. Возможно, именно это обстоятельство является причиной обострения подагры при употреблении алкоголя. Хотя основным путем метаболизма этанола является его окисление, катализируемое алкогольдегидрогеназой, часть этанола атакуется цитохром P-450-зависимой микросомальной системой, функционирующей при участии NADPH и О2. При хроническом алкоголизме эта система становится более активной, чем, вероятно, и объясняется ускорение метаболических превращений этанола, о чем говорит повышение содержания в крови как ацетальдегида, так и ацетата.