Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Синтез, транспорт и экскреция холестерола
Биосинтез холостерола - Путь биосинтеза
Приблизительно половина холестерола, имеющегося в организме, образуется путем биосинтеза (около 500 мг∙сут-1), а другая половина поступает с пищей. Холестерол синтезируется главным образом в печени (~ 50% от общего количества образующегося холестерола), кишечнике (~ 15%) и коже (большая часть остальной доли).
Все клетки, не утратившие ядро, способны синтезировать холестерол. Биосинтез холестерола происходит в микросомах (эндоплазматическом ретикулуме) и цитозоле.
Источником всех атомов углерода, входящих в молекулу холестерола, является ацетил-СоА. Путь биосинтеза сложной молекулы холестерола исследован во многих работах, и в настоящее время получены результаты, на основании которых установлено происхождение всех фрагментов молекулы холестерола (рис. 27.1, 27.2 и 27.3). Синтез этого вещества происходит в несколько стадий. 1. Мевалонат, в состав молекулы которого входит 6 атомов углерода, синтезируется из ацетил-СоА (рис. 27.1). 2. При отщеплении от мевалоната СО-, образуется изопреноидная единица (рис. 27.2). 3. Шесть изопреноидных единиц конденсируются с образованием промежуточного соединения сквалена. 4. Сквален циклизуется, образуя исходный стероид ланостерол. 5. Путем дальнейших превращений, включающих удаление трех метильных групп, ланостерол превращается в холестерол. (рис. 27.3).
1. Образование мевалоната через ГМГ-СоА (3-гидрокси-3-метилглутарил-СоА) протекает в цитозоле в результате такой же последовательности реакций, как и для биосинтеза кетоновых тел в митохондриях (гл. 28).
Hа первом этапе синтеза холестерола две молекулы ацетил-СоА конденсируются под действием цитозольного фермента тиолазы с образованием ацетоацетил-СоА. В альтернативном случае ацетоаце тат, образовавшийся в митохондриях печени по пути кетогенеза (см. гл. 28), диффундирует в цитозоль, где превращается в активное производное ацетоацетил-СоА (реакция катализируется ацетоацетил-СоА-синтазой при участии СоА и АТР). Другой фермент, ГМГ-СоА-синтаза, катализирует конденсацию ацетоацетил-СоА с ацетил-СоА с образованием ГМГ-СоА.
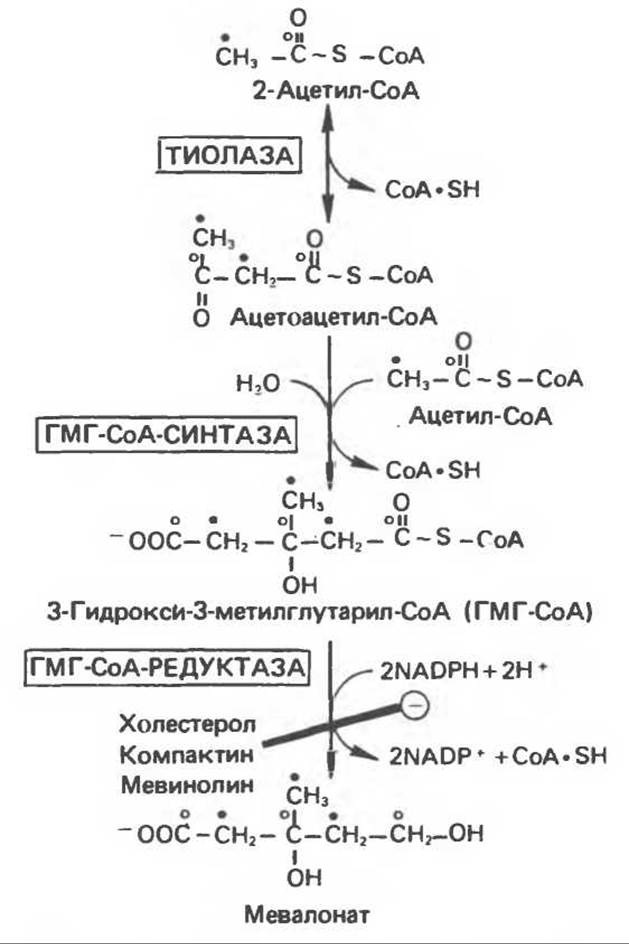
Рис. 27.1. Биосинтез мевалоиата. ГМ Г — 3-гилрокси- 3-метилглутарат. ГМГ-СоА-редуктаза ингибируется холоп еролом, а также метаболитами грибов компактином и мевинолином, которые конкурируют с ГМГ-СоА.
Затем ГМ Г-СоА превращается в мевалонат путем двухступенчатого восстановления за счет NADPH, катализируемого микросомальным ферментом ГМГ-СоА-редуктазой. Предполагается, что эта реакция является скорость-лимитирующей стадией на пути синтеза холестерола (рис. 27.1).
2. Мевалонат фосфорилируется АТР с образованием ряда активных фосфорилированных интермедиатов (рис. 27.2). Образовавшийся 3-фосфо-5-пирофосфомевалонат декарбоксилируется, в результате образуется изопентилпирофосфат — активная изопреноидная единица.
3. На следующем этапе происходит конденсация трех молекул изопентенилпирофосфата с образованием фарнезилпирофосфата. Процесс начинается с изомеризации изопентилпирофосфата (путем перемещения двойной связи) в диметилаллилпирофосфат.
Последний конденсируется с другой молекулой изопентенилпирофосфата с образованием десятиуглеродного интермедиата геранилпирофосфата (рис. 27.2), который затем конденсируется с еще одной молекулой изопентенилпирофосфата; в результате образуется фарнезилпирофосфат. Две молекулы фарнезилпирофосфата конденсируются концами, несущими пирофосфатные группы; сначала отщепляется одна пирофосфатная группа и образуется промежуточное соединение прескваленпирофосфат, которое затем восстанавливается NADPH с элиминированием оставшейся пирофосфатной группы и превращается в сквален. Следует отметить, что может функционировать побочный путь, который называют «транс-метилглутаконатный щунт». По этому пути значительная доля (20%) диметилаллилпирофосфата превращается в ГМГ-СоА (через транс-3-метилглутаконат-СоА). По-видимому. данный путь может участвовать в регуляции скорости синтеза холестерола.
4. Сквален имеет структуру, подобную стероидному ядру (рис. 27.3). Перед стадией циклизации сквален превращается в эндоплазматическом ретикулуме в 2,3-оксид сквалена под действием скваленэпоксидазы, которая относится к оксидазам со смешанной функцией. При циклизации, катализируемой оксидосквален — ланостерол-циклазой, метальная группа у С14 переносится на С13, а метильная группа у С8—на С14.
5. На последнем этапе (рис. 27.3) ланостерол превращается в мембранах эндоплазматического ретикулума в холестерол, при этом происходят изменения в стероидном ядре и боковой цепи. Метильная группа при С14 окисляется до СО2, и образуется 14-десметилланстерол. Подобным же образом удаляются еще две метальные группы при С4, и образуется зимостерол. Далее путем перемещения двойной связи между C8 и С9 в положение между C8 и С7 образуется ∆7,24-холестадиенол. В результате дальнейшего перемещения двойной связи в кольце В в положение между С5 и С6, характерное для молекулы холестерола, образуется десмостерол, и наконец, в результате восстановления двойной связи в боковой цепи образуется холестерол. Восстановление двойной связи в боковой цепи может, однако, происходить и на предшествующих стадиях биосинтеза холестерола. Следует отметить, что до настоящего времени еще нет точных данных о последовательности некоторых описанных выше превращений.
Предполагают, что промежуточные продукты на стадиях превращения сквалена в холестерол связываются специальным сквален- и стеролпереносящим белком. Этот белок связывает стеролы и другие нерастворимые липиды, обеспечивая им возможность участия в реакциях, протекающих в водной фазе клетки. Весьма вероятно, что холестерол превращается в стероидные гормоны и желчные кислоты, а также участвует в образовании мембран и липопротеинов, будучи связанным с холестеролпереносящим белком.
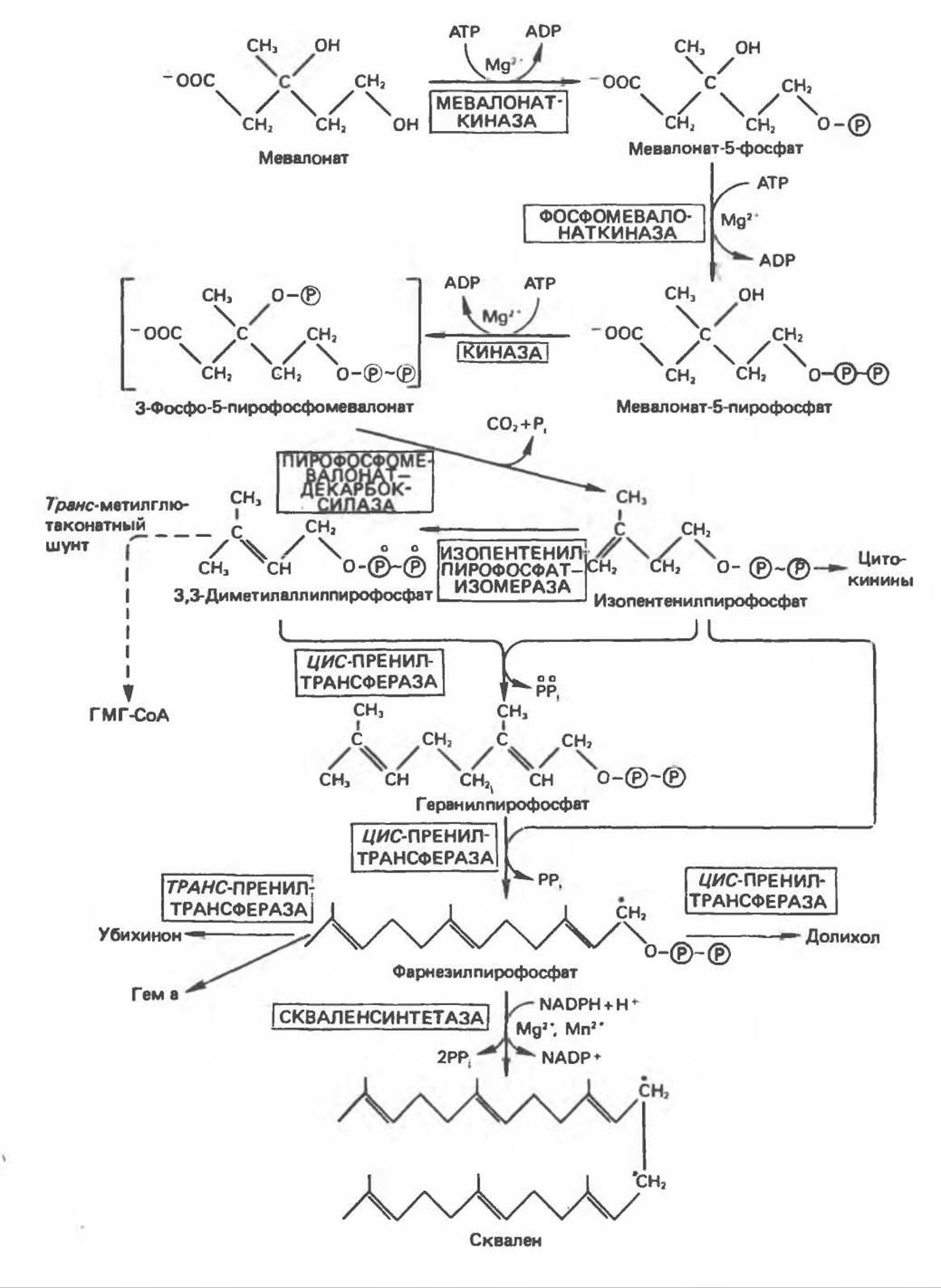
Рис. 27.2. Биосинтез сквалена, убихинона и долихола. ГМГ — 3-гидрокси-3-метилглутарат. Фарнезильный остаток входит в состав гема цитохромоксидазы. Атом углерода, помеченный звездочкой, занимает положение С11 или С12 в молекуле сквалена. Скваленсинтетаза является микросомальным ферментом, все остальные ферменты — растворимые белки цитоплазмы. Цитокинины представлены изопентениладенином - компонентом тРНК.
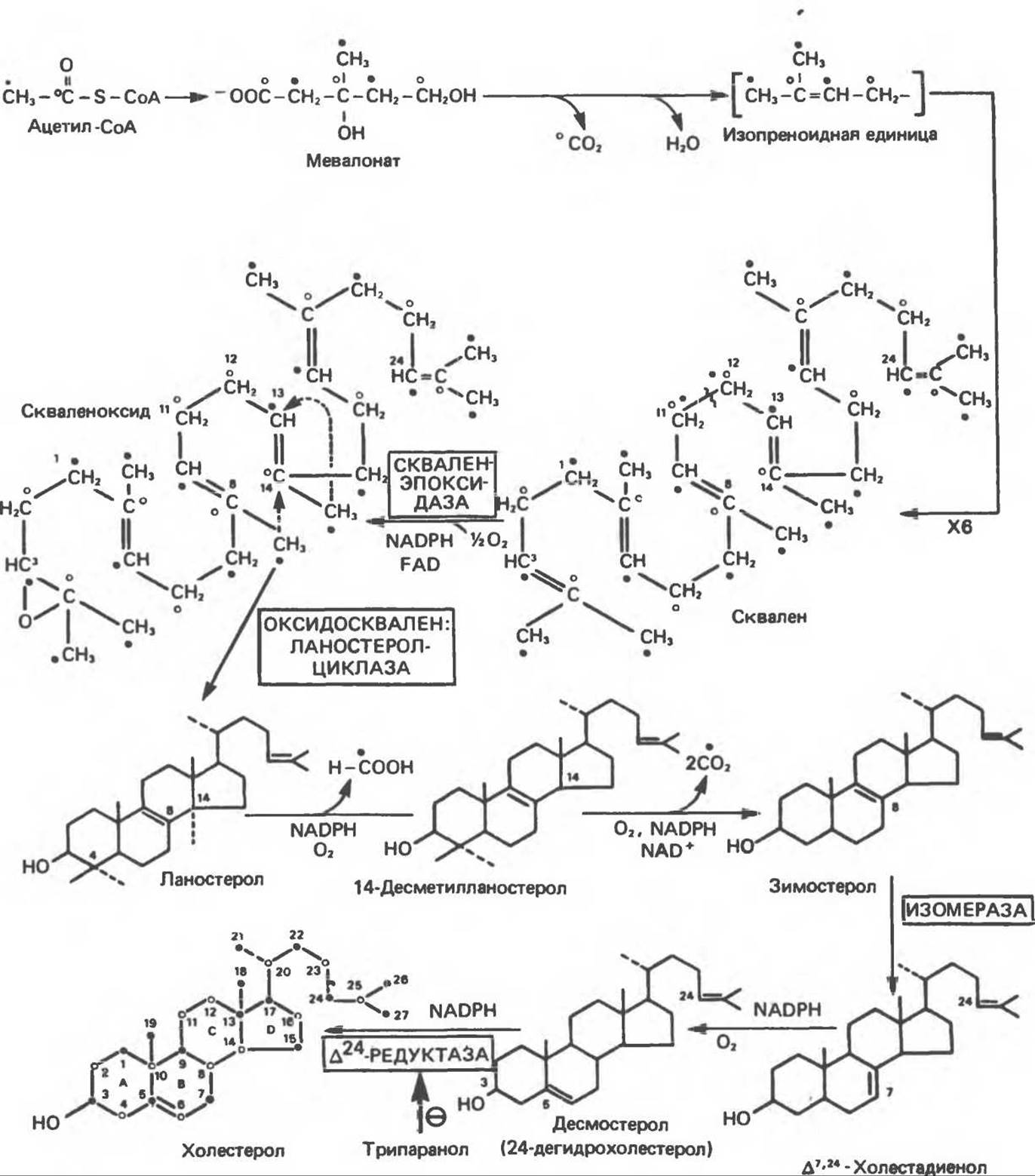
Рис. 27.3. Биосинтез холестерола. Атомы углерода пронумерованы, как в стероидном ядре. Звездочкой обозначены метки в сквалене, указанные на рис. 27.2.
Синтез других изопреноидных соединений
Фарнезилпирофосфат является предшественником других полиизопреноидов — долихола и убихинона. Полиизопренильный спирт долихол образуется путем присоединения еще 16 остатков изопентенилпирофосфата, а боковая цепь убихинона формируется путем присоединения 3—7 изопреноидных единиц.