Биохимия человека Том 1 - Марри Р. 1993
Метаболизм белков и аминокислот
Катаболизм углеродного скелета аминокислот
Аминокислоты, образующие сукцинил-кофермента
Суммарные реакции
При катаболическом превращении метионина, валина и изолейцина в амфиболический конечный продукт сукцинил-СоА часть углеродного скелета утрачивается (рис. 31.21). Четыре из пяти атомов углерода валина, три из пяти углеродных атомов метионина и половина углеродных атомов изолейцина переходят в молекулу сукцинил-СоА. Из карбоксильных атомов углерода всех этих аминокислот образуется СО2. Два концевых атома углерода молекулы изолейцина образуют ацетил-СоА, а S-метильная группа метионина удаляется.
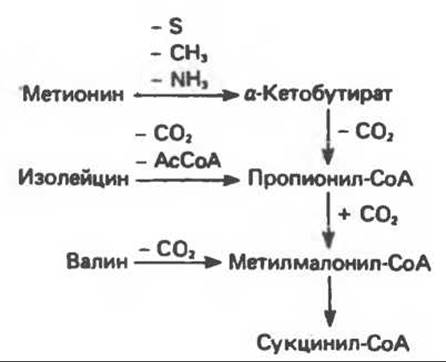
Рис. 31.21. Сводная схема катаболизма метионина, изолейцина и валина, превращающихся в сукцинил-СоА. Ас-СоА — ацетил-СоА.
Ниже описаны только реакции, которые приводят к превращению метионина и изолейцина в пропионил-СоА и к превращению валина в метилмалонил-СоА. Реакции превращения пропионил-СоА в метилмалонил-СоА и далее в сукцинил-СоА уже обсуждались в гл. 23 в связи с катаболизмом пропионата и жирных кислот с нечетным числом атомов углерода.
Метионин
Из L-метионина при взаимодействии его с АТР образуется S-аденозилметионин («активный метионин») (рис. 31.22). Активированная S-метильная группа может далее переноситься на целый ряд акцепторных соединений1. При удалении метильной группы образуется S-аденозилгомоцистеин. В результате гидролиза S—С-связи образуются L-гомоцистеин и аденин. Гомоцистеин далее конденсируется с серином, образуя цистатаонин (рис. 31.23). При гидролитическом расщеплении цистатионина образуются L- гомосерин и цистеин, так что суммарный процесс приводит к превращению гомоцистеина в гомосерин и серина в цистеин. Эти же две реакции участвуют в процессе биосинтеза цистеина из серина (см. гл. 29). Гомосерин превращается в а-кетобутират при участии гомосериндезаминазы (рис. 31.24). Затем происходит превращение а-кетобутирата в пропионил-СоА, оно осуществляется по обычному пути окислительного декарбоксилирования а-кетокислот (пирувата, а-кетоглутарата) с образованием ацил-СоА-производных.
Метаболические нарушения катаболизма метионина. См. табл. 31.2.
1 К соединениям, которые получают метальную группу от S-аденозилметаонина, относятся бетаины, холин, креатин, адреналин, мелатонин, саркозин, N-метилированные аминокислоты, нуклеотиды и многие растительные алкалоиды.
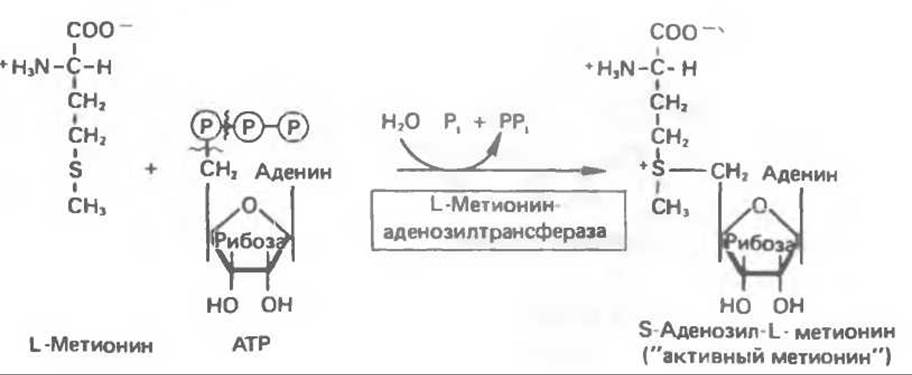
Рис. 31.22. Образование S-аденозилметионина. ~СН3 — группа «активного метионина», обладающая высоким потенциалом переноса.
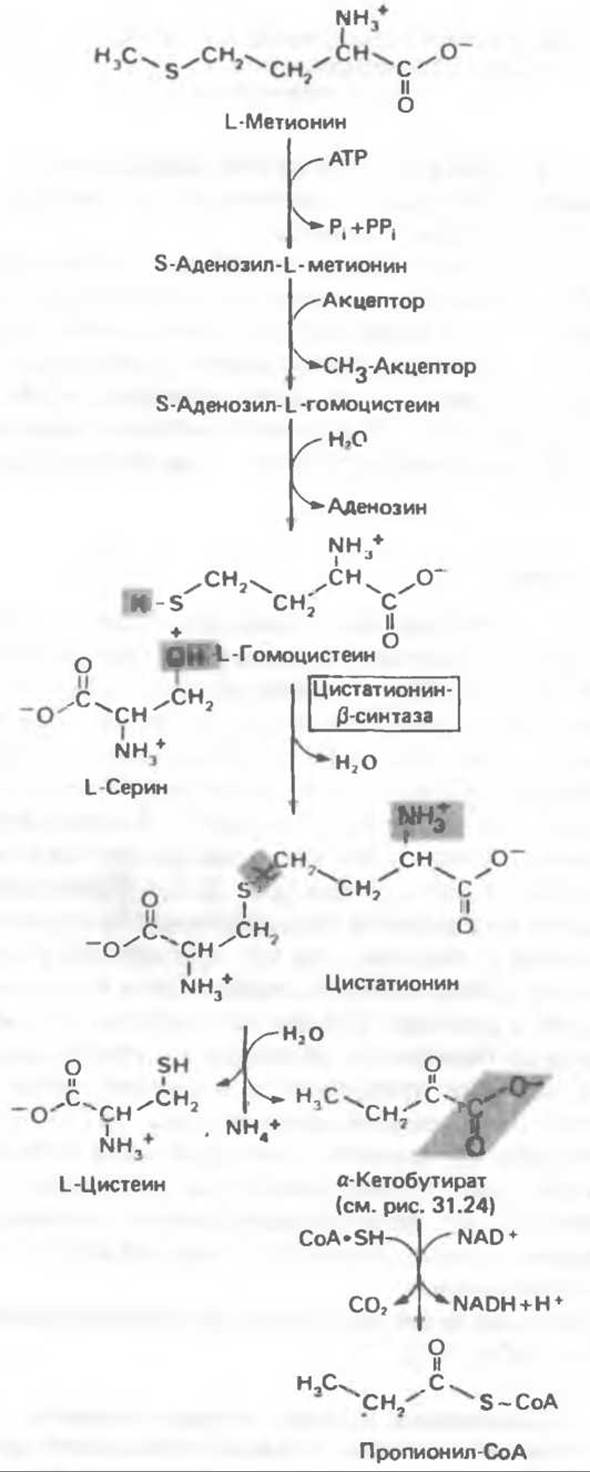
Рис. 31.23. Превращение метионина в пропионил-СоА.
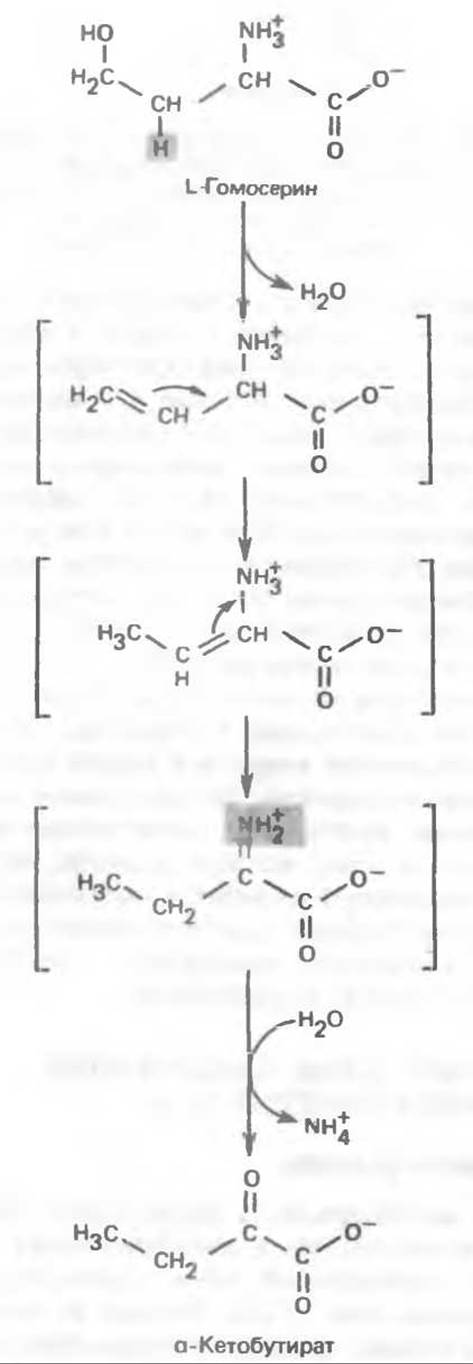
Рис. 31.24. Превращение L-гомосерина в и-кетобутират, катализируемое гомосериндезаминазой.
Лейцин, валин и изолейцин
Как и можно было предполагать, учитывая структурное сходство L-лейцина, L-валина и L-изолейцина, их катаболизм на первых этапах идет по общему пути. Затем этот путь разветвляется и скелет каждой аминокислоты трансформируется по собственному пути с образованием амфиболических интермедиатов (рис. 31.25 и 31.26). В зависимости от природы этих амфиболических конечных продуктов аминокислоты относят к типу гликогенных (валин), кетогенных (лейцин) или к обоим типам (изолейцин). Многие из рассматриваемых реакций аналогичны реакциям катаболизма жирных кислот с линейными и разветвленными цепями. В силу сходства начальных реакций катаболизма всех трех аминокислот, которое видно на рис. 31.26, их удобно рассматривать вместе. В последующем тексте номера реакций будут соответствовать тем, которые приведены на рис. 31.26—31.29.
А. Переа минирование. Обратимое переаминирование (реакция 1) всех трех разветвленных L-а-аминокислот в тканях млекопитающих осуществляется, вероятно, одной и той же трансаминазой. Обратимостью этой реакции объясняется возможность замены в диете L-a-аминокислот соответствующими a-кетокислотами, если организму доступны адекватные источники азота.
Б. Окислительное декарбоксилирование с образованием ацил-СоА-тиоэфиров. Эта реакция (реакция 2) аналогична окислению пирувата до ацетил-СоА и СО2 пируватдегидрогеназой и окислению а-кетоглутарата до СО2 и сукцинил-СоА а-кетоглутаратдегидрогеназой (см. гл. 18). У млекоптающих дегидрогеназа разветвленных a-кетокислот является митохондриальным мультиферментным комплексом, катализирующим окислительное декарбоксилирование a-кетоизокапроата (из лейцина), а-кето-β-метилвалерата (из изолейцина) и а-кетоизовалерата (из валина).
Субъединицы дегидрогеназного комплекса а-кетокислот аналогичны соответствующим субъединицам пируватдегидрогеназы. Комплекс включает субъединицы с декарбоксилазной (по отношению к a-кетокислотам), трансацилазной и дигидролипоилдегидрогеназной активностями. Как и в случае пируватдегидрогеназы, данный комплекс инактивируется при фосфорилировании за счет АТР в реакции, катализируемой протеинкиназой. Са2+. Независимая фосфопротеинфосфатаза катализирует дефосфорилирование комплекса и, следовательно, реактивирует его. Таким образом, перевод фермента в фосфорилированное состояние может регулировать катаболизм аминокислот с разветвленной цепью. Протеинкиназа ингибируется ADP, а-кетокислотами с разветвленной цепью, гиполипидемическим агентом клофибратом и дихлорацетатом, а также тиоэфирами кофермента А (например, ацетоацетил-СоА). Из разветвленных а-кетокислот самым сильным ингибитором является а-кетоизокапроат (а-кетолейцин).
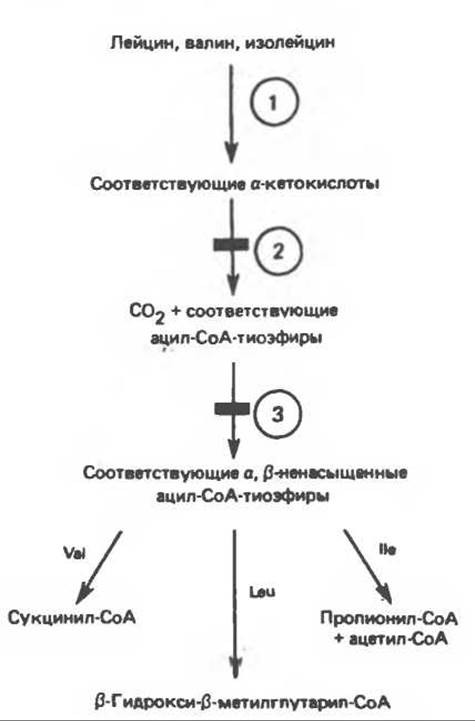
Рис. 31.25. Катаболизм аминокислот с разветвленной цепью у млекопитающих. Реакции 1—3 — общие для всех трех аминокислот; далее пути их катаболизма расходятся. Перечеркнутые стрелки показывают стадии, на которых метаболизм блокирован в случае двух редко встречающихся заболеваний: 2 — болезни «кленового сиропа» (нарушен катаболизм всех трех аминокислот), 3 — изовалериановой ацидемии (нарушен катаболизм лейцина).
В. Дегидрогенирование с образованием а, ß-ненасыщенных тиоэфиров ацил-СоА. Эта реакция (реакция 3) аналогична дегидрогенированию линейных ацил-СоА тиоэфиров в процессе катаболизма жирных кислот. Пока неизвестно, катализирует ли дегидрогенирование всех трех разветвленных ацил-СоА тиоэфиров одна и та же дегидрогеназа. Косвенные данные указывают на участие по крайней мере двух ферментов; они основаны на обследовании пациентов с изовалериановой ацидемией, у которых после приема обогащенной белком пищи в крови накапливается изовалерат; при этом содержание других разветвленных а-кетокислот не повышается. Изовалерат образуется путем деацилирования изовалерил-СоА, являющегося субстратом упомянутой выше дегидрогеназы.
Реакции, специфичные для катаболизма лейцина (рис. 31.27)
Реакция 4L: карбоксилирование ß-метилкротонил-СоА. Ключевым наблюдением, позволившим объяснить кетогенное действие лейцина, было обнаружение того факта, что при превращении концевой изопропильной группы лейцина в ацетоацетат происходит «фиксация» (т.е. ковалентное связывание) 1 моля СО2 на моль изопропильных групп. Этой фиксации (реакция 4L, рис. 31.27) предшествует осуществляемое за счет энергии АТР присоединение СО2 к связанному с ферментом биотину с образованием биотинил-СО2. В результате фиксации СО2 образуется интермедиат ß-метилглутаконил-СоА.
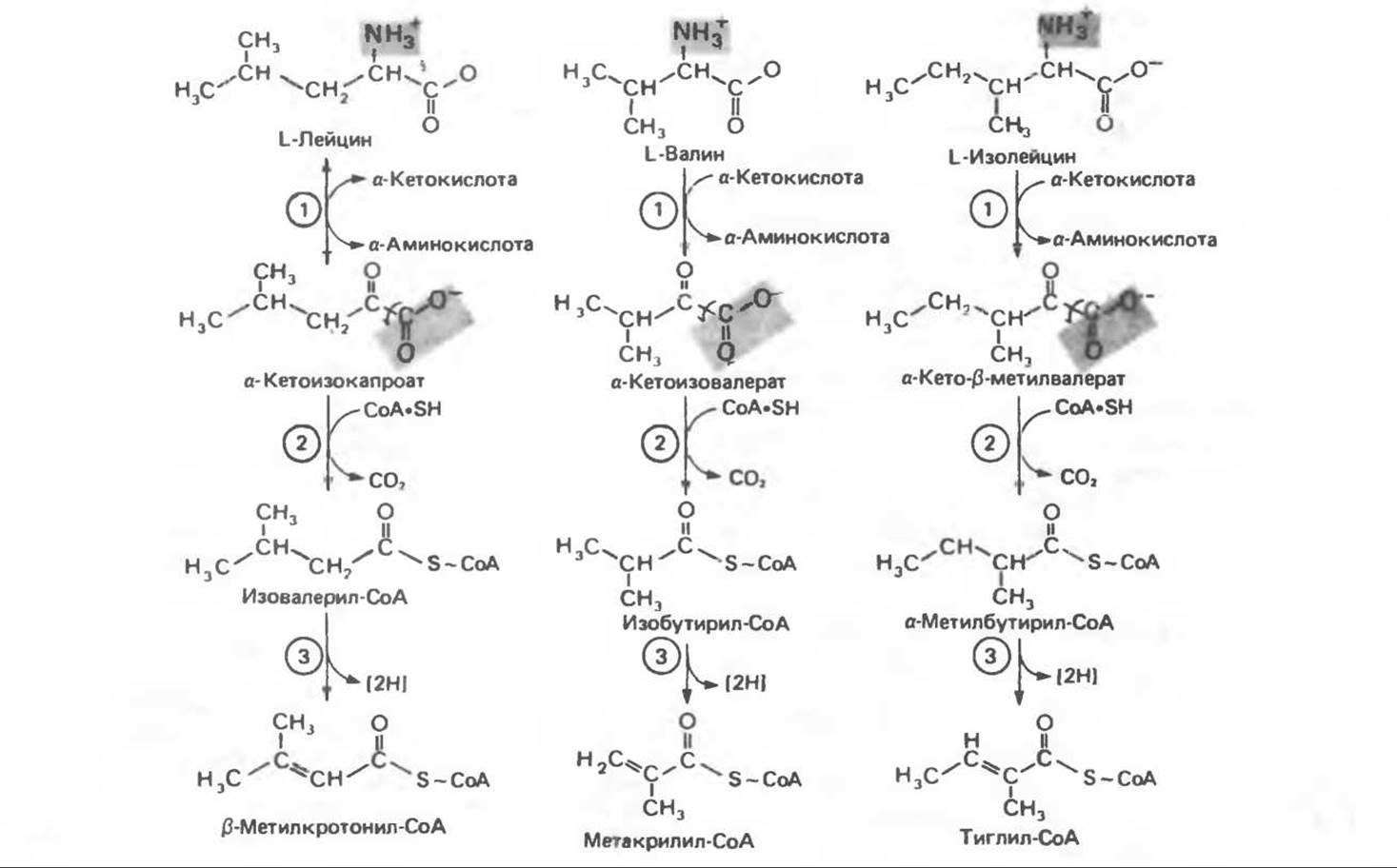
Рис. 31.26. Сходство трех первых реакций катаболизма лейцина, валина и изолейцина. Обратите внимание, что реакции 2 и 3 сходны также с соответствующими реакциями катаболизма жирных кислот. Подобная аналогия обнаруживается и на ряде последующих стадий (см. последующие рисунки).
Реакция 5L: присоединение воды по двойной связи ß-метилглутаконил СоА. Продукт реакции ß-гидрокси-ß-метилглутарил-СоА служит предшественником не только кетоновых тел (реакция 6L, рис. 31.27), но также и мевалоната, который далее может превращаться в холестерол и другие полиизопреноиды (см. гл. 28).
Реакция 6L: расщепление ß-гидрокси-β-метилглутарил-СоА. Реакция, в ходе которой из ß-гидрокси-ß-метилглутарил-СоА образуются ацетил-СоА и ацетоацетат, протекает у млекопитающих в митохондриях клеток печени, почек и сердца. Этим процессом объясняется сильное кетогенное действие лейцина, поскольку на 1 моль лейцина наряду с 1 молем ацетоацетата образуется опосредованно еще 1/2 моля кетоновых тел из ацетил-СоА (см. гл. 28).
Реакции, специфичные для катаболизма валина (рис. 31.28)
Реакция 4V: гидратация метилакрилил-СоА. Эта реакция, идущая достаточно быстро и в отсутствие фермента, катализируется кротоназой, представляющей собой гидролазу с широкой специфичностью, действующую на L-ß-гидроксиацил-СоА-тиоэфиры, содержащие в оксиацильной части 4—9 атомов углерода.
Реакция 5V: деацилирование ß-гидроксиизобутирил-СоА. Поскольку СоА-тиоэфир не является субстратом последующей реакции (реакция 6V, рис. 31.28), он должен быть сначала деацилирован в ß-гидроксиизобутират (реакция 5V, рис. 31.28). Эта реакция катализируется деацилазой, присутствующей во многих животных тканях; деацилаза может действовать также еще на один субстрат — ß-гидроксипропионил-СоА.
Реакция 6V: окисление ß-гидроксиизобутирата. В тканях млекопитающих содержится фермент, катализирующий NAD+-зависимое окисление первичной спиртовой группы ß-гидроксиизобутирата в альдегидную (реакция 6V, рис. 31.28) с образованием метилмалонового альдегида. Реакция легко обратима.
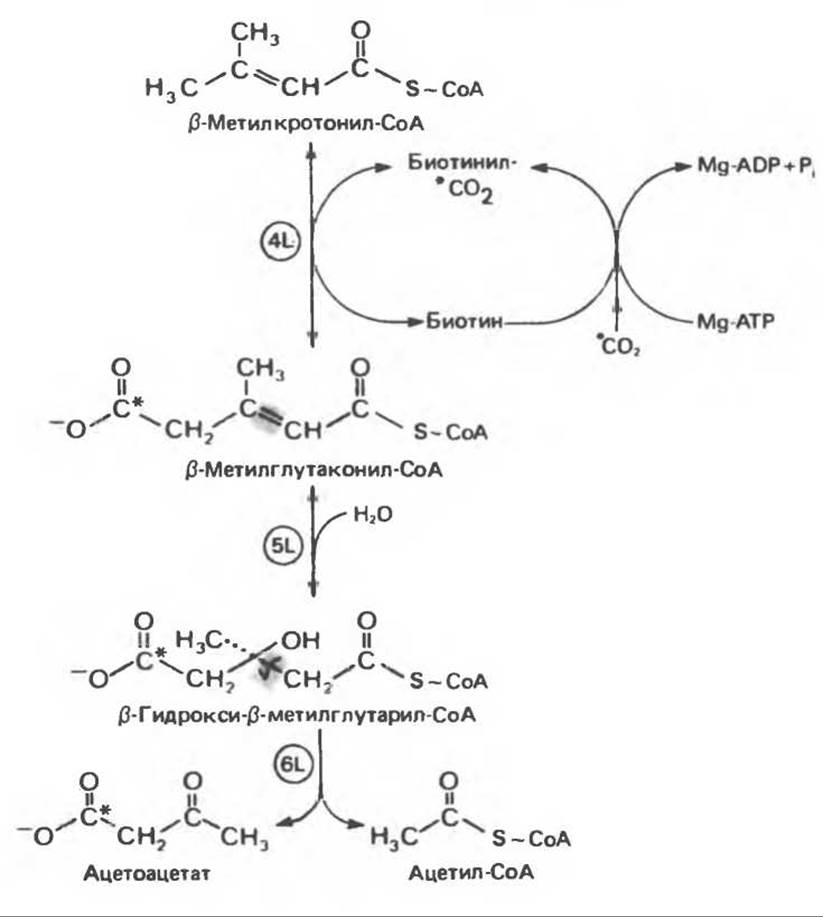
Рис. 31.27. Катаболизм ß-мстилкротонил-СоА, образующегося из L-лейцина (см. рис. 31.26). Звездочкой отмечены атомы углерода, поступившие из СО2. Структура биотинил-СО2 показана на рис. 20.4.
Реакция 7V: дальнейшие превращения метилмалонового полуальдегида. Дальнейший метаболизм метилмалонового полуальдегида в тканях млекопитающих может идти по двум путям: в результате переаминирования из него образуется ß-аминоизобутират (реакция 7V, рис. 31.28), а при превращении по пути, изображенному на рис. 31.28 (реакции 8V—10V), — в сукцинил-СоА. Переаминирование с образованием а-аминоизобутирата — аминокислоты, в норме присутствующей в моче, — осуществляется в различных тканях млекопитающих, в том числе в почках. Второй основной путь — окисление в метилмалонат с последующим образованием метилмалонил-СоА и изомеризацией последнего в сукцинил-СоА (реакции 8V—10V, рис. 31.28). Изомеризация (реакция 10V, рис. 31.28) протекает при участии аденозилкобаламинового кофермента, она катализируется метилмалонил-СоА-мутазой. Эта реакция важна для катаболизма не только валина, но и пропионил-СоА-катаболита изолейцина (рис. 31.29). В условиях дефицита кобаламина (витамина В12) активность мутазы снижается; у жвачных, использующих в качестве источника энергии пропионат, образующийся при брожении в рубце, при этом наблюдается «пищевой метаболический дефект». Очищенная мутаза из печени овцы содержит 2 молекулы дезоксиаденозил-витамина В12 на молекулу фермента. Преобразование в сукцинил-СоА происходит путем внутримолекулярного переноса связанной с СоА карбоксильной группы. Хотя полная реакция напоминает изомеризацию Tpeo-ß-метиласпартата в глутамат, механизмы этих реакций, вероятно, различаются.
Реакции, специфичные для катаболизма изолейцина (рис. 31.29)
Подобно тому как это было в случае валина и лейцина, первые сведения о катаболизме изолейцина были получены в ходе наблюдений над животными, которые содержались на различных рационах; в результате были выявлены гликогенные и слабокетогенные свойства изолейцина. Возможность синтеза гликогена из изолейцина была подтверждена при использовании D2О. С помощью 14С-меченных соединений показано, что углеродный скелет изолейцина расщепляется с образованием ацетил-СоА и пропионил-СоА (рис. 31.29).
Реакция 41: гидратация тиглил-СоА. Эта реакция протекает аналогично реакции катаболизма валина (реакция 4V, рис. 31.28). Она катализируется кротоназой тканей млекопитающих.
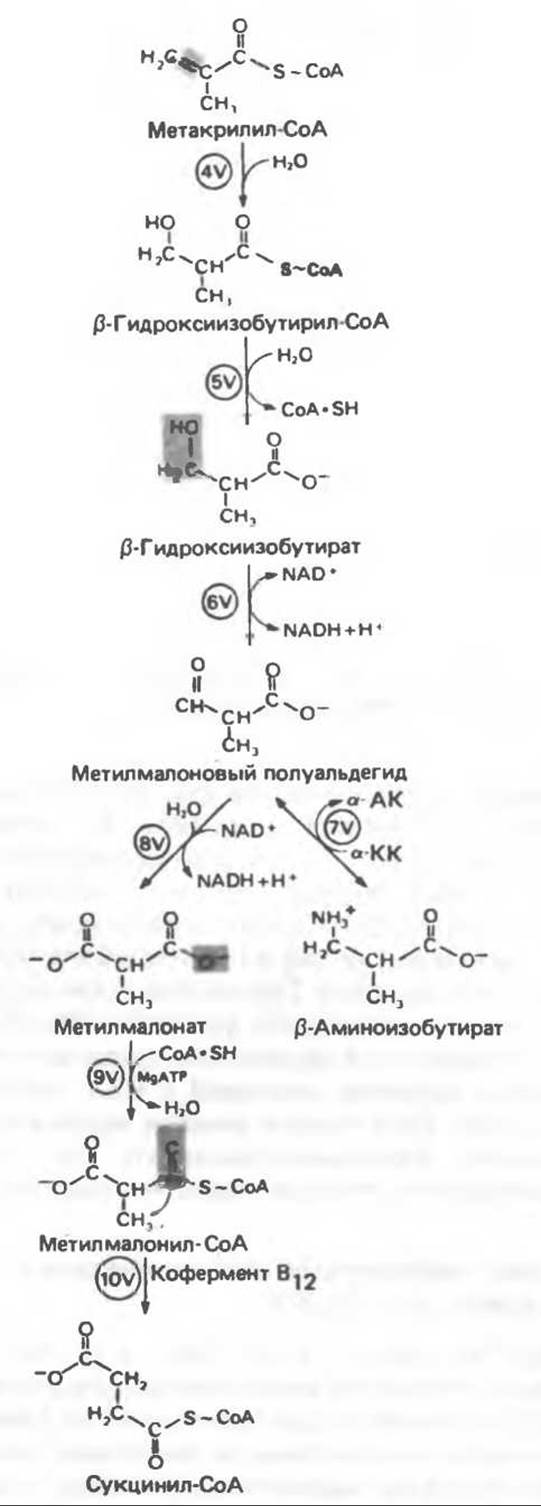
Рис. 31.28. Катаболизм метакрилил-СоА, образующегося из L-валина (см. рис. 31.26). а-КК — а-кетокислота, а-АК — а-аминокислота.
Реакция 51: дегидрогенирование а-метил-β-гидроксибутирил-СоА. Реакция аналогична реакции 5V катаболизма валина (рис. 31.28). Напомним, что в ходе катаболизма валина соответствующий ацил-СоА сначала гидролизуется и лишь затем окисляется.
Реакция 61: тиолиз а-метилацетоацетил-СоА. Тиолитическии разрыв ковалентной связи между углеродными атомами 2 и 3 в молекуле а-метилацетоацетил-СоА катализируется ß-кетотиолазой подобно тиолизу ацетоацетил-СоА с образованием двух молекул ацетил-СоА. Природа образующихся продуктов, ацетил-СоА (кетогенный) и пропионил-СоА (гликогенный), позволяет понять кетогенные и гликогенные свойства изолейцина.
Метаболические нарушения катаболизма разветвленных аминокислот (лейцина, валина и изолейцина)
Известны четыре метаболических нарушения. Наиболее обстоятельно изучена болезнь «кленового сиропа» (названная по характерному запаху мочи больных). Описано более 50 случаев заболевания. Частота его оценивается в 5—10 случаев на миллион новорожденных. Остальные три болезни — гипервалинемия, скачкообразная кетонурия (повышение содержания в моче кетокислот с разветвленной цепью) и изовалериановая ацидемия — наблюдались менее чем у пяти детей каждая.
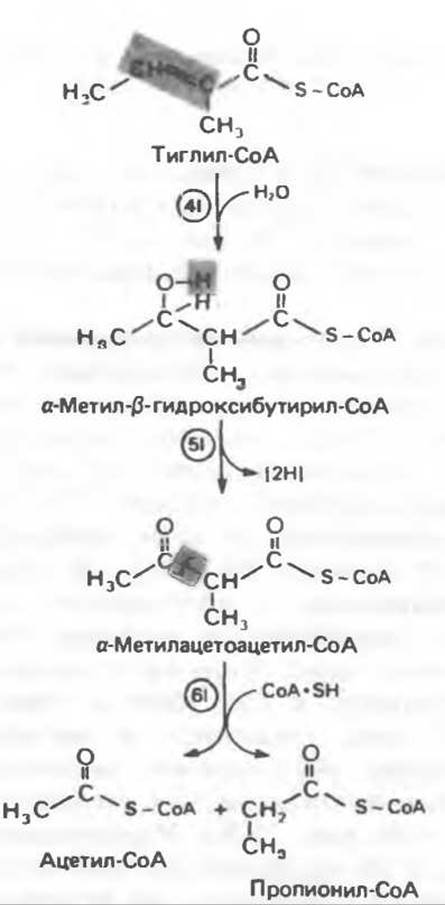
Рис. 31.29. Катаболизм тиглил-СоА, образующегося из L- изолейцина (см. рис. 31.26).
A. Гипервалинемия. Это метаболическое заболевание характеризуется повышенным содержанием в плазме валина (но не лейцина или изолейцина), что обусловлено нарушением переаминирования валина с образованием а-кетоизовалерата (реакция 1, рис. 31.26). При этом переаминирование лейцина и изолейцина (реакция 1, рис. 31.26) не нарушается.
Б. Болезнь «кленового сиропа». Наиболее ярким отличительным признаком этой наследственной болезни является характерный запах мочи больного, напоминающий запах кленового сиропа или жженого сахара. В плазме и в моче сильно повышается содержание аминокислот с разветвленной цепью — лейцина, изолейцина и валина, а также соответствующих им а-кетокислот. Поэтому болезнь «кленового сиропа» иногда называют кетонурией разветвленных кетокислот. Отмечено также присутствие в моче разветвленных а-гидроксикислот, образующихся при восстановлении а-кетокислот.
Характерные признаки болезни проявляются в конце первой недели после рождения. Наряду с описанными выше биохимическими нарушениями возникают трудности при кормлении ребенка, может наблюдаться рвота. Иногда наблюдается летаргия. Диагноз ранее конца первой недели возможен только с помощью ферментного анализа. У выживших детей отмечены выраженные нарушения мозговой деятельности. При отсутствии лечения летальный исход наступает к концу первого года жизни.
Биохимической причиной болезни является отсутствие или сильное снижение активности декарбоксилазы а-кетокислот, катализирующей превращение всех трех разветвленных а-кетокислот в ацил-СоА-тиоэфиры с выделением СО2 (реакция 2, рис. 31.26). Это было установлено путем ферментного анализа лейкоцитов и клеток культуры фибробластов кожи больных детей. Механизм токсического действия накапливающихся соединений неизвестен.
Больным назначают диету с заменой белков на смесь очищенных аминокислот, не содержащую лейцина, изолейцина и валина. После того как содержание этих трех аминокислот в плазме снизится до нормального уровня, можно вводить их в пищу, например, в составе молока и других продуктов, но лишь в таком количестве, чтобы обеспечить (но не превысить) потребности в аминокислотах с разветвленной цепью. Нет сведений о том, можно ли впоследствии ослабить ограничения в диете и когда именно. Если лечение было начато в первую неделю жизни ребенка, удается значительно смягчить тяжелые проявления болезни.
B. Скачкообразная кетонурия (разветвленных кетокислот). Эта болезнь является одной из форм болезни «кленового сиропа» и, вероятно, связана со сравнительно меньшими структурными изменениями декарбоксилазы а-кетокислот. Активность декарбоксилазы в лейкоцитах и фибробластах значительно ниже нормы, но все же существенно выше, чем в классических случаях болезни «кленового сиропа». Поскольку в этом случае больные обладают хотя и сниженной, но все же определенной способностью к катаболизму лейцина, изолейцина и валина, типичные симптомы болезни «кленового сиропа» проявляются позднее и наблюдаются лишь эпизодически. Прогноз при назначении соответствующей диеты более благоприятный.
Болезнь «кленового сиропа» и скачкообразная кетонурия разветвленных кетокислот могут служить иллюстрацией положения, о котором говорилось во введении к этой главе, — о мутациях, вызывающих различные изменения в структуре одного и того же фермента. Вероятно, изменения активности фермента проявляются в спектре форм заболевания, включающем выраженную форму, скачкообразную кетонурию и практически нормальное состояние.
Г. Изовалериановая ацидемия. Симптомами заболевания являются запах сыра у выдыхаемого воздуха и жидкостей организма, рвота, ацидоз и даже кома; последняя может возникнуть при избыточном потреблении белка или как следствие присоединившегося инфекционного заболевания. В трех известных случаях наблюдалась умеренная задержка умственного развития. Причиной болезни является недостаточность изовалерил-СоА-дегидрогеназы (реакция 3, рис. 31.26). Накапливающийся в результате изовалерил-СоА гидролизуется, образующийся изовалерат выделяется в составе мочи и пота.
Дополнительные метаболические нарушения, связанные с катаболизмом аминокислот (пропионат, метилмалонат и витамин В12)
Пропионил-СоА (рис. 31.21) может образоваться из изолейцина (рис. 31.26 и 31.29), метионина (рис. 31.23), а также из боковой цепи холестерола и жирных кислот с нечетным числом атомов углерода. Превращение пропионил-СоА в амфиболические интермедиаты включает биотинзависимое карбоксилирование с образованием метилмалонил-СоА; последний может образоваться и непосредственно из валина (при этом не происходит предварительного образования пропионил-СоА) (рис. 31.21 и 31.28, реакция 9 V). В результате изомеризации, коферментом которой является производное витамина В12, метилмалонил-СоА превращается в сукцинил-СоА — интермедиат цикла лимонной кислоты, который окисляется до СО2 и воды.
Вскоре после того, как было установлено участие 5'-дезоксиаденозилкобаламина в качестве кофактора изомеризации метилмалонил-СоА в сукцинил-СоА, было показано, что пациенты с недостаточностью витамина В12 экскретируют с мочой большие количества метилмалоната. Метилмалоновая ацидурия прекращалась после введения достаточных количеств витамина В12.
А. Пропионовая ацидемия. Недостаточная активность пропионил-СоА-карбоксилазы характеризуется высоким содержанием пропионата в сыворотке и нарушением катаболизма пропионата в лейкоцитах. Лечение состоит в назначении бедной диеты и в принятии мер по снижению метаболического ацидоза.
Б. Метилмалоновая ацидурия. Известны две формы метилмалоновой ацидурии. Одна из них прекращается после парентерального введения физиологических доз витамин В12, а другая — нет. В последнем случае улучшение наступает после введения больших (фармакологических) доз витамина B12 (I г в сутки). Фибробласты больных, культивируемые в среде, содержащей витамин В12 (концентрация 25 пг∙мл-1), слабо окисляют [14С]-пропионат. Содержание 5'-дезоксиаденозилкобаламина в клетках культуры составляло только около 10% от его содержания в контрольных клетках. После повышения концентрации витамина В12 в среде в 10000 раз скорость окисления пропионата и внутриклеточная концентрация 5'-дезоксиаденозилкобаламина приблизились к норме. В то же время не наблюдалось отклонений в связывании кофермента с апоферментом мутазы. Таким образом, причиной второй формы метилмалоновой ацидурии, по-видимому, является неспособность к образованию 5'-дезоксиаденозилкобаламина при нормальных концентрациях витамина.
Приведенные выше примеры наследственных нарушений катаболизма аминокислот относятся к сравнительно хорошо изученным заболеваниям. По этой теме имеется более обстоятельный обзор (Wellner and Meister, 1981).
Литература
Bremer H. J. et al. Amino Acid Metabolism: Clinical Chemistry and Diagnosis, Urban and Schwarzenberg. 1981.
Cooper A. J. L. Biochemistry of the sulfur-containing amino acids, Annu. Rev. Biochem., 1983, 52, 187.
Felig P. Amino acid metabolism in man, Annu. Rev. Biochem., 1975, 44, 933.
Frimter G. W. Aminoacidurias due to disorders of metabolism. (2 parts), N. Engl. J. Med., 1973, 289, 835, 895.
Paxton R., Harris R. A. Isolation of rabbit liver branched chain a-ketoacid dehydrogenase and regulation by phosphorylation, J. Biol. Chem., 1982, 257, 14433.
Paxton R., Harris R.A. Regulation of branched-chain a-ketoacid dehydrogenase kinase, Arch. Biochem Biophys, 1984, 231, 48.
Rosenberg L. E., Scriver C. R. Disorders of amino acid metabolism, Chapter 11. In: Metabolic Control and Disease, Bondy P. K., Rosenberg L. E. (eds), Saunders, 1980.
Schwarz V. A Clinical Companion to Biochemical Studies, Freeman, 1978.
Stanbury J. B. et al., (eds), The Metabolic Basis of Inherited Disease, 5th ed., McGraw-Hill, 1983.
Wellner D., Meister A. A survey of inborn errors of amino acid metabolism and transport in man, Annu. Rev. Biochem., 1981,50,911.