Биохимия человека Том 1 - Марри Р. 1993
Метаболизм белков и аминокислот
Превращение аминокислот в специализированные продукты
Орнитин
Помимо его роли в биосинтезе мочевины (см. гл. 30) орнитин (вместе с метионином) служит предшественником широко распространенных у млекопитающих (и бактерий) полиаминов спермина и спермидина (рис. 32.5). В организме здорового человека синтезируется приблизительно 0,5 ммоль спермина в день. Фармакологические дозы полиаминов вызывают понижение температуры и снижение кровяного давления.
Спермидин и спермин участвуют в различных физиологических процессах, общим признаком которых является связь с процессами пролиферации и роста клеток. Они являются факторами роста для культур клеток млекопитающих и бактерий и играют определенную роль в стабилизации интактных клеток, субклеточных органелл и мембран. Благодаря тому что молекулы полиаминов несут большое число положительных зарядов, они легко ассоциируют с полианионами, такими, как ДНК и РНК, и участвуют в таких фундаментальных процессах, как стимуляция биосинтеза ДНК и РНК, стабилизация ДНК и упаковка ДНК в бактериофагах. Полиамины оказывают влияние на синтез белка и являются ингибиторами ряда ферментов, включая протеинкиназы.
Хотя в настоящее время не удается описать механизм действия полиаминов на специфические метаболические процессы, их важная роль в метаболизме млекопитающих убедительно показана в экспериментах приводимого ниже типа. Начальная реакция биосинтеза полиаминов катализируется орнитиндекарбоксилазой (рис. 32.6). Добавление в культуру клеток млекопитающих ингибиторов орнитиндекарбоксилазы (например, а-метилорнитина или дифторметилорнитина) вызывает усиление синтеза орнитиндекарбоксилазы. Это свидетельствует о важной физиологической роли данного фермента, единственной известной функцией которого является биосинтез полиаминов.
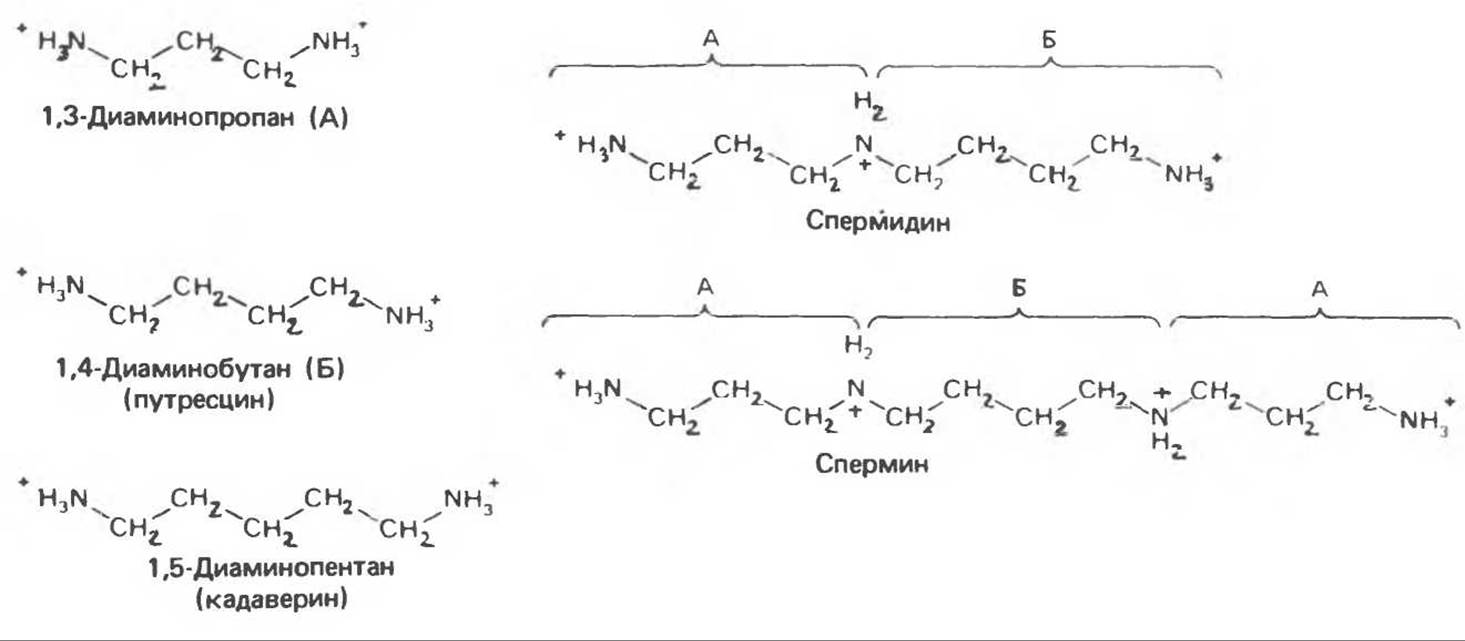
Рис. 32.5. Структура природных полиаминов. Обратите внимание, что спермидин и спермин являются полимерами диаминопропана (А) и диаминобутана (Б). В тканях млекопитающих присутствует также диаминопентан (кадаверин).
Биосинтез полиаминов
На рис. 32.6 представлен метаболический путь биосинтеза полиаминов в тканях млекопитающих. Обратите внимание на то, что путресциновый фрагмент спермидина и спермина образуется из L-орнитина (интермедиата цикла мочевины, см. гл. 30), а диаминопропановый фрагмент — из L-метионина (с промежуточным образованием S-аденозилметионина). Орнитиндекарбоксилаза и S-аденозилметионин-декарбоксилаза являются индуцируемыми ферментами с коротким периодом полужизни. Спермин- и спермидинсинтаза, напротив, не являются индуцируемыми и относительно «стабильны».
Из числа ферментов биосинтеза полиаминов у млекопитающих орнитиндекарбоксилаза и S-аденозилметионин-декарбоксилаза представляют интерес в плане их регуляции и возможности направленной химиотерапии. Время полужизни орнитиндекарбоксилазы (приблизительно 10 мин) меньше, чем у любого другого известного фермента млекопитающих; активность этого фермента очень быстро и масштабно изменяется в ответ на различные стимулирующие воздействия. Добавление в культуру клеток млекопитающих гормона роста, кортикостероидов, тестостерона или фактора роста эпидермиса быстро повышает активность орнитиндекарбоксилазы в 10—200 раз. При добавлении в культуру клеток полиаминов индуцируется синтез белкового антифермента (антизима), который связывается с орнитиндекарбоксилазой и ингибирует ее активность. Таким образом, активность орнитиндекарбоксилазы контролируется белок-белковым взаимодействием подобно регуляции активности трипсина ингибиторами белковой природы. По отношению к орнитиндекарбоксилазе дифторметилорнитин можно рассматривать как «суицидальный ингибитор», т.е. соединение, превращающееся в ингибитор под действием самого фермента. Он используется для выделения штамма мутантных клеток, характеризующихся гиперпродукцией орнитиндекарбоксилазы, а также как ингибитор репликации клеток (он действует как химиотерапевтический фактор, мишенью которого является фермент).
S-аденозилметионин-декарбоксилаза является единственным известным эукариотическим ферментом, содержащим пируват как ковалентно связанный кофактор (обычно декарбоксилазы содержат пиридоксальфосфат, но в S-аденозилметиониндекарбоксилазе он отсутствует). S-Аденозилметионин-декарбоксилаза имеет сравнительно небольшой период полужизни (1—2 ч) и реагирует на действие стимуляторов клеточного роста подобно орнитиндекарбоксилазе, однако несколько медленнее и менее масштабно. Активность S-аденозилметионин-декарбоксилазы (рис. 32.6) ингибируется декарбоксилированным S-аденозилметионином и стимулируется путресцином.
Катаболизм полиаминов
На рис. 32.7 представлена схема катаболизма полиаминов в тканях млекопитающих. Фермент полиаминоксидаза, находящийся в пероксисомах печени, окисляет спермин в спермидин и далее спермидин в путресцин. Оба диаминопропановых фрагмента превращаются в ß-аминопропионовый альдегид. Часть образующегося путресцина окисляется с образованием NH+4 и СО2, механизм этого процесса еще не выяснен. Основная часть путресцина и спермидина выделяется с мочой в виде конъюгатов, главным образом в форме ацетильных производные.