Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Белки: структура и свойства
Упорядоченные конформации полипептидов
а-Спираль
Основополагающим моментом в нашем понимании принципов организации белков послужило выявление того факта, что полипептидные цепи могут находиться в высокоупорядоченной конформации, стабилизируемой водородными связями между пептидными группами. Впоследствии существование подобных высокоупорядоченных структур было многократно подтверждено данными ренгеноструктурного анализа кристаллов белков при высоком разрешении, однако вначале концепция носила чисто теоретический характер.
Согласно рентгенографическим данным, полученным в начале 1930-х гг., а-кератины волос и шерсти обладают продольной периодичностью 0,5—0,55 нм. Однако в вытянутой полипептидной цепи расстояний, порождающих такую периодичность, найти не удавалось (рис. 5.2). Это кажущееся противоречие было устранено Полингом и Кори, предположившими, что полипептидные цепи а-кератина имеют форму а-спирали (рис. 5.3). В этой структуре R-группы при а-углеродных атомах направлены от оси спирали (рис. 5.4). На один виток спирали приходится 3,6 аминокислотных остатка, а шаг спирали составляет 0,54 нм, что близко к периодичности 0,5—0,55 нм, наблюдаемой на дифракционных картинах. Смещение вдоль оси, приходящееся на один остаток, равно 0,15 нм, что тоже согласуется с рентгеновскими данными. Основные характеристики a-спирали сводятся к следующему (рис. 5.5).
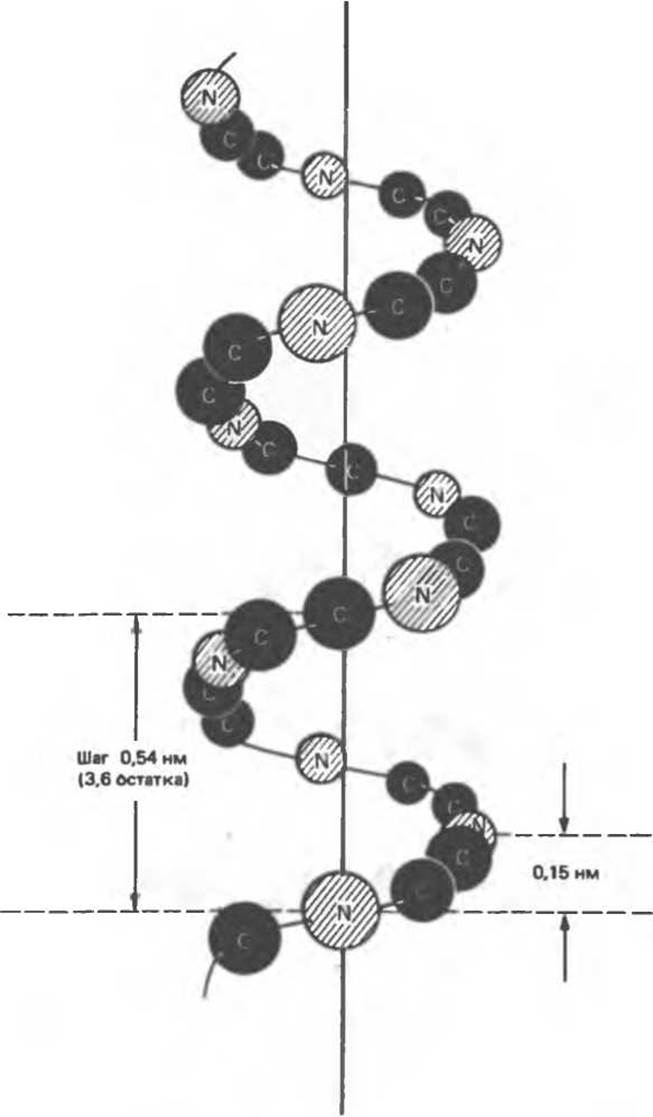
Рис. 5.3. Расположение атомов остова пептидной цепи относительно оси а-спирали.
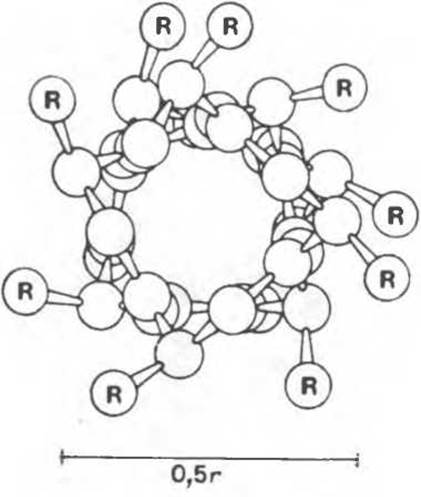
Рис. 5.4. Вид а-спирали сверху. R — боковые цепи, выступающие из спирали. Вандерваальсовы радиусы атомов значительно больше, чем это представлено на рисунке, по-этому внутри спирали почти не остается свободного пространства. (Воспроизведено с небольшими изменениями из книги Stryer L. Biochemistry, 2nd ed.. Freeman, 1981. Имеется перевод: Страйер Л. Биохимия. В 3-х т.— М: Мир, 1985.)
1. а-Спираль стабилизируется водородными связями между атомом водорода, присоединенным к атому азота пептидной группы, и карбонильным кислородом остатка, отстоящего от данного вдоль цепи на четыре позиции.
2. В образовании водородной связи участвуют все пептидные группы. Это обеспечивает максимальную стабильность а-спирали.
3. В образование водородных связей вовлечены все атомы азота и кислорода пептидных групп, что в значительной мере снижает гидрофильность а- спиральных областей (и увеличивает их гидрофобность).
4. а-Спираль образуется самопроизвольно и является наиболее устойчивой конформацией полипептидной цепи, отвечающей минимуму свободной энергии.
5. В цепи из L-аминокислот правая спираль, обычно обнаруживаемая в белках, намного стабильнее левой.
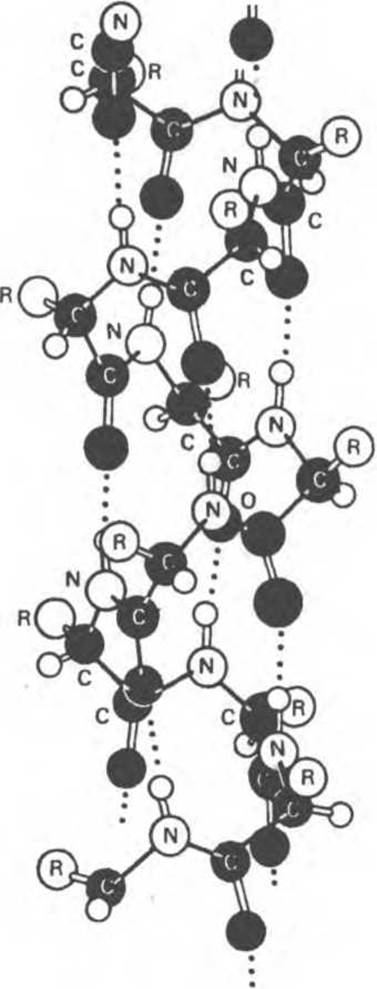
Рис. 5.5. Структура а-спирали. а-Спиральная конформация во многом определяется характером R-групп и стабилизируется водородными связями между атомами Н и О (показаны пунктирными линиями). (Воспроизведено с разрешения из книги Haggis G. Н. et al., Introduction to Molecular Biology. Wiley. 1964.)
Некоторые аминокислоты препятствуют свертыванию цепи в а-спираль, и в месте их расположения непрерывность а-спирали нарушается. К ним относятся пролин (в нем атом азота служит частью жесткой кольцевой структуры, и вращение вокруг связи N — Са становится невозможным), а также аминокислоты с заряженными или объемными R-группами, которые электростатически или механически препятствуют формированию а-спирали (табл. 5.3).
Складчатый ß-слой
Полинг и Кори предложили и другую упорядоченную структуру — складчатый ß-слой (обозначение ß указывало, что предложенная ими структура является второй после а-спирали). В то время как в а-спирали полипептидная цепь находится в конденсированном состоянии, в складчатом ß-слое цепи почти полностью вытянуты (рис. 5.6). В тех случаях, когда соседние полипептидные цепи складчатого ß-слоя идут в противоположных направлениях (за положительное принимается направление от N- к С-концу), структуру называют антипараллельным складчатым ß-слоем (она изображена на рис. 5.6). Когда соседние цепи идут в одном направлении, структуру ß-слоя называют параллельной (на рисунке не показана).
Таблица 5.3. Влияние различных аминокислот на формирование а-спирали
|
Способствуют |
Дестабилизируют |
Препятствуют |
|
Ala |
Arg |
Pro |
|
Asn |
Asp |
Hyp |
|
Cys |
Glu |
|
|
Gln |
Gly |
|
|
His |
Lys |
|
|
Leu |
Ile |
|
|
Met |
Ser |
|
|
Phe |
Thr |
|
|
Irp |
||
|
Туr |
||
|
Val |
Области складчатой ß-структуры имеются во многих белках, причем встречается и параллельная, и антипараллельная форма. В формировании таких структур могут участвовать от двух до пяти соседних полипептидных цепей. На рис. 5.7 представлен участок молекулы рибонуклеазы, в котором складчатая ß-структура образована тремя участками полипептидной цепи. Во многих белках одновременно имеются и а-спирали, и складчатая ß-структура (рис. 5.7).
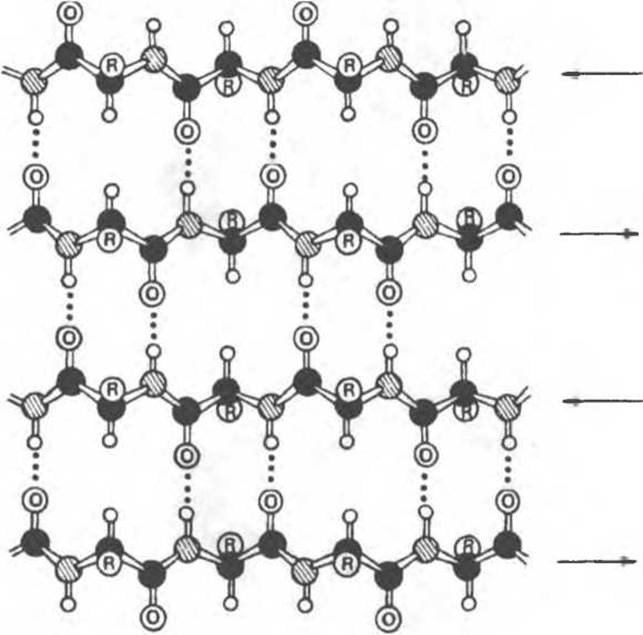
Рис. 5.6. Антипараллельный складчатый ß-слой. Направление соседних цепей взаимно противоположно. Структуру стабилизируют водородные связи между NH- и СО-группами соседних цепей. Боковые группы (R) располагаются выше или ниже плоскости слоя. Черные кружки — атомы углерода, серые — атомы азота, светлые — атомы водорода. (Из книги Stryer L. Biochemistry, 2nd cd., Freeman, 1981, с изменениями.)
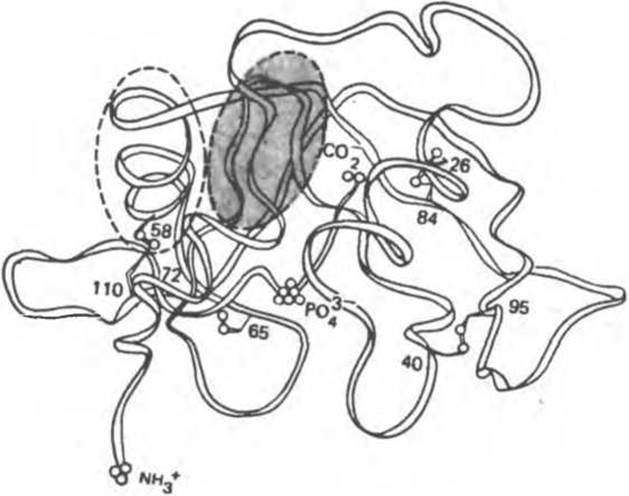
Рис. 5.7. Схематическое изображение укладки цепи в молекуле бычьей панкреатической рибонуклеазы — единой последовательности из 124 остатков. Структура стабилизирована четырьмя поперечными дисульфидными связями. Область а-спирали выделена овальным пунктирным контуром, область складчатого слоя затенена. Другие части структуры имеют нерегулярную конформацию. Локализацию активного центра (гл. 8) указывает ион РO3-4. (Из работы Kartha G., Bello J., Harker D.: Tertiary structure of ribonuclease. Nature 1967:213:862.) Этот белок удалось синтезировать чисто химическим путем.
В а-спирали стабилизирующие водородные связи образуются между пептидными группами, отстоящими одна от другой вдоль цепи на четыре остатка, а складчатая ß-структура формируется благодаря образованию водородных связей между пептидами, удаленными по цепи намного дальше. Это обстоятельство также иллюстрирует рис. 5.7.
Неупорядоченная конформация (клубок)
Те участки белковой молекулы, которые не относятся к спиральным или складчатым структурам, обычно называют неупорядоченными. Как показано на рис. 5.7, в такой конформации может находиться значительная часть белковой молекулы. Термин «неупорядоченный» не вполне удачен: создается впечатление, что это указывает на меньшую биологическую значимость таких участков по сравнению с высокоупорядоченными периодическими. В то же время с точки зрения биологической функции неупорядоченные, нерегулярные участки столь же важны, как и а-спирали и складчатые ß-слои.