Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Белки: миоглобин и гемоглобин
Миоглобин
Биологическая функция миоглобина
Миоглобин содержится в красных мышцах и участвует в запасании кислорода. В условиях кислородного голодания (например, при сильной физической нагрузке) кислород высвобождается из комплекса с миоглобином и поступает в митохондрии мышечных клеток, где осуществляется синтез АТР (окислительное фосфорилирование; см. гл. 13).
Первичная структура и распределение аминокислот
Миоглобин состоит из единичной полипептидной цепи с мол. массой 17000; никаких особенностей в характере составляющих его 153 аминокислотных остатков не обнаруживается. При анализе же их пространственного распределения четко выявляется одна особенность: на поверхности молекулы находятся полярные остатки, а внутри структуры — неполярные; это свойство характерно для глобулярных белков. Остатки, содержащие одновременно и полярные, и неполярные группы (например, Thr, Тrр и Туr), расположены так, что неполярные группы ориентируются внутрь глобулы. Если не считать двух остатков гистидина, принимающих участие в связывании кислорода, то внутренние области миоглобина содержат только неполярные остатки (например, Leu, Val, Phe, Met).
Вторичная и третичная структура миоглобина
Как показывает рентгеноструктурный анализ, миоглобин представляет собой компактную, примерно сферическую молекулу размером 4,5 ж 3,5 ж 2,5 нм (рис. 6.3). Примерно 75% остатков образуют восемь правых а-спиралей, содержащих от 7 до 20 остатков. Начиная с N-конца, спирали обозначают буквами от А до Н. Участки, соединяющие спирали, обозначают двумя буквами, указывающими соответствующие спирали. Индивидуальным остаткам присваивают букву, указывающую спираль, в которой они находятся, и порядковый номер, отсчитываемый от N-конца спирали. Например, His F8 — восьмой остаток в спирали F, им является гистидин. Остатки, далеко отстоящие друг от друга вдоль цепи (например, принадлежащие разным спиралям), могут быть пространственно сближены; например, довольно близко находятся остатки гистидина F8 (проксимальный) и Е7 (дистальный) (рис. 6.3).
Ряд данных свидетельствует о том, что в растворе вторичная и третичная структуры миоглобина близки к структуре кристаллического миоглобина. В обоих случаях наблюдаются практически идентичные спектры поглощения; кристаллический миоглобин связывает кислород; содержание а-спиралей в растворе, оцениваемое по дисперсии оптического вращения и круговому дихроизму, сходно с данными, полученными методом рентгеноструктурного анализа.

Рис. 6.3. Модель молекулы миоглобина. Контуры — это очертания, наблюдаемые при низком разрешении. Изображены в основном только атомы а-углерода и гем. (Из статьи Dickerson R. Е. In: The Proteins, 2nd ed., Vol. 2. Neurath H. (editor). Academic Press, 1964, с любезного разрешения.)
Влияние гема на конформацию миоглобина
При понижении pH до 3,5 образуется апомиоглобин (миоглобин, не содержащий гема), и содержание а-спиралей резко падает, а последующее добавление мочевины к апомиоглобину при нейтральном pH приводит к почти полному их исчезновению. Последующее удаление мочевины диализом и добавление гема полностью восстанавливает число а-спиралей, а добавление Fe2+ приводит к полному восстановлению биологической (кислородсвязывающей) активности. Таким образом, информация, содержащаяся в первичной структуре апомиоглобина, в присутствии гема однозначно детерминирует свертывание молекулы белка с образованием нативной, биологически активной конформации. Это важное положение распространяется и на другие белки: первичная структура белка определяет его вторичную и третичную структуру.
Пространственная ориентация атома железа, проксимального и дистального остатков гистидина в молекуле миоглобина
Гем в молекуле миоглобина расположен в щели между спиралями Е и F; его полярные пропионатные группы ориентированы к поверхности глобулы, а остальная часть находится внутри структуры и окружена неполярными остатками, за исключением His F8 и His F7. Пятое координационное положение атома железа занято атомом азота гетероциклического кольца проксимального гистидина His F8 (рис. 6.4). Дистальный гистидин (His Е7) расположен по другую сторону гемового кольца, почти напротив His F8, но шестое координационное положение атома железа His Е7 остается свободным (рис. 6.4).
Расположение атома железа
В неоксигенированном миоглобине атом железа на 0,03 нм выступает из плоскости кольца в направлении His F8. В оксигенированном миоглобине атом кислорода занимает шестое координационное положение атома железа, а сам атом железа выступает из плоскости гема только на 0,01 нм. Таким образом, оксигенирование миоглобина сопровождается смещением атома железа и, следовательно, His F8 и ковалентно связанных с ним остатков в направлении плоскости кольца; в результате эта область белковой глобулы принимает новую конформацию.
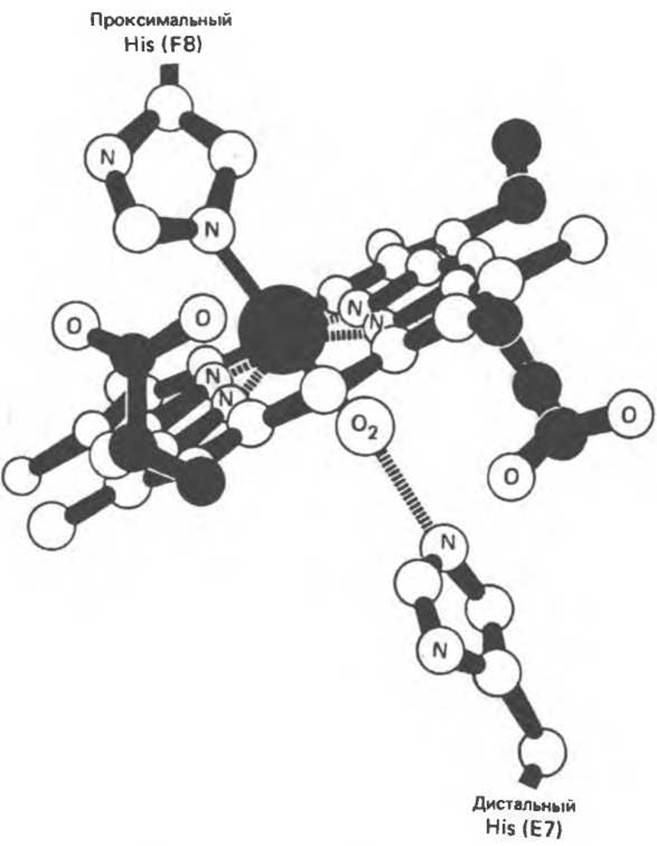
Рис. 6.4. Положение молекулы кислорода в геме после оксигенирования. Изображены также имидазольные кольца двух важных остатков гистидина в глобиновой цепи, которые располагаются рядом с атомом железа. (Из работы Harper Н. A. et al., Physiológische Chemie. Springer-Verlag, 1975, с любезного разрешения.)
Лиганды
Связь, образующаяся между атомом кислорода и атомом Fe2+, при оксигенировании миоглобина направлена перпендикулярно плоскости кольца гема. Второй атом кислорода удален от дистального гистидина, и связь между атомами кислорода образует относительно плоскости гема угол 121° (рис. 6.5).

Рис. 6.5. Предпочтительные ориентации молекул кислорода и окиси углерода, связанных с атомом железа изолированного гема (темные полоски).
Окись углерода (СО) связывается с изолированным гемом примерно в 25 000 раз более прочно, чем кислород. Поскольку атмосферный воздух содержит следы СО и еще небольшое количество СО образуется в ходе нормального. катаболизма гема, возникает вопрос: почему же шестое координационное положение железа в миоглобине занято не СО, а молекулой О2? Связано это со стеримескими ограничениями, возникающими в миоглобине. Молекула СО, связываясь с гемом, стремится принять такую ориентацию, при которой все три атома (Fe, С, О) находятся вдоль линии, перпендикулярной плоскости кольца гема (рис. 6.6). Для изолированного гема такая ориентация вполне возможна, но в миоглобине связыванию СО в такой ориентации стерически препятствует дистальный гистидин (рис. 6.6). Поэтому СО связывается в менее благоприятной конфигурации, что понижает прочность связи СО с гемом более чем на два порядка, так что она становится всего лишь в 200 раз прочнее, чем связь гем — О2. Тем не менее небольшая часть молекул миоглобина (около 1%) в нормальных условиях связывает СО.
Кинетика оксигенирования миоглобина
Почему миоглобин неспособен транспортировать кислород, но зато эффективно его запасает? Количество кислорода, связывающегося с миоглобином («процент насыщения»), зависит от концентрации кислорода в среде, непосредственно окружающей молекулу белка (эту концентрацию выражают как РО2 —парциальное давление кислорода). Зависимость между количеством связанного кислорода и РО2 можно представить графически в виде кривой насыщения миоглобина кислородом (кривой диссоциации кислорода). Для миоглобина изотерма адсорбции кислорода имеет форму гиперболы (рис. 6.7).
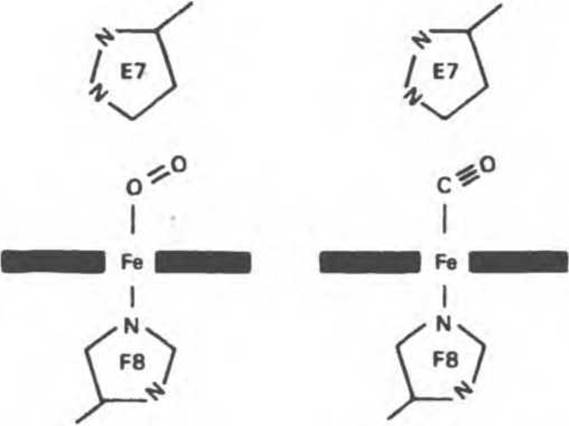
Рис. 6.6. Ориентация молекул кислорода и окиси углерода, связанных с атомом железа гема в составе миоглобина. Дистальный гистидин Е7 препятствует связыванию СО в предпочтительной для этой молекулы ориентации — под углом 90° к плоскости гемового кольца.
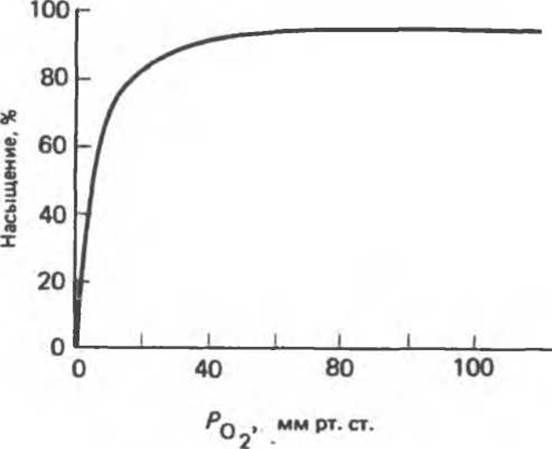
Рис. 6.7. Кривая насыщения миоглобина кислородом.
РО2 в ткани, окружающей легочные капилляры, составляет 100 мм рт. ст., поэтому миоглобин в легких мог бы весьма эффективно насыщаться кислородом. В венозной крови РО2 равно 40 мм рт. ст., а в активно работающей мышце — около 20 мм рт. ст. Но даже при парциальном давлении 20 мм рт. ст. степень насыщения миоглобина кислородом будет весьма значительной, и поэтому миоглобин не может служить средством его доставки от легких к периферическим тканям. Однако при кислородном голодании, которым сопровождается тяжелая физическая работа, РО2 в мышечной ткани может понизиться и до 5 мм рт. ст.; при столь низком давлении миоглобин легко отдает связанный кислород, обеспечивая тем самым окислительный синтез АТР в митохондриях мышечных клеток.