Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: общие свойства
«Трехточечная фиксация» субстратов на ферментах
Большинство субстратов образует по меньшей мере три связи с ферментом. Благодаря такой «трехточечной фиксации» симметричная молекула может проявлять асимметрию. Чтобы это пояснить, представим область фермента, связывающую субстрат, как участок плоской поверхности (хотя, как мы вскоре увидим, субстратсвязывающая «площадка» фермента редко бывает плоской, а возможно, и не бывает совсем). На рис. 7.3 молекула субстрата представлена в виде атома углерода с заместителями, три из которых взаимодействуют с тремя точками на плоском участке поверхности фермента. Если молекула субстрата может подойти к этому участку только с одной стороны и взаимодействовать могут только комплементарные структуры субстрата и фермента (в реальных ферментах оба этих условия соблюдаются), то молекула субстрата может связываться с ферментом единственным способом, даже если группы 1 и 3 идентичны. Перебирая мысленно все возможные пространственные ориентации молекулы субстрата, мы можем убедиться, что с тремя точками плоской поверхности (с одной и той же стороны) молекула может связаться только в одной ориентации. Отсюда следует, что группы 1 и 3, хотя они и идентичны, при связывании с ферментом становятся неэквивалентными из-за различия в их окружении. Химические изменения будут происходить только с группой 1, но не с группой 3 (или наоборот). Обобщая эти рассуждения, мы можем объяснить теперь, почему ферментативное восстановление оптически неактивного пирувата приводит к образованию именно L-, а не D, L-лактата.
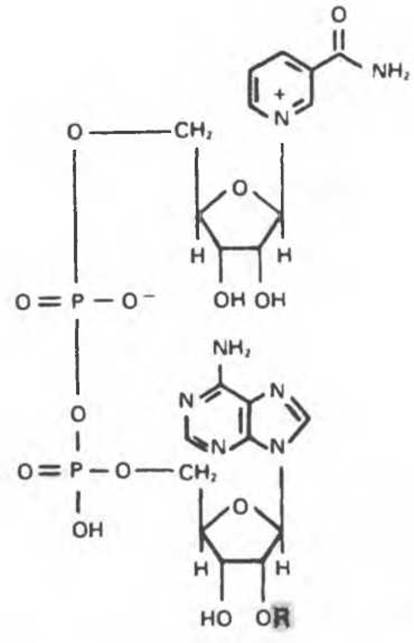
Рис. 7.2. NAD(P)+; R = Н (в случае NAD+) или -ОРО2-3(в случае NADP+).
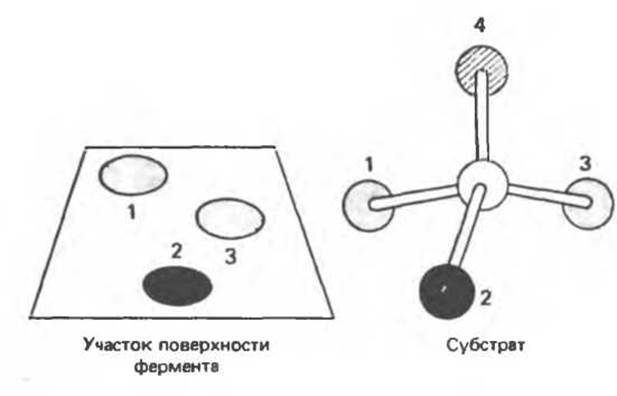
Рис. 7.3. «Трехточечная фиксация» субстрата на плоском активном центре фермента.