Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: общие свойства
Количественное определение ферментативной активности
Ферменты в отличие от органических или неорганических веществ присутствуют в клетках в чрезвычайно малых количествах, и определение их содержания в тканевых экстрактах или жидкостях представляет особую проблему. К счастью, весьма чувствительные и специфичные методы оказалось возможным создать на основе определения каталитической активности ферментов.
Чтобы оценить количество фермента в пробе тканевого экстракта или биологической жидкости, измеряют скорость реакции, катализируемой содержащимся в этой пробе ферментом. При определенных условиях измеряемая скорость пропорциональна количеству присутствующего фермента. Поскольку при этом трудно определить число молекул фермента в пробе или их общую массу, результаты выражают в условных единицах активности фермента. Далее сравнивают относительные количества фермента в различных экстрактах. Единицы активности удобнее всего выражать в микромолях (мкмоль, 10-6 моль), наномолях (нмоль, 10-9 моль) или пикомолях (пмоль, 10-12 моль) израсходованного субстрата или образовавшегося продукта за единицу времени (в минуту). Соответствующие международные единицы активности ферментов обозначаются μU, nU или pU.
Пример количественного анализа ферментативной активности; определение содержания дегидрогеназы
При измерении скоростей реакций, протекающих с участием NAD+ или NADP+ (реакции катализируются дегидрогеназами), можно воспользоваться тем обстоятельством, что NADH и NADPH (но не NAD+ и NADP+) поглощают свет с длиной волны 340 нм (рис. 7.4).
Окисление NADH в NAD+ (или обратный процесс) сопровождается изменением оптической плотности (D) растворов при 340 нм, и при определенных условиях скорость изменения D оказывается пропорциональна активности фермента (рис. 7.5).
Для получения калибровочной кривой (рис. 7.6) строят график зависимости скорости изменения оптической плотности (наклона прямых на рис. 7.5) от объема добавленного ферментного препарата. Количество фермента, присутствующего в исследуемом растворе, можно найти по наблюдаемой скорости изменения D при 340 нм.
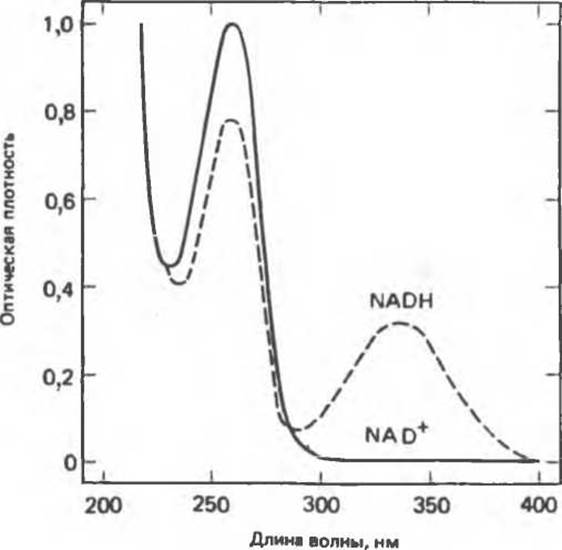
Рис. 7.4. Спектры поглощения NAD+ и NADH. Концентрация растворов 44 мг/л, длина оптического пути 1 см. Аналогичные спектры имеют NADP+ и NADPH соответственно.
Сопряженный ферментный анализ
В предыдущем примере оценка ферментативной активности основывалась на измерении скорости образования продукта (NADH). Скорость образования продукта (или, реже, скорость расходования субстрата) можно использовать для определения активности не только дегидрогеназ, но и других ферментов. Конкретный метод количественной оценки диктуется физико-химическими свойствами продукта или субстрата. Во многих случаях бывает удобно подвергать образовавшийся продукт реакции действию дегидрогеназы, для которой этот продукт является субстратом (рис. 7.7).
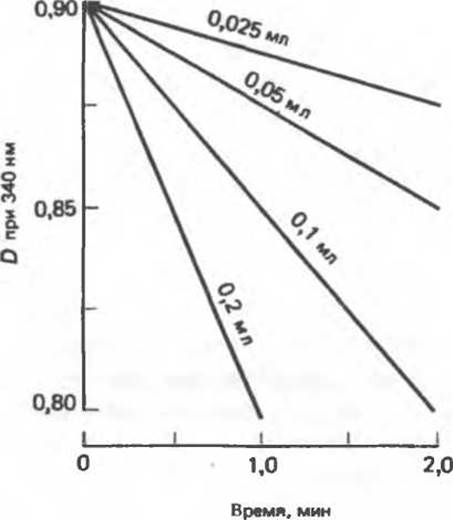
Рис. 7.5. Принцип измерения активности NADH- или NADPH-зависимой дегидрогеназы. Измеряют скорость изменения оптической плотности при 340 нм. обусловленного превращением восстановленного кофермента в окисленную форму. В кювету добавляют окисленный субстрат (S). восстановленный кофермент и буфер и регистрируют поглощение при 340 нм. Вначале наблюдается высокая оптическая плотность из-за сильного поглощения NADH (или NADPH). При добавлении 0,025-0,2 мл стандартного раствора фермента оптическая плотность понижается.
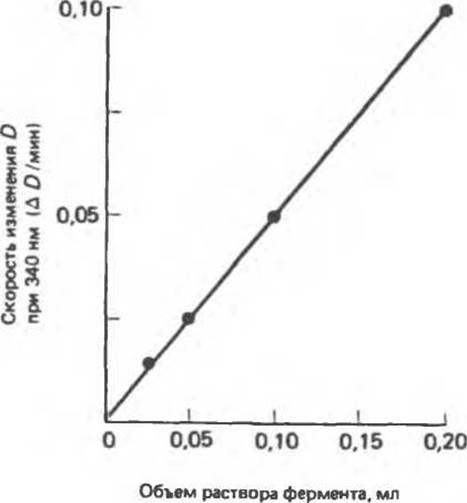
Рис. 7.6. Калибровочная кривая для определения количества фермента. По оси ординат отложен тангенс угла наклона прямых, приведенных на рис. 7 5, по оси абсцисс — количество фермента
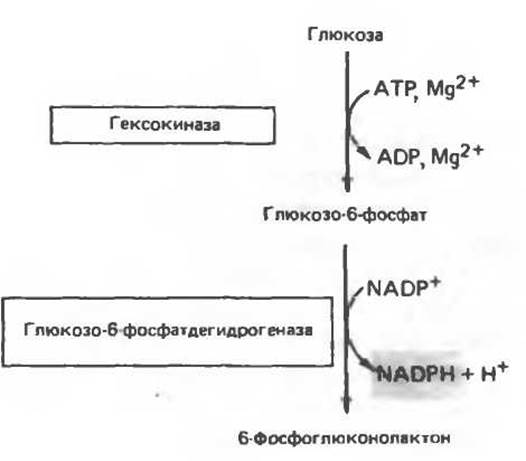
Рис. 7.7. Определение активности гексокиназы в системе, в которой протекает сопряженная ферментативная реакция, катализируемая глюкозо-6-фосфатдегидрогсназой. Глюкозо-6-фосфат дегидрогеназа, глюкоза, ATP, Mg2+ и NADP+ добавлены в избытке. В этих условиях скорость общей сопряженной реакции зависит от количества добавленной гексокиназы. Эту скорость определяют по образованию NADPH, который поглощает свет при 340 нм.