Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: общие свойства
Изоферменты (изозимы)
Когда мы говорим «малатдегидрогеназа» или «глюкозо-6-фосфатаза», то обычно имеем в виду конкретный белок, обладающий форментативной активностью, однако в действительности эти наименования охватывают все белки, катализирующие окисление малата в оксалоацетат или гидролиз глюкозо-6-фосфата с образованием глюкозы и Рi. В частности, после выделения малатдегидрогеназы из различных источников (печени крысы, Е. coli) обнаружилось, что ферменты из печени и фермент из Е. coli, катализирующие одну и ту же реакцию, различаются во многих отношениях по своим физическим и химическим свойствам. Физически различимые формы ферментов, обладающие одним и тем же видом каталитической активности, могут присутствовать в разных тканях одного организма, в разных типах клеток одной ткани и даже в прокариотическом организме, например в Е. coli. Это открытие было сделано благодаря применению электрофоретических методов разделения белков, в результате чего были обнаружены электрофоретически разные формы определенной ферментативной активности.
Термин «изофермент» («изозим») охватывает все вышеупомянутые физически различимые белки с данной каталитической активностью, однако на практике, и особенно в клинической медицине, его употребляют в более узком смысле, подразумевая физически различимые и поддающиеся разделению формы данного фермента, присутствующие в различных типах клеток данного эукариотического организма, например человека. Изозимы неизменно обнаруживаются в сыворотке и в тканях всех позвоночных, насекомых и в одноклеточных организмах. При этом число ферментов и их содержание сильно варьируют. Известны изоферментные формы дегидрогеназ, оксидаз, трансаминаз, фосфатаз, трансфосфорилаз и протеолитических ферментов. В различных тканях могут находиться разные изоферменты, и эти изоферменты могут иметь неодинаковое сродство к субстратам.
Диагностическое значение изозимов
Медицинский интерес к изозимам возник после того, как было обнаружено, что сыворотка человека содержит несколько изозимов лактатдегидрогеназы и что их относительное содержание значительно изменяется при определенных патологических состояниях. Впоследствии было выявлено много других случаев изменения относительного содержания изозимов при разных заболеваниях.
Изозимы сывороточной лактатдегидрогеназы обнаруживаются после электрофореза при pH 8,6 на крахмальном, агаровом или полиакриламидном гелях. При указанном значении pH изозимы несут разный заряд и распределяются на электрофореграмме в пяти разных местах. Далее изозимы можно обнаружить благодаря их способности катализировать восстановление бесцветных красителей в нерастворимую окрашенную форму.
Типичный набор реагентов для обнаружения изозимов дегидрогеназы включает:
1) восстановленный субстрат (например, лактат);
2) кофермент (NAD+);
3) краситель в окисленной форме (например, голубая нитротетразолиевая соль);
4) переносчик электронов от NADH к красителю [например, феназинметасульфат (ФМС)];
5) буфер; активирующие ионы (если требуются).
Лактатдегидрогеназа катализирует перенос двух электронов и одного иона Н+ от лактата к NAD+ (рис. 7.8). Если электрофореграмму опрыскать приведенной выше смесью и затем инкубировать при 37°С, то реакция сопряженного переноса электронов будет протекать только в тех местах, где присутствует лактатдегидрогеназы (рис. 7.9). Относительную плотность окраски полос можно далее оценить количественно с помощью сканирующего фотометра (рис. 7.10). Изозим с наибольшим отрицательным зарядом обозначают I1.
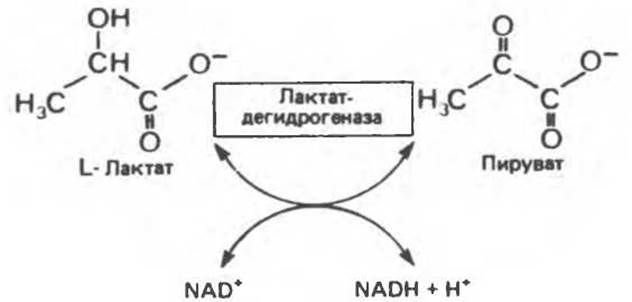
Рис. 7.8. Реакция, катализируемая L-лактатдегидрогеназой.
Физическая природа изозимов
Олигомерные ферменты, образованные разными протомерами, могут быть представлены несколькими формами. Часто определенная ткань продуцирует преимущественно один из протомеров. Если активный олигомерный фермент (например, тетрамер) может быть построен из таких протомеров в различных комбинациях, то образуются изозимы.
Изозимы лактатдегидрогеназы различаются на уровне четвертичной структуры. Олигомерная молекула лактатдегидрогеназы (мол. масса 130000) состоит из четырех протомеров двух типов, Н и М (оба с мол. массой около 34000). Каталитической активностью обладает только тетрамерная молекула. Если порядок соединения протомеров не имеет значения, то протомеры могут быть скомпонованы пятью способами:

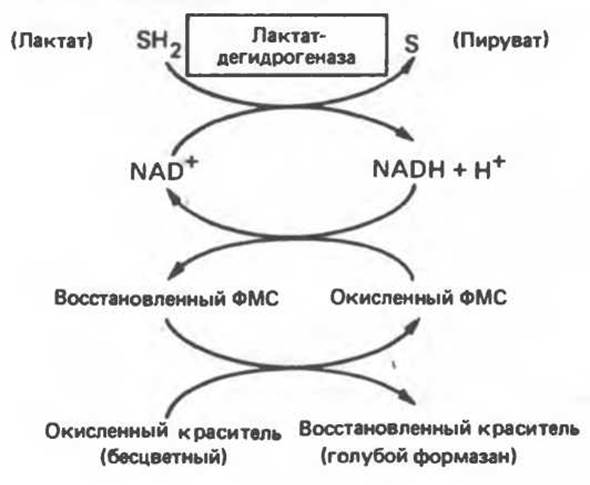
Рис. 7.9. Локализация лактатдегидрогеназы на электрофореграмме с использованием системы сопряженных реакций.
Маркерт подобрал условия для разрушения и реконструкции четвертичной структуры и сумел выяснить взаимоотношения между изозимами лактатдегидрогеназы. Расщепление и реконструкция лактатдегидрогеназ I1 и I5 не приводят к образованию новых изозимов. Следовательно, эти два изозима содержат только один тип протомеров. Когда такой же процедуре была подвергнута смесь лактатдегидрогеназ I1 и I5, появились также формы I2, I3 и I4. Соотношение изозимов соответствует приведенному ниже субъединичному составу:

Синтез Н- и М-субъединиц детерминируется разными генетическими локусами, и они по-разному экспрессируются в разных тканях (например, в сердечной и скелетной мышцах).