Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: кинетика
Роль ферментов в разрыве и образовании ковалентных связей
Большинство химических реакций, представляющих биохимический интерес, сопряжено с разрывом или образованием ковалентных связей. Рассмотрим, например, реакцию переноса, о которой говорилось в гл. 7:
D - G + A ⇄ A - G + D,
в которой группа G переносится с донора, D — G, на акцептор А. Полная реакция включает как разрыв связи D — G, так и образование новой связи, А — G. Однако если реакция переноса катализируется ферментом, ее лучше записывать следующим образом:

Такое ее представление подчеркивает три важных признака ферментативных реакций переноса групп.
1. Каждая полуреакция сопровождается и разрывом, и образованием ковалентной связи.
2. Фермент является равноправным реагентом, таким же как D — G и А.
3. В то время как в полной реакции фермент выполняет функцию катализатора (т. е. он требуется лишь в следовых количествах и возвращается в исходное состояние по окончании реакции), в каждой из полуреакций фермент выступает как стехиометрический реагент (т. е. реагирует с другими реагентами в молярном отношении 1:1).
Многие другие биохимические реакции можно рассматривать как частные случаи реакций переноса, в которых отсутствуют либо А, либо D, либо оба реагента. Так, реакцию изомеризации (например, взаимопревращение глюкозо-6-фосфата и глюкозо-1-фосфата) можно представить как реакцию переноса, в которой отсутствуют D и А:

В таком представлении, однако, теряется из виду еще одно ключевое свойство ферментативных реакций — участие в полной реакции двух и более форм комплекса Enz — S и последовательное протекание нескольких стадий реакции. Для того чтобы отразить это свойство, реакцию переноса можно представить в следующем виде:
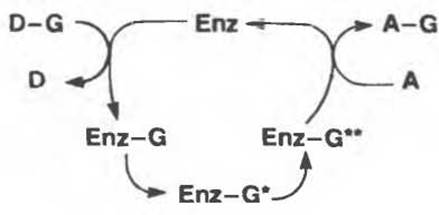
где Enz — G, Enz — G* и Enz — G** — формы комплекса Enz — S, последовательно образующиеся в ходе полной реакции.
Из всего сказанного выше ясно, что для протекания реакции необходимо, чтобы все участвующие в ней реактанты сближались на расстояния, достаточные для образования (или для разрыва) связей, т. е. сталкивались друг с другом. В химии гомогенных растворов концентрация реагирующих молекул в отсутствие катализаторов считается постоянной во всем растворе. Однако в присутствии катализатора это условие перестает соблюдаться. Для эффективной работы катализатор должен иметь на своей поверхности участки связывания реагирующих молекул. Такое связывание представляет собой обратимый процесс, однако равновесие сильно сдвинуто в сторону образования комплекса. Качественно это можно представить следующим образом:
Реактант + Катализатор ⇄ Комплекс реактанта с катализатором.
Прочность комплекса реактанта R и катализатора С можно охарактеризовать количественно с помощью константы диссоциации комплекса R — С (Кd)
или константы равновесия реакции:
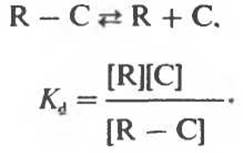
Таким образом, чем прочнее комплекс R — С, тем меньше Кd.
Отсюда мы получаем одно важное следствие: связывание реактанта с катализатором приводит к заметному повышению локальной концентрации реагента по сравнению с его концентрацией во всем растворе.
Таким образом, мы переходим из области химии гомогенных растворов в область химии гетерогенных растворов.
Если катализатор биомолекулярной реакции (идущей с участием двух реактантов) связывает оба реактанта, то локальная концентрация каждого из них повышается, причем степень этого повышения зависит от сродства катализатора к данному реактанту (Kd). Как мы увидим ниже, скорость бимолекулярной реакции
А + В → А — В
пропорциональна концентрации обоих реактантов, А и В, поэтому связывание А и В с катализатором может приводить к чрезвычайно большому (в несколько тысяч раз) увеличению скорости реакции.
Одним из ключевых факторов, позволяющих ферменту служить катализатором, является его способность эффективно связывать один или (чаще) оба реактанта, участвующие в бимолекулярной реакции, что приводит к повышению локальной концентрации реактантов и, следовательно, к локальному повышению скорости реакции. То обстоятельство, что ферменты по сравнению с большинством небелковых катализаторов необычайно эффективны и высокоизбирательны, требует дальнейшего объяснения. Чтобы понять эти отличительные свойства ферментов, мы должны ввести понятие активного, или каталитического, центра1.
1 Во многих руководствах понятия «активный центр» и «каталитический центр» рассматриваются как синонимы, однако некоторые ферменты имеют дополнительные «активные центры», предназначенные для регуляции активности фермейта и непосредственно не связанные с химическими превращениями на различных стадиях каталитического процесса. Поэтому, чтобы избежать неоднозначности, мы используем термин «каталитический центр».