Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: кинетика
Ингибирование активности ферментов
Различают два больших класса ингибиторов ферментативной активности — конкурентные и неконкурентные — на основании того, ослабляется (конкурентное ингибирование) или не ослабляется (неконкурентное ингибирование) их ингибирующее действие при повышении концентрации субстрата. На практике многие ингибиторы не проявляют тех свойств, которые характерны для чисто конкурентного или чисто неконкурентного ингибирования. Другой способ классификации ингибиторов основывается на характере места их связывания. Одни из них связываются с ферментом в том же месте, что и субстрат (в каталитическом центре), а другие — на значительном расстоянии от активного центра (в аллостерическом центре).
Конкурентное ингибирование аналогами субстрата
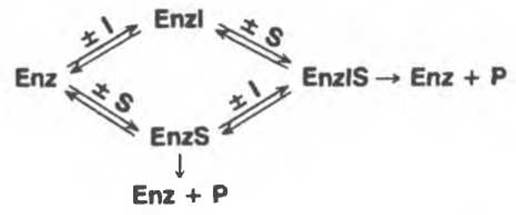
Классическое конкуретное ингибирование основано на связывании ингибитора с субстратсвязывающим (каталитическим) центром. Химическая структура аналога субстрата, действующего как ингибитор (I), обычно сходна со структурой субстрата (S). Поэтому ингибитор может обратимо связываться с ферментом, образуя вместо Enz—S комплекс Enz—I, т.е. фермент-ингибиторный комплекс. Когда в реакционной смеси одновременно присутствуют и субстрат, и ингибитор указанного типа, они конкурируют за один и тот же связывающий центр на поверхности фермента. Один из наиболее подробно изученных примеров конкурентного ингибирования — это ингибирование сукцинатдегидрогеназы малонатом (I), конкурирующим за один и тот же центр с субстратом сукцинатом (S).
Сукцинатдегидрогеназа катализирует образование фумарата в результате отщепления атома водорода от каждого из двух а-углеродных атомов сукцината (рис. 8.19). Малонат (ООС—СН2—СОО) способен связываться с дегидрогеназой, образуя комплекс Enz—I. От Са-атома малоната отщепления атома водорода произойти не может. Комплекс Enz—I может только распадаться на свободный фермент и ингибитор. Для этой обратимой реакции
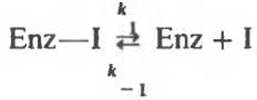
константа равновесия Кi равна
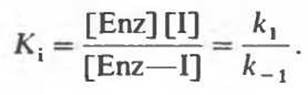
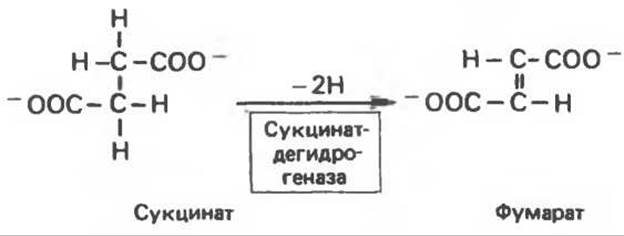
Рис. 8.19. Сукцинатдегидрогеназвая реакция.
Действие конкурентных ингибиторов можно представить в виде следующих реакций:

Скорость образования продукта — обычно именно она является объектом измерения — зависит только от концентрации комплекса Enz—S. Предположим, что I очень прочно связывается с ферментом (Кi мала). Тогда количество свободного фермента (Enz), который мог бы присоединять S, образуя комплекс Enz—S, а затем и Enz + Р, будет весьма мало. Таким образом, скорость реакции (образования Р) будет мала. По аналогичным причинам при той же концентрации слабо связывающегося ингибитора (Кi велика) катализируемая реакция существенно не замедлится. Предположим теперь, что при фиксированной концентрации ингибитора 1 добавляется все большее количество субстрата S. Это повышает вероятность образования комплекса Enz—S по сравнению с комплексом Enz—I. С ростом отношения [Enz—S]/[Enz—I] будет расти и скорость реакции. При достаточно высокой концентрации S концентрация комплекса Enz—I станет исчезающе мала. Но тогда скорость катализируемой реакции будет такой же, что и в отсутствие I (рис. 8.20).
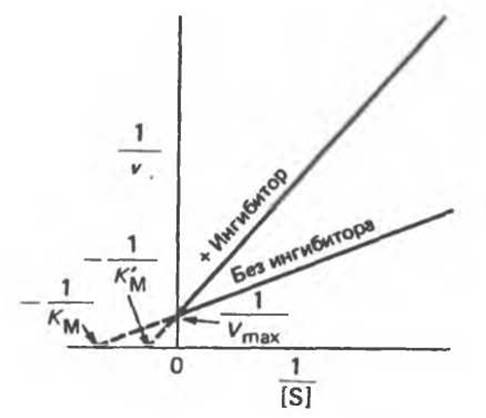
Рис. 8.20. График Лайнуивера — Бэрка для случая классического конкурентного ингибирования. Обратите внимание на полное отсутствие ингибирующего действия при высоких значениях [S] (низких значениях (1/[S]).
Графическая оценка констант конкурентного ингибирования
На рис. 8.20 приведен типичный случай конкурентного ингибирования, представленный в форме графика Лайнуивера—Бэрка. Скорость реакции (v) измеряется при разных значениях концентрации S и при фиксированной концентрации ингибитора. Прямые, проведенные через экспериментальные точки, пересекаются в одной и той же точке на оси у. Длина отрезка, отсекаемого от оси у, равна 1/Vmах; это означает, что при бесконечно большой концентрации S (1/[S) = 0) v будет такой же, что и в отсутствие ингибитора. Однако длина отрезка, отсекаемого от оси x (а эта величина определяет значение KМ), в присутствии ингибитора уменьшается (-1/К'м < -1/Км). Таким образом, конкурентный ингибитор повышает кажущееся значение Км (К'м) для субстрата. Для простого конкурентного ингибирования длина отрезка, отсекаемого от оси х, будет равна
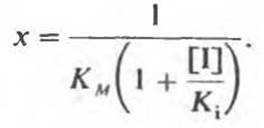
Определив КM в отсутствие I, можно найти из этого уравнения Кi. Если концентрация добавленного 1 значительно превышает концентрацию фермента, то можно считать [I] равной концентрации добавленного ингибитора. Значения Кi для ряда аналогов субстрата (конкурентных ингибиторов) показывают, какой из них наиболее эффективен. Ингибиторы с наименьшими Ki даже при малых концентрациях могут оказывать сильное ингибирующее действие.
Многие лекарственные препараты, широко применяющиеся в клинике, действуют как конкурентные ингибиторы очень важных ферментов, функционирующих как в микробных, так и в животных клетках.
Обратимое неконкурентное ингибирование
Как следует уже из самого названия, в этом случае конкуренция между S и I отсутствует. При этом ингибитор обычно ничем не напоминает S и, как можно предположить, связывается с другим участком фермента. Обратимые неконкурентные ингибиторы понижают максимальную скорость, достижимую при данном количестве фермента (понижают Vmax), но, как правило, не влияют на Км. Поскольку I и S связываются с разными центрами, возможно образование как комплекса Enz—I, так и комплекса Enz—IS. Комплекс Enz—IS тоже распадается с образованием продукта, однако с меньшей скоростью, чем Enz—S; поэтому реакция будет замедляться, но не остановится. Таким образом, могут протекать cледующие конкурентные реакции:
На рис. 8.21 представлена зависимость 1/v от 1/[S] в присутствии и в отсутствие ингибитора (предполагается, что связывание I не приводит к существенным изменениям в работе активного центра).
Необратимое неконкурентное ингибирование
Ферментативная активность может уменьшаться в присутствии многих «ядов», таких, как иодацетамид, ионы тяжелых металлов (Ag+, Hg2+), окисляющие агенты и т.д. В присутствии одного или нескольких субстратов или продуктов скорость инактивации фермента может снижаться. Тот кинетический анализ, о котором здесь шла речь, может оказаться недостаточным для того, чтобы отличить действие ферментных ядов от действия неконкурентных обратимых ингибиторов. Обратимое неконкурентное ингибирование встречается сравнительно редко. К сожалению, оно не всегда выявляется, поскольку и обратимое, и необратимое неконкурентное ингибирование характеризуются сходной кинетикой.
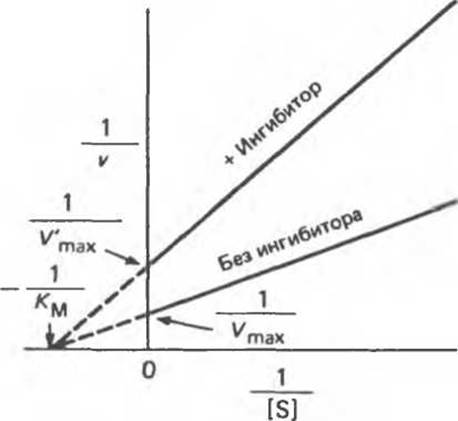
Рис. 8.21. График Лайнуивера—Бэрка для случая обратимого неконкурентного ингибирования.