Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: механизм действия
Роль избирательного протеолиза в формировании активных центров ферментов
Превращение прохимотрипснна в химотрипсин
Прохимотрипсин — это полипептид, состоящий из 245 аминокислотных остатков. Его превращение в активный фермент, а-химотрипсин, начинается с протеолитического разрыва, приводящего к образованию каталитически активного п-химотрипсина (п-ХТ), который далее протеолитически расщепляется еще в трех местах (рис. 9.6).
В а-химотрипсине цепи А, В и С (рис. 9.6) остаются связанными друг с другом двумя межцепочечными дисульфидными связями (рис. 9.7).
Проферменты
Многие белки синтезируются и секретируются в форме неактивных белков-предшественников, которые называют пробелками. В тех случаях, когда белки являются ферментами, пробелки называют проферментами или зимогенами. Превращение про белка в зрелый белок осуществляется путем избирательного протеолиза. В пробелке происходит один или несколько последовательных протеолитических разрывов, после чего появляется характерная для зрелого белка активность (например, ферментативная). К числу белков, синтезируемых в виде пробелков, относятся гормон инсулин (его пробелком является проинсулин), пищеварительные ферменты пепсин, трипсин и химотрипсин (пробелки — пепсиноген, трипсиноген и химотрипсиноген), несколько факторов каскадных систем свертывания крови и растворения кровяного сгустка (см. гл. 55), белок соединительной ткани коллаген (пробелок — проколлаген).
Почему некоторые белки секретируются в неактивной форме? Дело в том, что есть два типа белков. Одни из них необходимы практически постоянно, надобность же в других (например, ферментах, участвующих в образовании и растворении кровяного сгустка) возникает лишь эпизодически. Однако когда в этих, в норме отсутствующих, ферментах возникает реальная потребность, они оказываются необходимыми немедленно. Некоторые физиологические процессы, например пищеварение, тоже не идут непрерывно, но они более или менее регулярны и предсказуемы (правда, у первобытного человека это могло быть и не так). В других случаях (например, при образовании кровяного сгустка, при его растворении или при восстановлении поврежденной ткани) физиологические процессы являются непосредственной реакцией на внезапно возникшие физиологические потребности организма или патологические состояния. Понятно, что процессы образования кровяного сгустка и его растворения должны быть скоординированы, чтобы был достигнут гемостаз. Наконец, следует указать, что синтез протеаз в виде каталитически неактивных предшественников защищает ткани, в которых они синтезируются (например. ткань поджелудочной железы), от самопереваривания (такое самопереваривание наблюдается при панкреатите).
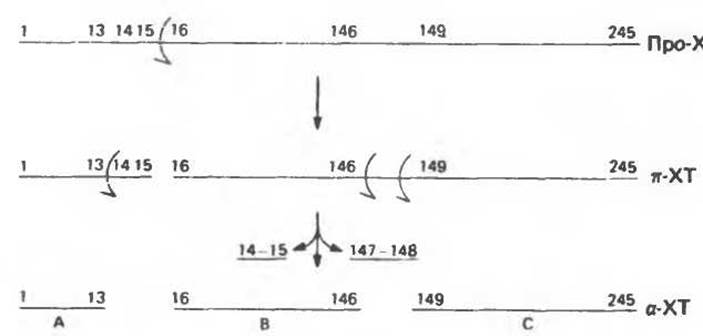
Рис. 9.6. Схема превращения прохимотрипсина (про-ХТ) в п-химотрипсин (п-ХТ) и далее в зрелый, каталитически активный а-химотрипсин (а-ХТ).
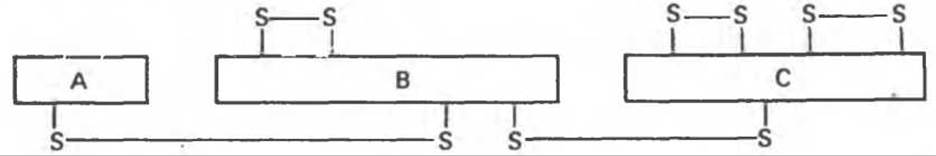
Рис. 9.7. Схема внутри- и межцепочечных дисульфидных связей в а-химотрипсине (а-ХТ).
Синтез новых белков, потребность в которых обусловливается патологическими факторами (например, потерей крови), может осуществляться довольно быстро. Однако для этого необходимо, чтобы имелся соответствующий и достаточно полный пул аминокислот; кроме того, процесс секреции может оказаться слишком медленным, чтобы удовлетворить внезапно возникшую физиологическую потребность в том или ином белке.
Рассмотрим общие принципы превращения пробелка в зрелую, физиологически активную форму.
1. Процесс включает избирательный протеолиз, в некоторых случаях он сводится к осуществлению единственного протеолитического разрыва.
2. Полипептидные продукты могут далее функционировать как индивидуальные молекулы или же могут оставаться ассоциированными друг с другом в зрелой форме белка.
3. Процесс может (но необязательно) сопровождаться значительными изменениями молекулярной массы.
4. Главным следствием избирательного протеолиза является изменение конформации молекулы.
5. Если пробелок превращается в фермент, то указанные выше конформационные изменения играют важную роль в формировании каталитического центра фермента. В этом смысле избирательный протеолиз профермента можно рассматривать как процесс запуска конформационных изменений, обеспечивающих формирование каталитического центра.
Обратите внимание, что остатки His 57 и Asp 102 находятся в составе В-пептида а-химотрипсина, тогда как Ser 195 — в С-пептиде (рис. 9.6). Таким образом, избирательный протеолиз прохимотрипсина (химотрипсиногена) обеспечивает сближение трех остатков, участвующих в переносе заряда. Этот пример наглядно показывает, как с помощью избирательного протеолиза может формироваться каталитический центр. Следует еще отметить, что каталитические остатки и остатки субстратсвязывающего центра, попадая в разные полипептидные цепи, тем не менее оказываются на таких расстояниях друг от друга, при которых они могут взаимодействовать с субстратом.