Биохимия человека Том 2 - Марри Р. 1993
Структура, функция и репликация информационных макромолекул
Метаболизм пуриновых и пиримидиновых нуклеотидов
Пиримидины
Биосинтез пиримидинов
Структура ядра пиримидинов проще и путь их биосинтеза короче, чем у пуринов. В то же время оба пути имеют ряд общих предшественников. ФРПФ, глутамин, СО2 и аспартат необходимы для синтеза всех пиримидиновых и пуриновых нуклеотидов. Синтез тимидиновых нуклеотидов, а также всех пуриновых нуждается в присутствии производных тетрагидрофолата. Можно отметить одно существенное различие в путях биосинтеза пуриновых и пиримидиновых нуклеотидов. В первом случае синтез начинается с молекулы рибозофосфата как интегральной части будущей молекулы предшественника нуклеотида, во втором случае сначала синтезируется пиримидиновое основание и только на последних стадиях присоединяется остаток рибозофосфата.
Синтез пиримидинового кольца (рис. 35.15) начинается с образования карбамоилфосфата из глутамина, АТР и СО2 в реакции, катализируемой в цитозоле карбамоилфосфатсинтазой (реакция 1). Отметим, что карбамоилфосфатсинтаза, ответственная за ранние стадии синтеза мочевины, локализована в митохондриях.
Первый уникальный для биосинтеза пиримидинов этап — образование карбамоиласпартата в реакции конденсации карбамоилфосфата и аспартата катализируется аспартаттранскарбамоилазой (реакция 2). Затем в реакции, катализируемой дигидрооротазой, выщепляется Н2О и образуется кольцевая структура (реакция 3).
На следующем этапе происходит дегидрогенирование под действием дигидрооротатдегидрогеназы с использованием NAD в качестве кофактора, при этом образуется оротовая кислота (реакция 4).
В реакции 5 к оротовой кислоте присоединяется остаток рибозофосфата с образованием оротидилата (оротидинмонофосфат, ОМР). Этот процесс осуществляется оротат-фосфорибозилтрансферазой — ферментом, аналогичным гипоксантин-гуанин — фосфорибозилтрансферазе и аденин-фосфорибозилтрансферазе, которые участвуют в фосфорибозилировании пуриновых колец.
Первый истинный пиримидиновый рибонуклеотид — уридилат (уридинмонофосфат, UMP) образуется при декарбоксилировании оротидилата (реакция 6). Таким образом, только на предпоследней стадии образования UMP происходит фосфорибозилирование гетероцикла.
Дигидрооротатдегидрогеназа — митохондриальный фермент. Все остальные ферменты, участвующие в синтезе пиримидинов de novo, локализуются в цитозоле.
Фосфорилирование пиримидиновых нуклеозидмонофосфатов до соответствующих ди- и трифосфатов происходит аналогично тому, как это описано для пуриновых нуклеозидмонофосфатов (реакции 7—12). UTP аминируется до СТР; в реакции участвуют глутамин и АТР (реакция 9). Механизм восстановления пиримидиннуклеозиддифосфатов до соответствующих 2'-дезоксинуклеозиддифосфатов (реакция 10) также аналогичен тому, который описан для пуриновых нуклеозиддифосфатов (рис. 35.6 и 35.13).
Образование тимидилата (тимидинмонофоcфат; ТМР) (реакция 12) — единственная реакция на пути биосинтеза пиримидиновых нуклеотидов, требующая участия производного тетрагидрофолата в качестве донора одноуглеродного фрагмента. 2'-Дезокси-UMP метилируется тимидилатсинтазой, использующей N5, N10-метилентетрагидрофолат как донор метильной группы. Метиленовая группа N5, N10-метилентетрагидрофолата в ходе реакции восстанавливается до метильной и присоединяется к атому С-5 dUMP. Процесс сопровождается окислением тетрагидрофолатного переносчика до дигидрофолата. Можно считать, что в результате метилирования dUMP с образованием ТМР происходит полное восстановление гидроксиметильной группы серина (переносимой на тетрагидрофолат при образовании N5, N10-метилентетрагидрофолата) до метильной с одновременным окислением тетрагидрофолата до дигидрофолата. Для того чтобы фолатный переносчик и далее мог функционировать, необходимо восстановить дигидрофолат до тетрагидрофолата. Эту реакцию катализирует дигидрофолатредуктаза. Именно поэтому делящиеся клетки, вынужденные синтезировать ТМР с образованием дигидрофолата, оказываются особенно чувствительны к ингибиторам дигидрофолатредуктазы. Один из таких ингибиторов — метотрексат (аметоптерин) широко используется как противоопухолевый препарат.
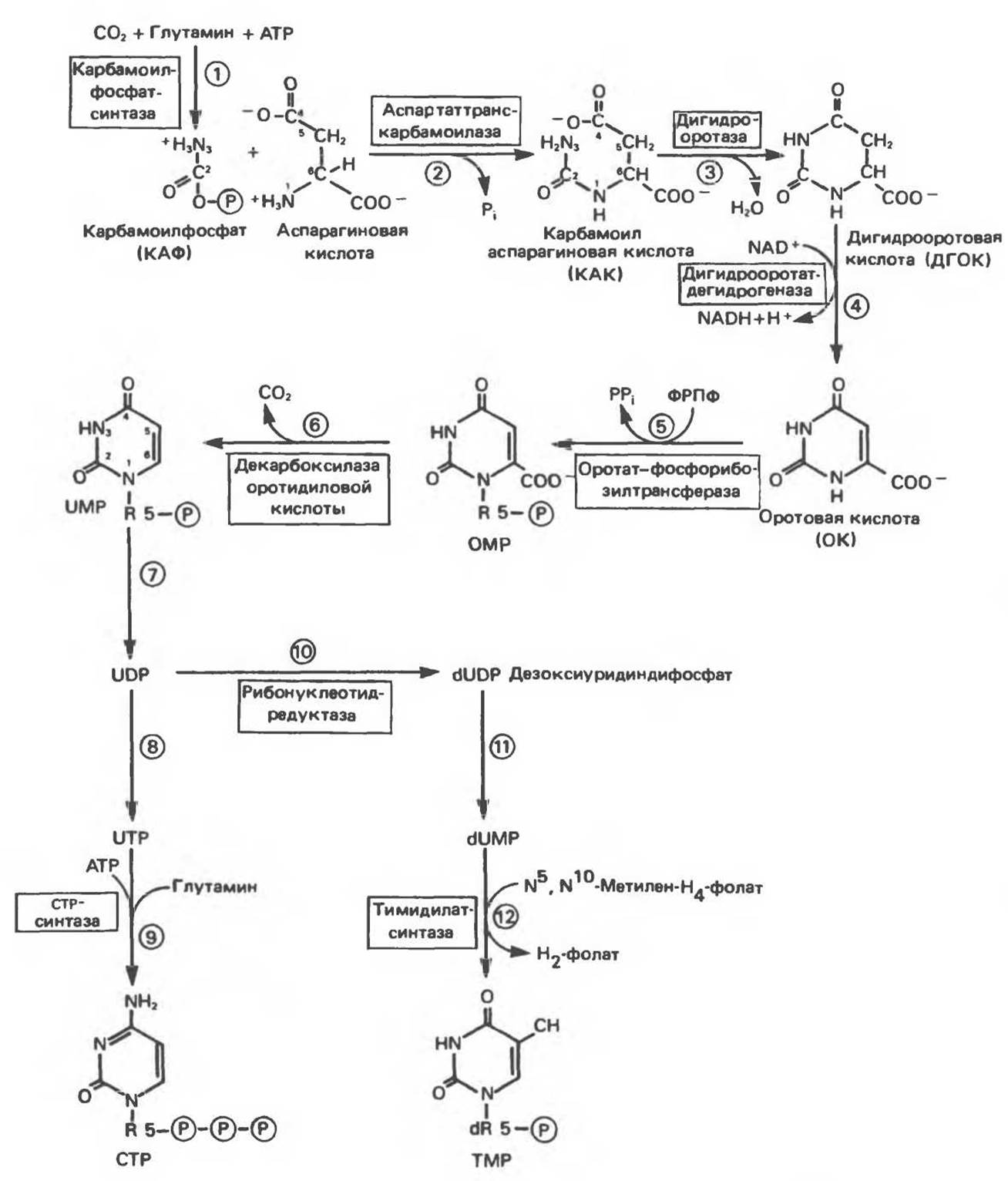
Рис. 35.15. Путь биосинтеза пиримидиновых нуклеотидов.
Пути регенерации пиримидиновых нуклеотидов
Клетки млекопитающих не располагают эффективными средствами использования свободных пиримидиновых оснований для синтеза нуклеотидов. В то же время они обладают способностью утилизировать пиримидиновые рубонуклеозиды уридин и цитидин, а также 2'-дезоксирибонуклеозиды тимидин и дезоксицитидин путем превращения их в соответствующие нуклеотиды (рис. 35.16). 2'-Дезоксицитидин фосфорилируется дезоксицитидининазой — ферментом, способным также фосфорилировать дезоксигуанозин и дезоксиаденозин.
Фермент оротат-фосфорибозилтрансфераза, необходимый для синтеза пиримидинов de novo, отвечает за фосфорибозилирование оротовой кислоты с образованием ОМР, хотя оротовая кислота, строго говоря, и не является истинным пиримидиновым основанием. Оротат-фосфорибозилтрансфераза не может использовать в качестве субстратов нормальные пиримидиновые основания, но способна фосфорибозилировать аллопуринол (4-гидроксипиразолопиримидин) до нуклеотидного производного, в котором рибозилфосфат присоединен к атому N-1 пиримидинового кольца этого лекарственного соединения. Противоопухолевый препарат 5-фторурацил также фосфорибозилируется этим ферментом.
Катаболизм пиримидинов
В результате катаболизма пиримидинов, протекающего в основном в печени, образуются хорошо растворимые конечные продукты (рис. 35.17). Именно этим они отличаются от конечных продуктов катаболизма пуринов (мочевая кислота и ее натриевая соль обладают слабой растворимостью). Выделение СО2, происходящего из уреидного углерода (С-2) пиримидинового кольца, представляет собой главный путь катаболизма урацила, цитозина и тимина. Основные конечные продукты катаболизма этих оснований — ß-аланин и ß-аминоизобутират.
Тимин выступает в роли предшественника ß-аминоизобутирата у человека и обычных лабораторных животных. Экскреция ß-аминоизобутирата увеличивается при лейкемии и после рентгеновского облучения, что, без сомнения, отражает ускорение гибели клеток и деструкцию их ДНК. Выделение аномально больших количеств ß-аминоизобутирата может наблюдаться и у здоровых во всех остальных отношениях людей. Этот признак наследуется как рецессивный и, следовательно, проявляется только у гомозигот по соответствующему аллелю. Примерно у 25% обследованных индивидов (японцев и китайцев по происхождению) обнаружено повышение уровня экскреции ß-аминоизобутирата. Сравнительно немного известно о механизме деградации ß-аминоизобутирата в организме человека. Фермент, катализирующий обратимое трансаминирование этого соединения, обнаружен в почках свиньи, ß-Аминоизобутират превращается в метилмалоновый полуальдегид, затем в пропионат, который в свою очередь преобразуется в сукцинат.
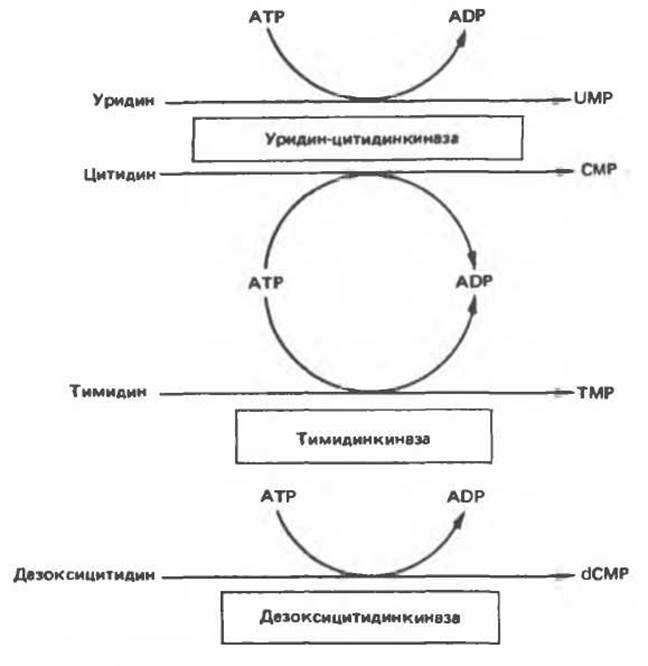
Рис. 35.16. Реакции образования пиримидиновых нуклеозидмонофосфатов из соответствующих пиримидиновых нуклеозидов, катализируемые нуклеозидкиназой.
Начальные стадии деградации пиримидиновых нуклеотидов, включающие этап отщепления углевод-фосфатного фрагмента по N-гликозидной связи, весьма напоминают обращенные последние стадии пути биосинтеза. Для псевдоуридина, образующегося in situ в результате внутренней перестройки, не существует механизма гидролиза или фосфоролиза до урацила. Соответственно этот необычный нуклеотид у здоровых индивидов экскретируется с мочой неизмененным.
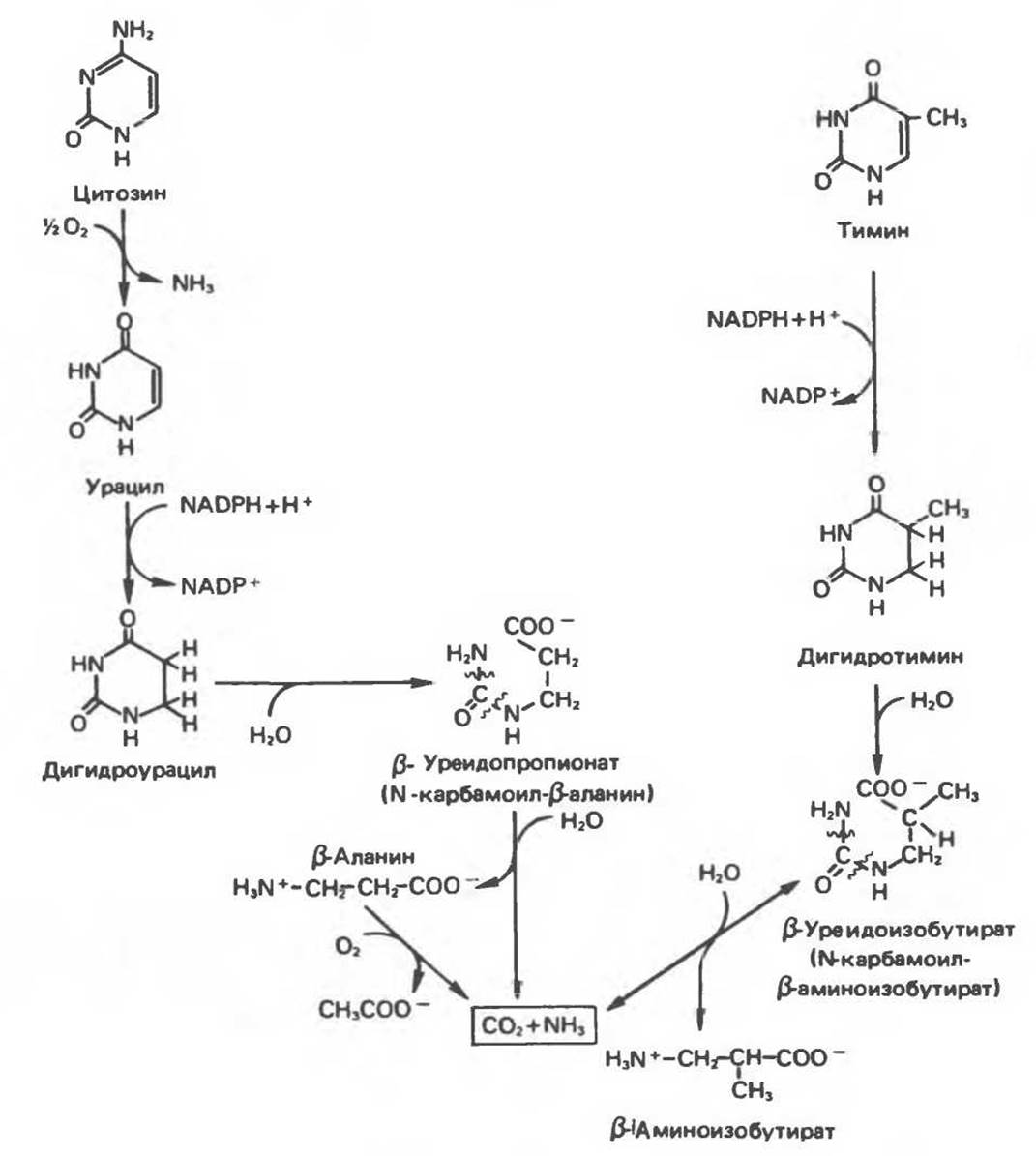
Рис. 35.17. Катаболизм пиримидинов.
Регуляция биосинтеза пиримидинов
Путь биосинтеза пиримидиновых нуклеотидов регулируется двумя различными механизмами. Активность первых двух ферментов находится под контролем аллостерических эффекторов. Кроме того, три первых и два последних фермента являются объектами координированной репрессии — дерепрессин. Карбамоилфосфатсинтаза ингибируется UTP, пуриновыми нуклеотидами, но активируется ФРПФ (рис. 35.18). Аспартаттранскарбамоилаза особенно чувствительна к ингибирующему влиянию СТР. Аллостерические свойства аспартаткарбамоилазы микроорганизмов явились предметом интенсивных и ставших уже классическими исследований механизмов аллостерической регуляции активности ферментов.
Скорость биосинтеза пиримидинов коррелирует со скоростью биосинтеза пуринов, что указывает на координированный контроль синтеза нуклеотидов обоих типов. ФРПФ-синтетаза — фермент, катализирующий образование предшественника обоих путей биосинтеза, — ингибируется по принципу обратной связи как пуриновыми, так и пиримидиновыми нуклеотидами. Карбамоилфосфатсинтаза также подвержена ингибированию по принципу обратной связи нуклеотидами обоих типов, а ФРПФ активирует этот фермент. Таким образом, на нескольких этапах биосинтеза пуриновых и пиримидиновых нуклеотидов осуществляется перекрестная регуляция.
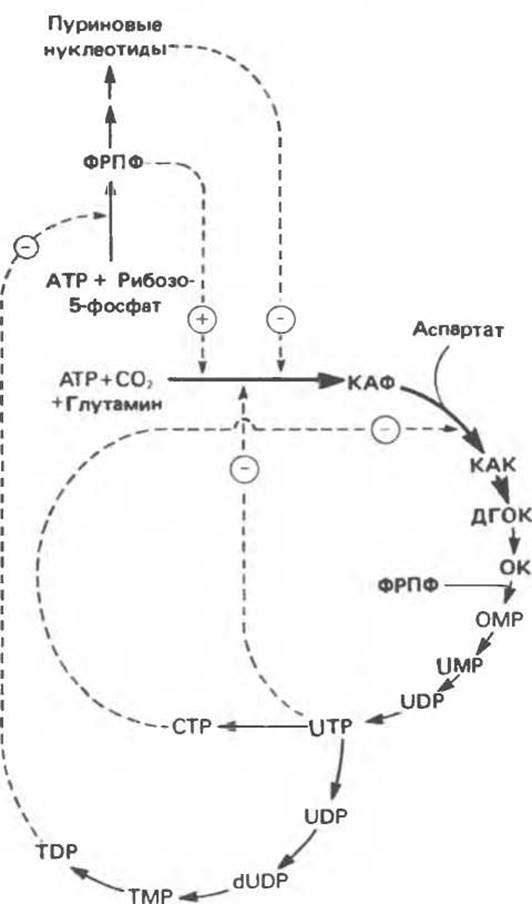
Рис. 35.18. Регуляция пути биосинтеза пиримидиновых нуклеотидов. Сплошные линии указывают путь химических превращений. Пунктирные линии обозначают положительную (⊕) и отрицательную (⊝) регуляцию по принципу обратной связи. Сокращения расшифрованы на рис. 35.15.