Биохимия человека Том 2 - Марри Р. 1993
Частные вопросы
Гликопротеины и протеогликаны
Протеогликаны и гликозаминогликаны - Функции гликозаминогликанов и протеогликанов
Связывание гликозоаминогликанов с другими внеклеточными макромолекулами вносит значительный вклад в структурную организацию соединительнотканного матрикса. Гликозоаминогликаны могут взаимодействовать с внеклеточными макромолекулами, белками плазмы, компонентами клеточной поверхности и внутриклеточными макромолекулами.
Связывание гликозаминогликанов имеет обычно электростатический характер, обусловленный их выраженной полианионной природой, однако некоторые реакции связывания являются более специфичными. В целом гликозаминогликаны, содержащие IdUA, такие, как дерматансульфат и гепарансульфат, связывают белки с большим сродством, чем содержащие GlcUA в качестве единственной уроновой кислоты.
Взаимодействие с внеклеточными макромолекулами
Все гликозаминогликаны, за исключением тех, в которых отсутствуют сульфатные (гиалуронат) или карбоксильные группы (кератансульфаты), при нейтральных значениях pH электростатически связываются с коллагеном. Присутствие IdUA способствует более прочному связыванию, и протеогликаны взаимодействуют с коллагеном сильнее, чем соответствующие гликозаминогликаны. С каждым коллагеновым мономером связывается от 2 до 5 полисахаридных цепей. Все растворимые коллагены (типы I, II и III) связывают хондроитинсульфатные протеогликаны.
Хондроитинсульфат и гепарансульфат специфически связываются с эластином.
Как отмечалось выше, хондроитинсульфатные и кератансульфатные цепи в составе соответствующих протеогликанов при посредстве связывающих белков образуют агрегаты с гиалуроновой кислотой. С одной молекулой гиалуроната может связываться до 100 протеогликановых молекул.
Взаимодействия с белками плазмы
В состав артериальной стенки входят протеогликаны, содержащие гиалуронат, хондроитинсульфат, дерматансульфат и гепарансульфат. Из них в связь с липопротеинами плазмы вступает дерматансульфат. Кроме того, дерматансульфат, по-видимому, является главным гликозаминогликаном, синтезируемым гладкомышечными клетками артерий. Поскольку именно эти клетки пролиферируют при атеросклеротических поражениях артерий, дерматансульфат может играть значительную роль в образовании атеросклеротических бляшек.
Хотя гепарин синтезируется и запасается в тучных клетках, он всегда тесно связан с кровеносными сосудами. В силу своего высокого отрицательного заряда (обусловленного остатками IdUA и сульфата) гепарин интенсивно взаимодействует с некоторыми компонентами плазмы. Он специфически связывает факторы свертывания крови IX и XI. Более важной для антикоагулянтной активности гепарина является его способность взаимодействовать с а2-гликопротеином плазмы, называемым антитромбином III. Стехиометрическое связывание с гепарином (1:1) значительно усиливает инактивирующее действие антитромбина III на сериновые протеазы, в частности на тромбин. Связывание гепарина с остатками Lys антитромбина III, по-видимому, вызывает конформационные изменения, благоприятствующие взаимодействию последнего с сериновыми протеазами. Эти процессы схематически изображены на рис. 54.13.
Имеющийся в продаже гепарин содержит 2 компонента — высокоаффинный и низкоаффинный, которые, вероятно, связываются с одной и той же областью молекул антитромбина III. Однако высокоаффинный гепарин обладает в 10 раз большей антикоагулянтной активностью, а также более высокой константой связывания, чем низкоаффинный. N-Десульфирование или модификация IdUA-остатков гепарина снижает его антикоагулянтную активность.
Гепарансульфат, сходный по структуре с гепарином, также обладает способностью ускорять действие антитромбина III, но по эффекту значительно уступает гепарину.
Гепарин может специфически связываться с липопротеинлипазой, присутствующей в стенке капилляров, и вызывать высвобождение этого фермента в кровоток. Сходным образом связывается с гепарином и поступает в кровоток печеночная липаза, но это связывание происходит с меньшим сродством, чем в случае липопротеинлипазы. Частично N- десульфированный гепарин связывается с липопротеинлипазой интенсивнее, чем с антитромбином III.
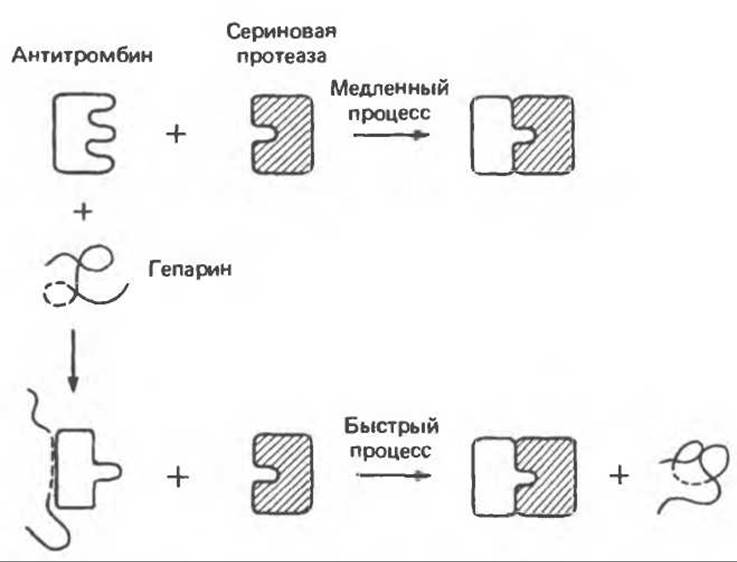
Рис. 54.13. Схематическое изображение процесса инактивации антитромбином сериновых протеаз (например, тромбина), участвующих в свертывании крови. Гепарин, по- видимому, ускоряет инактивацию, связываясь с антитромбином и вызывая в нем такие конформационные изменения, которые ускоряют взаимодействие антитромбина с тромбином. (Не исключено также связывание гепарина с тромбином.) Взаимодействие требует присутствия специфического связывающего центра (- - - - - - ) в полисахарид ной цепи. (Reproduced, with permission, from Lennarz W. J. The Biochemistry of Glycoproteins and Proteoglycans. Plenum Press, 1980.)
Гликозаминогликаны и молекулы клеточной поверхности
Гепарин обладает способностью связываться со многими типами клеток, включая тромбоциты, клетки эндотелия артерий и печеночные клетки. Хондроитинсульфат, дерматансульфат и гепарансульфат связываются с разными участками клеточной поверхности, например фибробластов. Именно в этих участках гликозаминогликаны и протеогликаны подвергаются деградации.
Гиалуронат откладывается клетками, растущими на пластиковых подложках. Кроме того, гиалуронат, по-видимому, участвует в процессах слипания клеток друг с другом, что играет столь важную роль в росте и развитии многоклеточных организмов.
Некоторые протеогликаны, вероятно, служат рецепторами и переносчиками макромолекул, в том числе липопротеинов, липаз и антитромбина. Протеогликаны могут принимать участие в регуляции роста клеток, в межклеточных взаимодействиях и защите рецепторов клеточной поверхности.
Гликозаминогликаны и внутриклеточные макромолекулы
Протеогликаны и их гликозаминогликановые компоненты кроме взаимодействия с ферментами, участвующими в их биосинтезе и деградации, оказывают влияние на синтез белка и внутриядерные функции. В частности, гепарин может действовать на структуру хроматина и активировать ДНК-полимеразу in vitro. В какой степени эти эффекты являются физиологическими, неясно. Гликозаминогликаны присутствуют в значительных количествах в ядрах различных типов клеток, и существуют данные, подтверждающие роль гепарансульфата в развитии эмбрионов морского ежа.
Хондроитинсульфаты, дерматансульфаты и гепарин могут активировать или ингибировать кислые гидролазы лизосом. Эти ферменты способны формировать природные комплексы с гликозаминогликанами с образованием защищенных или неактивных форм.
Многочисленные гранулы, служащие для запасания или секреции продуктов, такие, как хромаффинные гранулы мозгового слоя надпочечников, пролакгиновые секреторные гранулы гипофиза и базофильные гранулы тучных клеток, содержат сульфированные гликозаминогликаны. Гликозаминогликан-пептидные комплексы, присутствующие в этих гранулах, могут играть роль в высвобождении биогенных аминов.
Литература
Buckwalter J. A., Rosenberg L. С. Electron microscopic studies of cartilage proteoglycans, J. Biol. Chem., 1982, 257, 9830. DiNatale P., Neufeld E. F. The biochemical diagnosis of mucopolysaccharidoses, mucolipidosis and related disorders. In: Perspectives in Inherited Metabolic Diseases, Vol. 2, Barra B. et al. (eds.), Editiones Ermes (Milan), 1979.
Höök M. et al. Cell-surface glycosaminoglycans, Annu. Rev. Biochem., 1984, 53, 847.
Hubbard S. C., Ivatt R. J. Synthesis and processing of asparagine-linked oligosaccharides, Annu. Rev. Biochem., 1981, 50, 555.
Jagues L. B. Heparin: an old drug with a new paradigm. Science, 1979, 206, 528.
Kornfeld R., Kornfeld S. Assembly of asparagine-linked oligosaccharides, Annu. Rev. Biochem., 1985, 54, 631. Kornfeld S., Sly W. S. Lysosomal storage defects, Hosp. Pract. (Aug), 1985, 20, 71.
Lennarz W. J. The Biochemistry of Glycoproteins and Proteoglycans, Plenum Press, 1980.
Poole A. R. et al. Proteaglycans from bovine nasal cartilage: Immunochemical studies of link protein, J. Biol. Chem., 1980, 255, 9295.
Reitman M. L. et al. Fibroblasts from patients with I-cell disease and pseudo-Hurler polydystrophy are deficient in uridine 5'-diphosphate-N-acetylglucosamine: glycoprotein N- acetylglucosaminylphosphotranspherase activity, J. Clin. Invest., 1981, 67, 1574.
Schächter H. Biosynthetic controls that determine the branching and heterogeneity of protein-bound oligosaccharides, Biochem. Cell Biol., 1986, 64, 163.
Snider M. D., Rogers О. C. Transmembrane movement of oligosaccharide-lipids during glycoprotein synthesis, Cell, 1984, 36, 753.