Биохимия человека Том 2 - Марри Р. 1993
Частные вопросы
Рак, онкогены, факторы роста
Причины возникновения опухолей - Химические канцерогены
Канцерогенные свойства присущи целому ряду химических соединений (табл. 57.3); структура трех наиболее изученных веществ представлена на рис. 57.1. Канцерогенность большинства соединений, приведенных в табл. 57.3, доказана на лабораторных животных (грызунах и других). Полагают, что многие из них вызывают развитие опухолей и у человека. Подсчитано, что до 80% опухолей человека вызываются факторами окружающей среды, в основном химическими веществами. Контакт с такими соединениями может быть связан с профессиональной деятельностью человека (бензол, асбест), особенностями питания (например, канцероген афлатоксин В, продуцируемый плесневым грибком Aspergillus flavus, часто загрязняет арахис), образом жизни (курение). В некоторых случаях канцерогенными оказываются лекарственные препараты. Мы рассмотрим лишь некоторые важные выводы, сформулированные при исследовании химического канцерогенеза.
Структура
Канцерогенами могут быть как органические, так и неорганические молекулы (табл. 57.3). Разнообразие этих соединений свидетельствует о том, что канцерогенность не связана с какой-либо определенной структурной особенностью.
Действие
Наиболее полно изучено действие органических канцерогенов. Было обнаружено, что некоторые из них (например, горчичный газ и ß-пропиолактон) являются прямыми канцерогенами, т. е. непосредственно взаимодействуют с молекулами-мишенями. Другие соединения (проканцерогены) для проявления опухолеродной активности должны пройти ряд метаболических превращений. Катализируемый ферментами процесс перехода проканцерогенов в активные канцерогены называется метаболической активацией. Промежуточные продукты подобных реакций носят название промежуточных канцерогенов; конечный продукт, непосредственно реагирующий с компонентами клетки (например, с ДНК), называется конечным канцерогеном. Последовательность такова:
Проканцероген → промежуточный канцероген А → промежуточный канцероген Б → конечный канцероген.
Проканцероген сам по себе химически неактивен, а конечный канцероген, как правило, обладает высокой активностью. Для превращения проканцерогена 2-ацетиламинофлуорена (2-ААФ) в сульфатный эфир N-гидрокси-ААФ (конечный канцероген) требуются по меньшей мере две стадии. Важно отметить, что конечные канцерогены часто являются электрофилами (т. е. молекулами с дефицитом электронной плотности у определенных групп). Именно поэтому они имеют повышенное сродство к нуклеофильным (т.е. с избытком электронов) группам ДНК, РНК и белков.
Монооксигеназы и трансферазы
В метаболизме проканцерогенов и других ксенобиотиков принимают участие монооксигеназы и трансферазы. Ферменты, ответственные за метаболическую активацию проканцерогенов, являются в основном гем-содержащими монооксигеназами, локализованными в эндоплазматическом ретикулуме. Эти же ферменты метаболизируют и другие ксенобиотики, например лекарства и вещества, загрязняющие окружающую среду. Монооксигеназы катализируют гидроксилирование различных проканцерогенов и ксенобиотиков, при этом источником кислорода служит молекулярный кислород, a NADPH — восстановителем:
![]()
Поскольку один атом кислорода попадает в конечный продукт, другой — в молекулу воды, эти ферменты раньше называли оксидазами со смешанными функциями. Реакции гидроксилирования могут приводить к появлению активной или неактивной формы лекарств. Очевидно, что эти реакции играют центральную роль в метаболизме многих лекарственных препаратов. В эндоплазматическом ретикулуме клеток печени человека содержится по меньшей мере шесть монооксигеназ. Они имеют широкую, часто перекрывающуюся субстратную специфичность. Особая монооксигеназа, метаболизирующая полициклические ароматические углеводороды, называется цитохромом Р-448 или гидроксилазой ароматических углеводородов. Реакции, катализируемые рассмотренными монооксигеназами, носят название реакций первой фазы метаболизма ксенобиотиков; в результате таких реакций в соединение вводится гидроксильная группа и продукт оказывается более полярным, более подготовленным к последующей экскреции. Во второй фазе метаболизма ксенобиотиков гидроксилированные соединения конъюгируют с различными молекулами (например, с глюкуронатом, сульфатом, ацетатом, глутатионом). В результате реактивность соединений существенно понижается (детоксикация), еще более повышается их полярность, и они могут экскретироваться из организма (в основном с мочой). Иногда конъюгация приводит к повышению биологической или химической активности молекулы. Ферменты, катализирующие реакции конъюгации (глюкуронил-, сульфат-, ацетил-, глутатионтрансферазы), обычно локализуются в цитозоле, однако некоторые из них находятся также и в эндоплазматической сети. В качестве доноров глюкуронильных сульфатных и ацетильных групп трансферазы используют UDP-глюкуронат, 3'-фосфоаденозин-5'-фосфосульфат (ФАФС) и ацетил-СоА соответственно. Донором для различных глутатионтрансфераз служит сам глутатион.
Факторы, влияющие на ферменты, метаболизирующие ксенобиотики
На активность ферментов, участвующих в метаболизме ксенобиотиков влияют многие факторы: 1) активность ферментов может существенно варьировать у разных видов животных; 2) большой разброс в активности ферментов у особей одного вида связан, по-видимому, с генетическими факторами; 3) на активность ферментов влияет пол и возраст особи; 4) попадание в организм некоторых ксенобиотиков, например фенобарбитала или некоторых углеводородов, может повышать активность этих ферментов. Этот процесс носит название индукции фермента. Вдыхание во время беременности углеводородов, содержащихся в сигаретном дыме, приводит к индукции активности системы цитохрома Р-448 в плаценте; при этом меняется количество некоторых метаболитов углеводородов, с которыми контактирует плод; 5) активность ферментов, метаболизируюших ксенобиотики, могут ингибировать метаболиты ряда лекарств. Все эти факторы объясняют неодинаковую канцерогенность одних и тех же химических веществ для различных видов животных или для особей одного вида.
Ковалентное связывание
С помощью методики радиоактивного мечения установлено, что при введении химических канцерогенов животным (или при обработке ими клеток в культуре) происходит ковалентное связывание этих соединений или их метаболитов с клеточными макромолекулами (ДНК, РНК или белками). Исследована химическая природа продуктов, образующихся в результате взаимодействия некоторых конечных канцерогенов с их внутриклеточными мишенями. Наибольший интерес вызывают комплексы, образованные с ДНК. Было показано, что канцерогены реагируют с пуриновыми и пиримидиновыми основаниями, а также с фосфодиэфирными группами ДНК. Наиболее часто мишенью служит гуанин, при этом канцерогены присоединяются к N-2, N-3, N-7, 0-6 и 0-8 — атомам этого основания.
Повреждение ДНК
Ковалентное связывание прямых или конечных канцерогенов с ДНК может приводить к различного рода повреждениям ее молекулы. Часть этих повреждений клетка репарирует (см. гл. 38).
Несмотря на наличие систем репарации, некоторые модификации молекулы ДНК, вызванные химическими канцерогенами, могут сохраняться относительно длительное время. Возможно, именно они ведут к возникновению мутаций и развитию опухолей.
Мутагены
Большинство химических канцерогенов являются мутагенами. Для выявления мутационной активности разработано множество тестов. Во всех случаях было показано, что при обработке бактерий конечными канцерогенами происходит целый ряд мутаций, в том числе транзиции и трансверсии (см. гл. 38 и 40). Предполагалось, что именно они и служат причиной развития опухолей. В настоящее время получены экспериментальные подтверждения этой гипотезы (см. ниже «Онкогены»).
Тестирование канцерогенности химических соединений на лабораторных животных — процесс медленный и дорогостоящий. В связи с этим были разработаны системы скрининга, основанные на определении мутагенной активности; такие опыты непродолжительны и менее дороги, чем эксперименты по обнаруживанию канцерогенности. При скрининге потенциальных канцерогенов весьма эффективной оказалась методика, предложенная Эймсом. Она подразумевает использование ауксотрофного штамма Salmonella typhimurium, имеющего генотип His-. Такие бактерии не способны синтезировать гистидин, и его необходимо добавлять в культуральную среду. Если под действием канцерогена происходит мутация в сайте His-, бактерии приобретают способность расти на среде без гистидина. Клетка, несущая реверсию His-→ His+, даст начало колонии на агаре, не содержащем гистидина.
Следует отметить, что набор бактериальных монооксигеназ существенно меньше такового у высших животных. Вот почему, если химическое вещество требует активации для проявления канцерогенных или мутагенных свойств, это не всегда можно определить с помощью бактерий. Эймс обошел эту проблему, введя в тест стадию инкубации исследуемых веществ с постмитохондриальным супернатантом печени крыс (фракция S-9). Фракцию получают центрифугированием гомогената печени крыс при 9000 g. Она содержит большую часть различных монооксигеназ и других ферментов, активирующих потенциальные мутагены и канцерогены.
Благодаря методике Эймса идентифицировано 90% известных на сегодняшний день канцерогенов. Именно она используется в настоящее время при тестировании вновь синтезированных химических веществ. Соединения, продемонстрировавшие мутагенную активность по методике Эймса, анализируют на животных.
Инициация и промотирование
В некоторых органах (например, в коже и печени) процесс канцерогенеза можно разделить на две стадии. Рассмотрим классический пример. Определенный участок кожи у группы мышей однократно обрабатывают бензпиреном. Если не произвести дополнительной обработки, опухоль кожи не развивается (рис. 57.2). Если же вслед за бензпиреном на кожу несколько раз нанести кротоновое масло, развивается множество опухолей. Обработка кожи одним лишь кротоновым маслом (без предварительного нанесения бензпирена) не приводит к появлению опухолей. Используя эту методику, были проведены разнообразные опыты, на основании которых можно сделать ряд выводов: 1) стадия канцерогенеза, вызываемая в данном случае нанесением бензпирена на кожу, носит название инициации; эта стадия является быстрой и необратимой. Суть ее, по-видимому, заключается в том, что на данном этапе происходят необратимые модификации молекул ДНК, приводящие к одной или нескольким мутациям. Бензпирен в этом случае называют инициирующим агентом; 2) вторая, гораздо более медленная (длящаяся месяцы и годы) стадия канцерогенеза (в нашем случае — результат обработки кротоновым маслом) называется промотированием. Кротоновое масло, таким образом, выступает здесь в роли промотирующего агента (промотора); 3) большинство канцерогенных веществ способны действовать и как инициирующие факторы, и как промоторы.
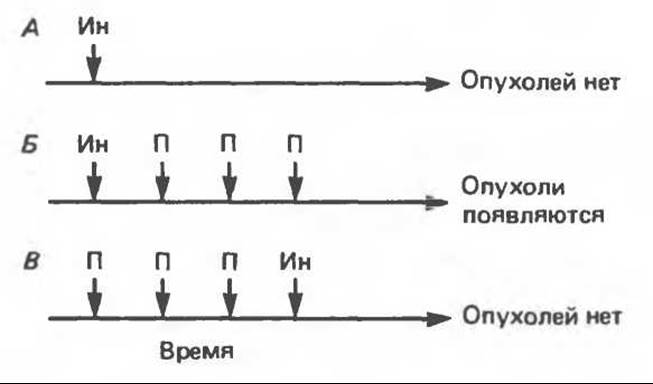
Рис. 57.2. Схематическое изображение стадий инициации и промотирования в процессе химического канцерогенеза в коже. А. Кожа нескольких мышей однократно обрабатывается инициатором (например, бензпиреном). Б. Вслед за обработкой инициатором следуют с недельным интервалом три обработки промотором (кротоновым маслом). В. Сначала кожу обрабатывают промотором, а затем инициатором. Доброкачественные опухоли кожи (папилломы) могут появляться уже через 100 дней; злокачественные опухоли (карциномы) появляются примерно через 1 год. Было проведено множество вариантов данного эксперимента, все они подтверждают основные концепции инициации и промотирования. И — инициатор; П — промотор.
Целый ряд соединений, в том числе фенобарбитал и сахарин, может играть роль промоторов в различных органах. Активное начало кротонового масла — смесь форболовых эфиров, а наиболее активный среди них — 12-О-тетрадеканоилфорбол-13-ацетат (ТФА), вызывающий целый ряд эффектов. Наиболее интересными оказались данные, согласно которым протеинкиназа С может служить рецептором ТФА. Повышение активности фермента в результате взаимодействия с ТФА может вызвать фосфорилирование ряда мембранных белков, что в свою очередь ведет к изменению транспорта и других функций клеток. Этот важный результат позволяет связать действие некоторых опухолевых промоторов с их влиянием на трансмембранную передачу сигналов (см. ниже «Факторы роста»). Многие опухолевые промоторы изменяют экспрессию генов; однако механизмы, с помощью которых промоторы превращают «инициированные» клетки в опухолевые, остаются пока невыясненными.
Роль ДНК
Основная клеточная мишень, ответственная за процесс канцерогенеза, — ДНК. В пользу такого вывода говорит целый ряд фактов: 1) опухолевые клетки производят себе подобное клеточное потомство. Это значит, что изменения, приводящие к возникновению опухолей, передаются от материнской клетки к дочерним, что согласуется с поведением ДНК; 2) радиационное излучение и химические канцерогены повреждают ДНК и могут вызывать мутации; 3) во многих опухолевых клетках обнаружены аномальные хромосомы; 4) опыты по трансфекции (см. ниже) показали, что очищенная ДНК из опухолевых клеток может превращать нормальные клетки в потенциально злокачественные. В процессе канцерогенеза могут участвовать и эпигенетические факторы.