Биохимия человека Том 2 - Марри Р. 1993
Частные вопросы
Рак, онкогены, факторы роста
Онкогенные вирусы - Онкогены
Онкогены — это участки ДНК (гены), функционирование которых приводит к опухолевой трансформации клеток. Открытие онкогенов имело большое значение для исследования фундаментальных механизмов канцерогенеза. Впервые онкогены были найдены в опухолеродных вирусах и идентифицированы как факторы, ответственные за процесс трансформации (вирусные онкогены).
Онкогены вируса саркомы Рауса
В настоящее время исследована структура онкогена вируса саркомы Рауса и охарактеризован продукт этого онкогена. Геном данного ретровируса состоит из четырех генов: gag, pol, env, src. Схематически его можно изобразить следующим образом:
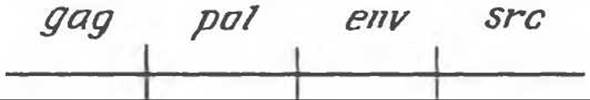
Ген gag кодирует синтез вирусных группоспецифических антигенов, ген pol — специфическую для ретровирусов обратную транскриптазу, ген env — синтез некоторых гликопротеинов вирусной оболочки. Продуктом гена src, ответственного за трансформацию (возникновение саркомы), является тирозиновая протеинкиназа. Эти данные оказались чрезвычайно важными. Они продемонстрировали наличие специфического биохимического механизма, которым можно, хотя бы отчасти, объяснить плейотропный эффект ретровирусов при трансформации. Клеточные белки, изменение фосфорилирования которых, возможно, приводит к трансформации, еще предстоит идентифицировать. Одним из них, по-видимому, является винкулин — белок, найденный в адгезионных бляшках (структурах, участвующих в межклеточной адгезии). Изменением фосфорилирования винкулина адгезионных бляшек, возможно, следует объяснять округление клеток при трансформации, а также понижение клеточной адгезии к стеклу и другим клеткам (табл. 57.5). Мишенями тирозиновой протеинкиназы, кодируемой геном src, являются, по-видимому, некоторые гликолитические ферменты. Это согласуется с более высоким уровнем гликолиза, часто наблюдаемым в трансформированных клетках. Продукт гена src может также катализировать реакцию фосфорилирования фосфатидилинозитола, в результате образуется фосфатадилинозитолмоно- и бисфосфат. При гидролизе фосфатидилинозитол-4,5-бисфосфата фосфолипазой С образуются инозитолтрифосфат и диацилглицерол (см. гл. 44). Первое соединение участвует в качестве медиатора в высвобождении ионов Са2+ из внутриклеточных компартментов (например, из эндоплазматического ретикулума). Диацилглицерол стимулирует активность связанной с плазматической мембраной протеинкиназой С; этот фермент в свою очередь фосфорилирует ряд других белков, в том числе, вероятно, белковые компоненты ионных насосов. Высказано предположение, что небольшое повышение внутриклеточного pH, вызываемое активацией системы Na+/H+-антипорта, стимулирует процесс митоза (см. гл. 42). Таким образом, продукт гена src может оказывать влияние на целый ряд клеточных процессов путем фосфорилирования различных белковых мишеней и ферментов, а также, стимулируя пути синтеза полифосфоинозитидов.
Таблица 57.5. Изменения в культуре клеток, свидетельствующие об опухолевой трансформации (например, после инфекции опухолеродными вирусами). Решающий признак малигнизации — способность клеток образовывать опухоли при введении животным
|
Изменения морфологии: трансформированные клетки имеют более округлую форму, чем контрольные клетки Увеличение плотности клеток (потеря контактного торможения роста): трансформированные клетки часто формируют многослойные структуры, тогда как контрольные клетки растут в виде монослоя Утрата необходимости закрепления на подложке: трансформированные клетки могут расти, не прикрепляясь к поверхности культурального сосуда, и часто растут в агаре Утрата контактного торможения движения: трансформированные клетки могут расти и двигаться поверх других клеток, тогда как нормальные клетки прекращают движение, когда вступают в контакт с другими клетками Различные биохимические изменения, в том числе повышение скорости гликолиза, изменение состава клеточной поверхности (например, изменение состава гликопротеинов или гликосфинголипидов), секреция ряда протеаз Изменения цитоскелетных структур, например актиновых микрофиламентов Снижение потребности опухолевых клеток в факторах роста; секреция ряда факторов в окружающую среду при этом часто повышается |
Тирозиновая протеинкиназа в нормальных и опухолевых клетках
Благодаря открытию тирозиновой протеинкиназы вируса саркомы Рауса стал интенсивно изучаться процесс фосфорилирования остатков тирозина в белках. Теперь известно, что тирозиновая протеинкиназа содержится во многих нормальных клетках. В большинстве таких клеток количество фосфотирозина мало, но при трансформации онкогенными вирусами, содержащими протеинкиназу, оно обычно
повышается, хотя абсолютное количество остается невысоким (1% всех фосфорсодержащих аминокислот). Ряд рецепторов (например, фактора роста эпидермиса, инсулина, фактора роста из тромбоцитов) нормальных и опухолевых клеток обладает активностью тирозиновой протеинкиназы, которая усиливается при взаимодействии рецепторов со своими лигандами (см. ниже «Факторы роста»). Таким образом, тирозиновая протеинкиназа играет важную роль и в нормальных, и в трансформированных клетках.
Онкогены других ретровирусов
Помимо онкогенов вируса саркомы Рауса было обнаружено около 20 онкогенов других ретровирусов. Продукты примерно половины из них представляют собой протеинкиназы (в основном тирозинового типа). Некоторые вирусные онкогены и их продукты приведены в табл. 57.6. Часть из них кодирует протеинкиназы; однако целый ряд онкогенов детерминирует различные другие белки, обладающие биологической активностью. Продукт гена еrb-В вируса эритобластоза птиц представляет собой неполную форму рецептора фактора роста эпидермиса, продукт онкогена sis вируса обезьяньей саркомы — неполную форму В-цепи молекулы фактора роста из тромбоцитов. Онкоген fms одного из вирусов, выделенных из клеток саркомы кошек, кодирует синтез фактора, стимулирующего рост колоний макрофагов. Продукт гена myc, впервые обнаруженного у вирусов, вызывающих миелоцитому кур, представляет собой ДНК-связывающий белок, который может регулировать митозы в клетках. Продукт онкогена ras вируса саркомы мышей связывает GTP, обладает GTPaзной активностью. Вероятно, он имеет отношение к белкам, регулирующим активность одного из ключевых ферментов мембран — аденилатциклазы (гл. 44).
Таблица 57.6. Некоторые онкогены ретровирусов. (Modified and reproduced, with permission, from Franks L. M., Teich N. M. (editors). Introduction to the Cellular and Molecular Biology of Cancer, Oxford Univ. Press, 1986.)
|
Онкоген |
Ретровирус |
Происхождение |
Продукт онкогена |
Субклеточная локализация |
|
abl |
Вирус Абельсона (лейкоза грызунов) |
Мыши |
Тирозиновая протеинкиназа |
Плазматическая мембрана |
|
erb-B |
Вирус эритробластоза птиц |
Куры |
Неполный рецептор ФРЭ |
Плазматическая мембрана |
|
fes |
Вирус саркомы кошек |
Кошки |
Тирозиновая протеинкиназа |
Плазматическая мембрана |
|
fos |
Вирус саркомы грызунов |
Мыши |
? |
Ядро |
|
myc |
Вирус миелоцитомы 29 |
Куры |
ДНК-связывающий белок |
Ядро |
|
sis |
Вирус саркомы обезьян |
Обезьяны |
Неполный фактор роста из тромбоцитов (В-цепь) |
Мембраны секретируется (?) |
|
src |
Вирус саркомы Рауса |
Куры |
Тирозиновая протеинкиназа |
Плазматическая мембрана |
Протоонкогены
Основной вопрос, который занимает исследователей со времени открытия вирусных онкогенов, — это вопрос об их происхождении. Опыты по гибридизации нуклеиновых кислот (см. гл. 36) показали, что нормальные клетки содержат последовательности ДНК, сходные (а возможно, идентичные) с вирусными онкогенами. Очевидно, в период внутриклеточного развития вирусы включают в свой геном клеточные гены. Их присутствие в геноме вирусов, по-видимому, обусловливает определенные селективные преимущества, связанные, например, с изменением характера роста трансформированных клеток.
Последовательности клеточной ДНК, гомологичные вирусным онкогенам, были найдены во многих клетках эукариот; это значит, что они представляют собой важные компоненты нормальных клеток. Кроме того, соответствующие мРНК и кодируемые ими белки могут обнаруживаться на разных стадиях развития или жизненного цикла клеток. Такие гены нормальных клеток получили название протоонкогенов. Продукты протоонкогенов играют существенную роль в нормальной дифференцировке и других клеточных процессах.
Онкогены опухолевых клеток
Опыты с ДНК, выделенной из клеток опухолей, также свидетельствуют о существовании онкогенов. Метод обнаружения клеточных онкогенов получил название «переноса генов» или «трансфекции». Он основан на том, что некоторые гены, присутствующие в опухолевых клетках, могут вызывать трансформацию «нормальных» клеток в культуре. Из опухолевых клеток выделяют ДНК, осаждают фосфатом кальция и добавляют к клеткам-реципиентам (обычно в этой роли выступает линия мышиных фибробластов NIH/3T3). Через 1—2 недели под микроскопом наблюдают образование фокусов трансформации. Клетки, составляющие фокус, меняют свою морфологию: из распластанных они становятся округленными. Из трансформированных клеток выделяют ДНК, и опыт повторяют. Так делают несколько раз, при этом уменьшается количество ДНК, не участвующей в переносе признака трансформации, и, следовательно, облегчается идентификация специфических генов (при помощи гибридизации по Сау-зерну (см. гл. 36)). С помощью этого метода было идентифицировано около 20 клеточных онкогенов; некоторые из них сходны с геном ras вируса саркомы мышей. Эти клеточные онкогены либо вообще не отличаются от нормальных генов, либо имеют небольшие структурные особенности (см. ниже). В первом случае при опухолевом перерождении может меняться регуляция их экспрессии.
Сокращенные названия клеточных и вирусных онкогенов
Онкоген, содержащийся в опухолевых клетках, обычно обозначается в литературе «с-оnс» (от cellular oncogene; например, c-ras). Аналоги, содержащиеся в нормальных клетках, — протоонкогены — соответственно носят название с-оnс-протоонкоген (например, с-rас-протоонкоген). Вирусный онкоген называют v-onc (например, v-ras; от viral oncogene), а соответствующий протоонкоген — v-оnс-протоонкоген (например, v-ras-протоонкоген).
Механизм превращения протоонкогенов в онкогены
Мы обсудим пять механизмов, с помощью которых меняется экспрессия или структура протоонкогенов и, следовательно происходит их превращение в онкоген. Процесс, в результате которого транскрипция гена повышается (от нулевого или низкого уровня), называют активацией. Знание механизмов активации принципиально для понимания современного состояния проблемы канцерогенеза.
А. Вставка промотора. Некоторые ретровирусы (например, вирусы лейкозов птиц) не содержат онкогенов, однако способны вызывать рак. При этом опухоли появляются через более длительный промежуток времени (через месяцы, а не дни, как в случае вирусов, содержащих онкогены). При инфицировании клеток этими вирусами и другими ретровирусами с вирусного РНК-генома с помощью обратной транскриптазы синтезируется копия ДНК (кДНК), которая встраивается в геном клетки-хозяина. Интегрированная двухцепочечная кДНК называется провирусом. Копии кДНК ретровирусов, подобно некоторым транспозонам (прыгающим генам), найденным в растениях и бактериях, содержат на обоих концах последовательности, называемые длинными концевыми повторами. Эти последовательности играют важную роль в механизме интеграции провируса и действуют как промоторы транскрипции (см. гл. 39). При инфицировании В-лимфоцитов кур некоторыми вирусами лейкоза птиц их провирусы встраиваются в районе гена mуc. Этот ген активируется расположенным до него длинным концевым повтором, выступающим в роли промотора. В результате происходит транскрипция, а затем и трансляции соответствующей myc-мРНК (рис. 57.3). Это в свою очередь приводит к развитию В-клеточной опухоли, хотя конкретная роль продуктов гена mуc в этом процессе пока неясна. Сходные процессы происходят и при инфицировании различных клеток другими ретровирусами.
Б. Вставка энхансера. Иногда провирус встраивается после гена mуc или до него, но в обратной ориентации, тем не менее ген mуc активируется (рис. 57.4). В данном случае активацию нельзя объяснить вставкой промотора, так как последний должен находиться до гена, транскрипция которого усиливается, а последовательность должна иметь правильную ориентацию (от 5' к 3'). Следовательно, активация объясняется, по-видимому, присутствием энхансеров в длинных концевых повторах ретровирусов (см. гл. 39 и 41).
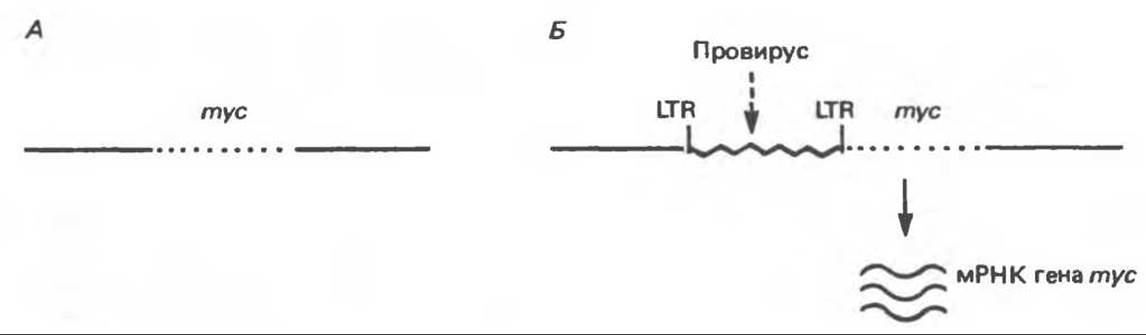
Рис. 57.3. Схематическое изображение процесса активации протоонкогена в результате вставки промотора. А. Нормальная хромосома курицы содержит неактивный ген mуc. Б. Вирус лейкоза птиц интегрирован в хромосоме в виде провируса в области, соседней с геном mуc. Правый длинный концевой повтор провируса (LTR), содержащий сильный промотор, локализован до гена mуc, активирует его, и в результате начинается транскрипция mус-мРНК. Для простоты изображена лишь одна цепочка ДНК.
Приведенные два механизма (вставка промотора и энхансера) можно назвать обычными для вирусного канцерогенеза.
В. Хромосомные транслокации. Как отмечалось ранее, во многих опухолевых клетках можно наблюдать хромосомные аномалии. Один из видов таких аномалий — транслокация. Суть ее состоит в том, что фрагмент одной хромосомы отщепляется и присоединяется к другой хромосоме. Если эта последняя хромосома в свою очередь отдает соответствующий фрагмент первой хромосоме, то происходит так называемая «реципрокная транслокация». В целом ряде опухолевых клеток найдены характерные транслокации. Например, при хроническом гранулоцитарном лейкозе в клетках можно обнаружить Филадельфийскую хромосому. В ее образовании участвуют хромосомы 9 и 22.
Реципрокная транслокация выявлена у некоторых пациентов с лимфомой Беркитта — быстрорастущей опухоли В-лимфоцитов человека (рис. 57.5). Эта транслокация иллюстрирует механизм активации потенциальных клеточных онкогенов. В транслокации участвуют хромосомы 8 и 14. Фрагмент хромосомы 8, присоединяющийся к хромосоме 14, содержит ген mуc. Как показано на рисунке 57.6, в результате такого перемещения (транспозиции) неактивный ген попадает под контроль энхансера, усиливающего транскрипцию генов, кодирующих тяжелые цепи иммуноглобулинов. В результате ген mуc активируется. По-видимому, синтез больших количеств ДНК-связывающего белка, кодируемого геном mуc, вызывает малигнизацию клеток, возможно влияя на регуляцию митозов. Этот механизм сходен с механизмом вставки энхансера, однако в рассматриваемом случае хромосомная транслокация (а не интеграция провируса) «ставит» протоонкоген (в данном случае mуc) под контроль энхансера.
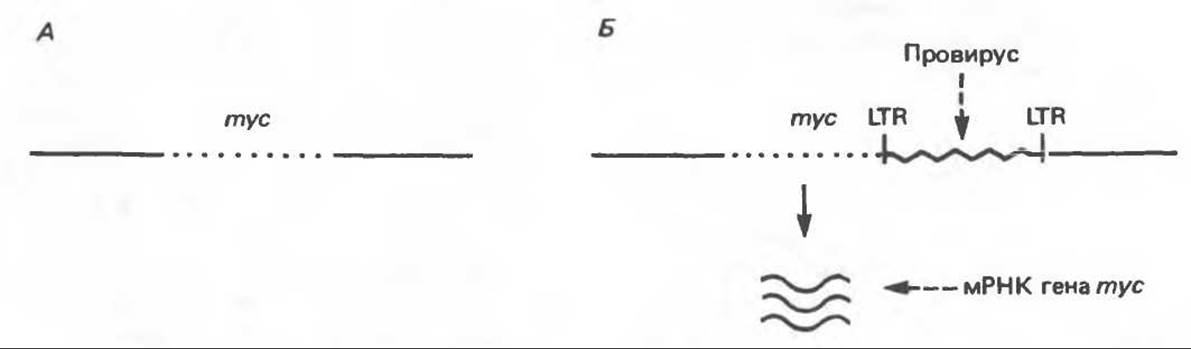
Рис. 57.4. Схематическое изображение процесса активации протоонкогена в результате вставки энхансера. А. Нормальная хромосома курицы содержит неактивный ген mуc. Б. Вирус лейкоза птиц встраивается в хромосому в форме провируса в области, соседней с геном mуc. В данном случае, однако, сайт интеграции расположен за геном mуc и не может работать как промотор (рис. 57.6). Определенная последовательность провируса в данном случае выступает в роли энхансера, что ведет к активации гена mуc и транскрипции его. Для простоты изображена лишь одна цепочка ДНК.
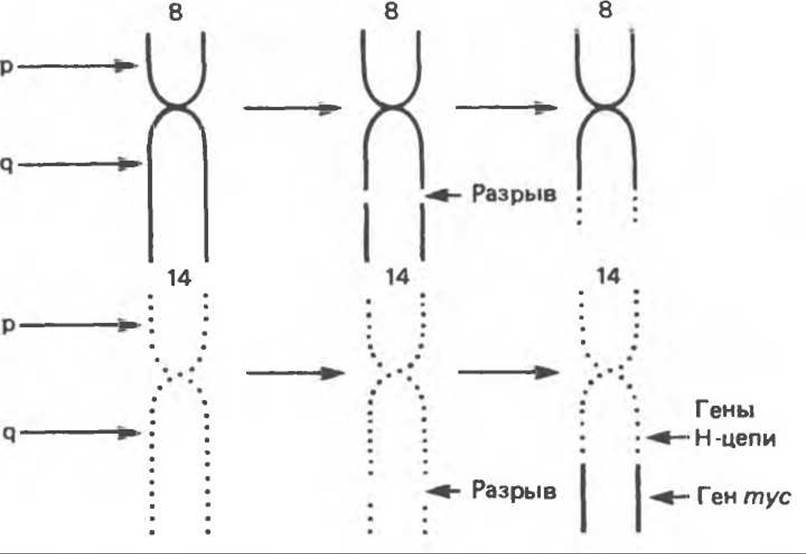
Рис. 57.5. Схематическое изображение реципрокной транслокации, обнаруживаемой в клетках лимфомы Беркитта. Участвуют хромосомы 8 и 14. Конец q-плеча 8-й хромосомы переходит к 14-й хромосоме, гомологичный фрагмент хромосомы 14 переходит к 8-й хромосоме. Ген mуc находится в том сегменте хромосомы 8, который попадает на хромосому 14; он встраивается вслед за генами, кодирующими тяжелые цепи молекул иммуноглобулинов, и активируется.
Г. Амплификация генов. Амплификация некоторых генов (см. гл. 38) обнаружена в клетках ряда опухолей. Как выяснилось, ее можно вызвать введением противоопухолевого препарата метотрексата — ингибитора дигидрофолатредуктазы. В результате опухолевые клетки становятся резистентными к действию метотрексата. Причиной резистентности является амплификация гена дигидрофолатредуктазы, при этом активность фермента повышается примерно в 400 раз. Амплифицированные гены, имеющие суммарную длину 1000 т. п. н. или даже больше, выявляются в виде гомогенно окрашенных участков на соответствующих хромосомах. Амплифицированные гены могут обнаруживаться также в двойных мини-хромосомах, не содержащих центромер. В настоящее время исследуется связь гомогенно окрашенных участков и двойных мини-хромосом. Процесс амплификации, а следовательно, и активации, может затрагивать и некоторые клеточные онкогены. Имеются данные, позволяющие предполагать, что увеличение количества продукта некоторых онкогенов (например, с-ras) в результате амплификации может играть роль в повышении злокачественности опухолевых клеток (см. ниже «Прогрессия опухолей»).
Д. Точечные мутации. Онкоген с-ras был впервые обнаружен в некоторых ретровирусах грызунов (например, крыс и мышей). Продукт этого гена — белок с мол. массой 21000 (р21) — близок G-белкам, регулирующим активность аденилатциклазы, и. следовательно, играет ключевую роль в ответных реакциях клеток на гормоны и лекарства. Сравнение последовательности ДНК протоонкогена c-ras из нормальных клеток человека и онкогена с-ras из клеток опухоли мочевого пузыря показало, что они отличаются лишь по одному основанию и, следовательно, по одной аминокислоте (положение 12 белка р21). Этот интересный результат был подтвержден анализом генов c-ras других опухолей человека. Во всех случаях были получены одни и те же результаты: ген, выделенный из клеток опухоли, содержал лишь одну точковую мутацию по сравнению с c-ras-пpoтоонкогеном из нормальных клеток. Поскольку положение такой мутации варьирует, меняется и положение аминокислотной замены. Мутации р21 меняют конформацию белка и уменьшают его GТРазную активность. Понижение активности этого фермента влечет за собой стимуляцию активности аденилатциклазы, которая тормозится при образовании GDP из GTP (см. гл. 44). В результате стимуляции аденилатциклазы возрастает количество сАМР, что влияет на активность различных сАМР-зависимых протеинкиназ. Это в свою очередь сдвигает баланс процессов клеточного метаболизма в направлении трансформации или ее стабилизации.
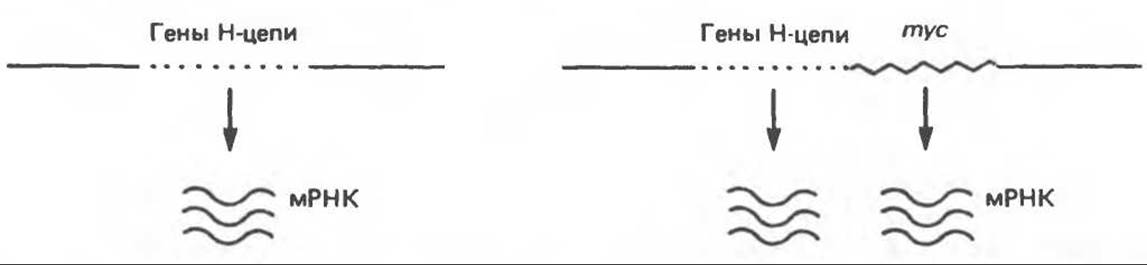
Рис. 57.6. Схематическое изображение процесса активации mус-протоонкогена при транслокации в клетках лимфомы Беркитта. Небольшой фрагмент 14-й хромосомы перед транслокацией. Указанный фрагмент содержит гены, кодирующие участки тяжелых цепей иммуноглобулинов. После транслокации первично неактивный ген mуc оказывается под контролем энхансера, локализованного в области генов, кодирующих тяжелые цепи. В результате ген mуc активируется. Показана лишь одна цепь ДНК.
Общие замечания относительно активации онкогенов
Из пяти рассмотренных механизмов активации онкогенов в первых четырех (вставка промотора, вставка энхансера, хромосомные транслокации и амплификация генов) имеет место усиление транскрипции и вследствие этого повышение количества продукта онкогена. При этом его структура не меняется. Возможно, именно увеличения концентрации продукта оказывается достаточно, чтобы запустить процесс малигнизации клеток. Пятый механизм активации (точечные мутации) подразумевает изменение структуры продукта онкогена, при этом количество его может не меняться. Таким образом, для процесса трансформации может оказаться достаточным наличие структурно аномального регуляторного белка.
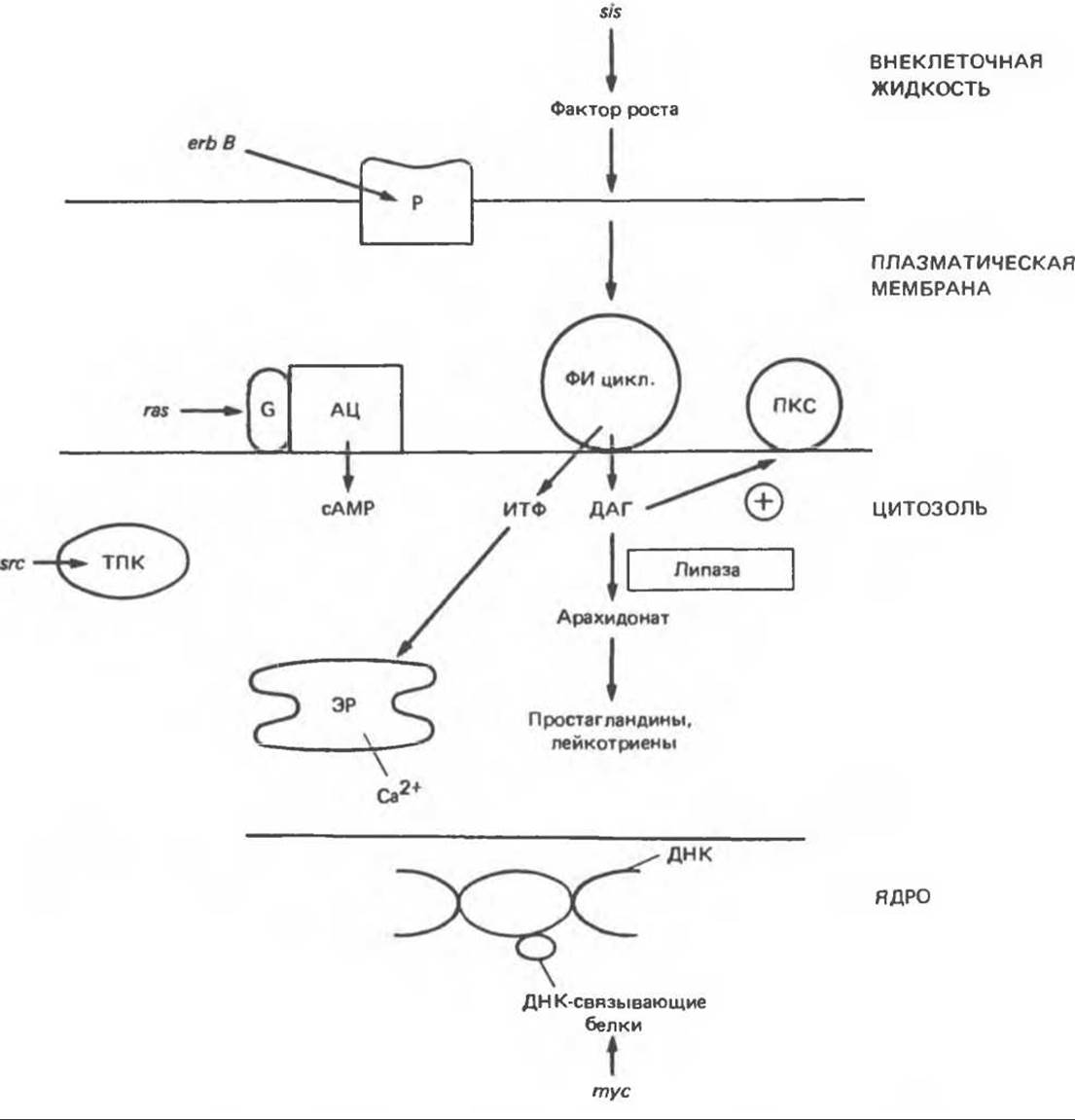
Рис. 57.7. Схема механизмов, с помощью которых продукты онкогенов могут влиять на клеточный метаболизм и тем самым стимулировать рост. сАМР влияет на клеточные процессы, активируя сАМР-зависимые протеинкиназы. Тирозиновая протеинкиназа и протеинкиназа С могут активировать целый ряд белков-мишеней. На клеточные реакции влияют ионы Са2+, простагландины и лейкотриены, образующиеся из арахидоновой кислоты. Р — рецептор; G — G-белок: АЦ — аденилатциклаза; ФИ — фосфатидилинозитол; ПКС — протеинкиназа С; ТПК — тирозиновая протеинкиназа; ИТФ — инозитолтрифосфат; ДАГ — диацилглицерол; ЭР — эндоплазматический ретикулум.
При обсуждении роли онкогенов в процессе возникновения злокачественных новообразований стоит иметь в виду, что онкогены выделены лишь из 15% опухолей человека. Возможно, в некоторых случаях активация онкогена — это следствие трансформации, а не причина ее. Участие онкогенов в развитии экспериментальных опухолей, вызванных химическими канцерогенами, лишь начинает изучаться. Так, недавно было показано, что при индукции опухоли молочной железы крысы нитрозометилмочевиной наблюдается активация гена с-ras, при этом выявлена мутация типа транзиции G→A. Этот факт свидетельствует о том, что онкогены участвуют в химическом канцерогенезе. Поскольку в данных экспериментах канцероген применяли однократно (без промотора), обнаруженная мутация могла быть компонентом стадии инициации химического канцерогенеза. Для выяснения возможной роли онкогенов в процессах инициации, промотирования, прогрессии опухолей и их метастазирования необходимы дальнейшие исследования.
Механизмы действия онкогенов
Существуют по меньшей мере три механизма, с помощью которых онкогены стимулируют рост клеток (рис. 57.7). 1. Онкогены могут действовать на ключевые внутриклеточные процессы, участвующие в контроле роста клеток. При этом оказывается ненужным внешний стимул. Примерами могут служить продукт гена src, являющийся тирозиновой протеин
киназой, продукт гена ras, стимулирующий (опосредованно) активность аденилатциклазы, или продукт гена mуc — ДНК-связывающий белок. В каждом из этих примеров онкоген может оказывать воздействие на процесс митоза (продукты первых двух онкогенов путем влияния на фосфорилирование ключевых регуляторных белков). Существенный пробел в нашем понимании процесса клеточного роста состоит в том, что очень мало известно о молекулярных аспектах регуляции митоза даже в нормальных клетках. 2. Продукты онкогенов могут имитировать действие полипептидных факторов роста. 3. Продукты онкогенов могут имитировать ситуацию, возникающую при взаимодействии рецептора с соответствующим фактором роста.