Биохимия человека Том 2 - Марри Р. 1993
Структура, функция и репликация информационных макромолекул
Синтез белка и генетический код
Процесс синтеза белка
Основные структурные характеристики рибосом и процесс их самосборки обсуждались в гл. 39. Эта особая структура выступает в роли «машины», обеспечивающей трансляцию последовательности нуклеотидов мРНК в последовательность аминокислот белковой молекулы. Трансляция молекул мРНК начинается с 5'-конца с образованием N-конца растущей полипептидной цепи. Информация считывается в направлении 5'→3' и заканчивается образованием С-конца белковой молекулы. Таким образом реализуется сформулированная ранее концепция полярности (однонаправленности) генетической информации. Как показано в гл. 39, транскрипция гена в соответствующую мРНК начинается с образования 5'-конца молекулы мРНК. У прокариот это позволяет начать трансляцию мРНК еще до завершения транскрипции. У эукариот процесс транскрипции происходит в ядре, а трансляция мРНК — в цитоплазме. Такая компартментализация процессов исключает одновременное протекание транскрипции и трансляции и делает неизбежным процессинг первичных гяРНК-транскриптов с образованием зрелых молекул мРНК.
Процесс синтеза белка так же, как репликация ДНК и транскрипция генов, разбивается на три этапа: инициацию, элонгацию и терминацию.
Инициация (рис. 40.7)
У большинства мРНК-молекул эукариот 5'-конец «кэпирован», (гл.39). Кэп представляет собой остаток метилгуанозилтрифосфата и, возможно, участвует в связывании РНК-молекул с 40S-субъединицей рибосомы. Как правило, трансляция начинается с кодона AUG. Рибосомная 18S-PHK (рРНК) 40S-субъединицы связывается с областью мРНК, предшествующей первому кодону. Связывание мРНК с 40S-субъединицей требует участия белкового фактора — фактора инициации З (ФИ-3).
Первая аминоацил-тРНК, участвующая в трансляции первого кодона, взаимодействует с GTP и фактором инициации 2 (ФИ-2). Образовавшийся комплекс в присутствии фактора инициации 1 (ФИ-1) присоединяет тРНК к первому кодону матрицы и образует инициаторный комплекс с 40S-субъединицей рибосомы. После высвобождения факторов инициации (ФИ-1, ФИ-2 и ФИ-3) к GTP присоединяется субъединица 60S, при этом происходит гидролиз молекулы GTP. Так завершается образование полной 80S-рибосомной частицы.
Полностью собранная рибосома содержит два функциональных участка для взаимодействия с молекулами тРНК. Пептидильный участок (Р-участок) содержит растущую полипептидную цепь в составе пептидил-тРНК в комплексе с последним протранслированным кодоном мРНК. Аминоацильный участок (A-участок) содержит аминоацил-тРНК, соединенную с соответствующим кодоном мРНК. После образования инициаторного комплекса с первым кодоном аминоацил-тРНК попадает в формирующийся P-участок, оставляя A-участок свободным. Таким образом, рамка считывания определяется прикреплением первой тРНК к первому транслируемому кодону. Узнавание этого инициаторного кодона, по-видимому, зависит от вторичной структуры молекулы мРНК. Кроме того, в специфической инициации трансляции у прокариот, а возможно, и у эукариот принимает участие входящая в состав мРНК нуклеотидная последовательность, комплементарная фрагменту 16S (18S)-рибосомной РНК.
У прокариот в инициацию синтеза большинства, если не всех, белков вовлечена специальная аминоацил-тРНК—N-формилметионил-тРНК. У эукариот метионил-тРНК не подвергается формилированию, хотя сам метионин является N-концевой аминокислотой большинства белков.
Возможно, что у прокариот N-формилироваиие остатка метионина в тРНК создает аналогию с пептидной связью, благодаря которой становится возможным перемещение инициаторного комплекса в пептидильный участок. У прокариот также имеется фермент, отщепляющий формильную группу или весь N-концевой формилметионильный или метионильный остаток от белка. Во многих случаях это происходит еще до полного завершения трансляции.
Элонгация (рис. 40.8)
В полностью сформированной на стадии инициации трансляции 80S-рибосоме A-участок свободен. Присоединение соответствующей аминоацил-тРНК в A-участке требует точного узнавания кодона. Фактор элонгации 1 (ФЭ-1) образует комплекс с GTP и молекулой аминоацил-тРНК. Благодаря этому аминоацил-тРНК может присоединиться к рибосоме. При этом произойдет высвобождение комплекса ФЭ-1-GDP и фосфата. Как показано на рис. 40.8, комплекс ФЭ-1-GDP затем вновь превращается в ФЭ-1-GTP при участии других свободных белковых факторов и GTP.
а-Аминогруппа новой аминоацил-тРНК в участке А осуществляет нуклеофильную атаку этерифинированной карбоксильной группы пептидил-тРНК, занимающей P-участок. Эта реакция катализируется пептидил трансферазой — белковым компонентом, входящим в состав 60S-рибосомной субъединицы. Поскольку аминокислота в аминоацил-тРНК уже «активирована», для этой реакции не требуется дополнительной энергии. В результате реакции растущая полипептидная цепь оказывается прикрепленной к тРНК, находящейся в А-участке.
После удаления пептидильного остатка с гРНК в P-участке свободная молекула тРНК быстро покидает P-участок. Комплекс GTP с фактором элонгации 2 (ФЭ-2) участвует в процессе гранслокации новообразованной пептидил-тРНК из A-участка в Р-участок. При этом происходит гидролиз GTP, используемого в качестве кофактора ФЭ-2, до GDP и фосфата. В результате транслокации вновь сформированная пептидил-тРНК и соответствующий ей кодон переходят в P-участок, освобождая A-участок для нового цикла узнавания следующего кодона соответствующей молекулой аминоацил-тРНК и элонгации.
Присоединение аминокислотного остатка к тРНК требует гидролиза АТР до АМР, что эквивалентно гидролизу двух молекул АТР до ADP и фосфата. Внедрение аминоацил-тРНК в A-участок сопровождается гидролизом GTP до GDP. Для транслокации пептидил-тРНК из A-участка в Р-участок также необходим гидролиз GTP до GDP и фосфата. Таким образом, энергетические потребности образования одной пептидной связи обеспечиваются за счет гидролиза двух молекул АТР до ADP и двух молекул GTP до GDP, т. е. гидролиза четырех макроэргических фосфатных связей.
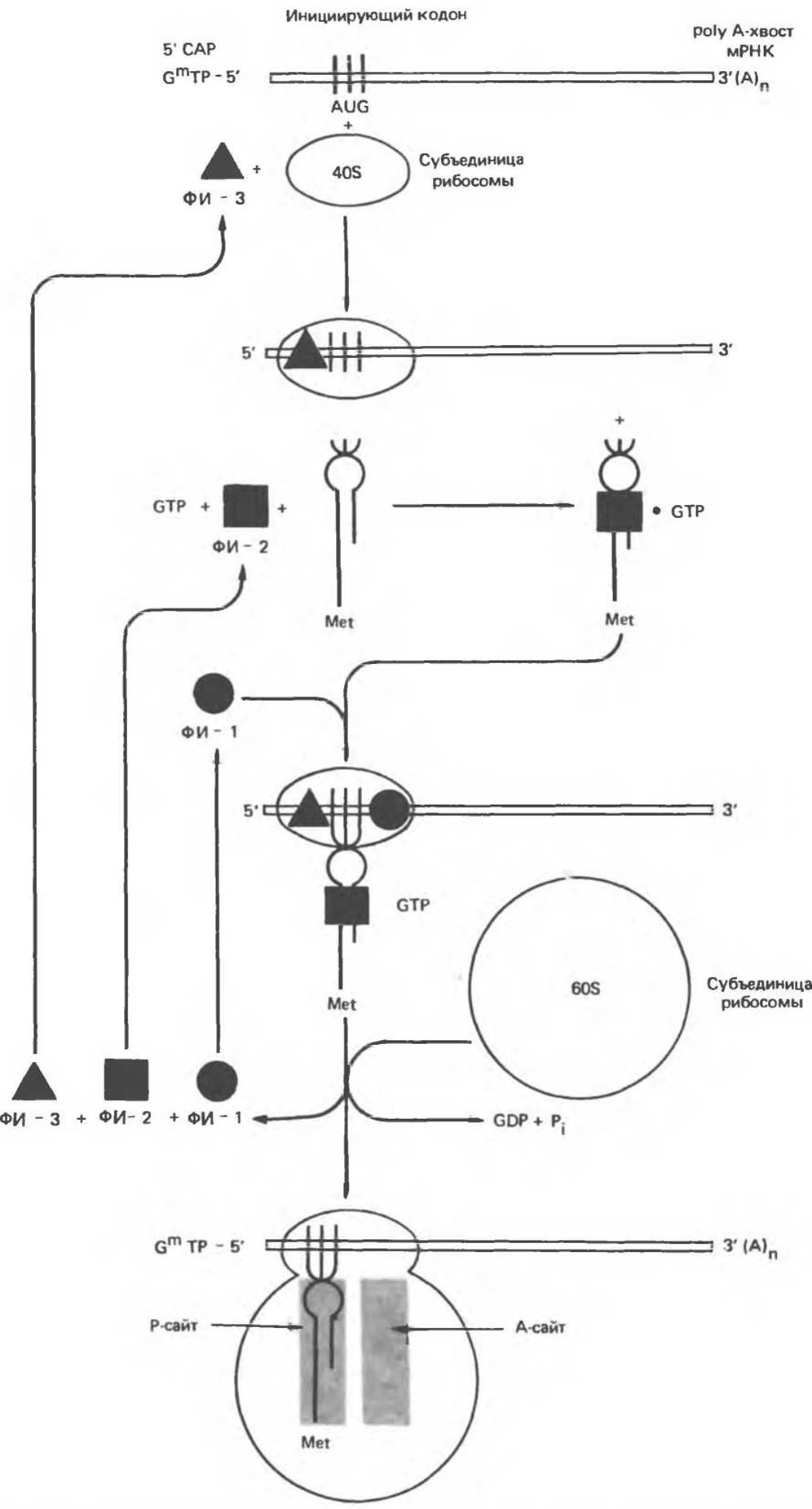
Рис. 40.7. Схема инициации синтеза белка на мРНК, содержащей 5'-кэпирующую структуру и 3'-роlу A-конец. ФИ-1, ФИ-2 и ФИ-3 — факторы инициации 1,2 и 3 соответственно. Шпилечная структура с остатком Met на конце обозначает метионил-тРНК. Буквами Р и А обозначены участки связывания на рибосоме — пептидил-тРНК и аминоацил-тРНК соответственно.
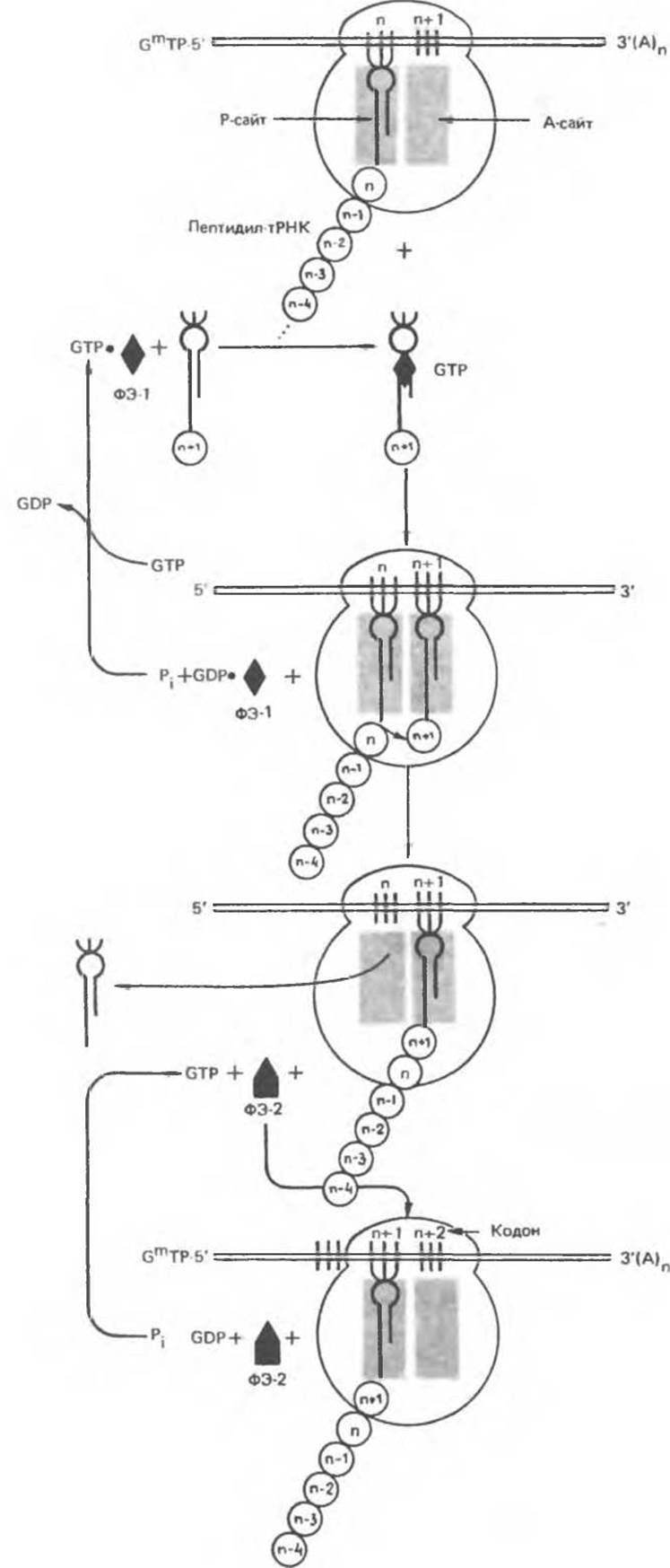
Рис. 40.8. Схема процесса элонгации синтеза белка. Кружками с обозначениями n-1, n, n+1 и т. д. отмечены аминокислотные остатки синтезируемой белковой молекулы. ФЭ-1 и ФЭ-2 — факторы элонгации 1 и 2 соответственно.
Терминация (рис. 40.9)
После многих циклов элонгации, в результате которых синтезируется полипептидная цепь белка, в А-участке появляется терминирующий или нонсенскодон. В норме отсутствуют молекулы тРНК, способные узнавать нонсенс-кодоны. Появление в А-участке терминирующего кодона распознается так называемыми факторами высвобождения (R-факторами). R-факторы при участии GTP и пептидилтрансферазы обеспечивают гидролиз связи между полипептидом и молекулой тРНК, занимающей P-участок. После гидролиза и высвобождения синтезированного полипептида и тРНК 80S-рибосома диссоциирует на 40S- и 60S-субъединицы, которые могут затем вновь использоваться в трансляции новых мРНК. Таким образом, факторы высвобождения — это белки, гидролизующие пептидил-тРНК при попадании в А-участок нонсенс-кодона.
Одну и ту же цепь мРНК могут транслировать одновременно множество рибосом. Из-за довольно большого собственного размера их расстояние на мРНК не меньше чем 80 нуклеотидов. Рибосомы, расположенные на одной молекуле мРНК, образуют так называемую полирибосому или полисому. В отсутствие ограничений число рибосом, присоединенных к мРНК (а значит, и размер полисомы), коррелирует с длиной цепи мРНК. Масса самой молекулы мРНК значительно ниже, чем масса даже единичной рибосомы.
Одна рибосома млекопитающих может осуществлять синтез около 100 пептидных связей ежеминутно.
Полисомы, активно синтезирующие белки, могут существовать в виде свободных частиц или быть прикрепленными к внутриклеточной мембранной сети, называемой эндоплазматическим ретикулумом (ЭПР). Многочисленные полисомы, прикрепленные к мембранам эндоплазматического ретикулума, создают регистрируемую электронным микроскопом «шероховатую» структуру. Белки, синтезируемые на прикрепленных полисомах, вытесняются в пространство между слоями шероховатого ЭПР и подвергаются последующей экскреции. Для этого некоторые белковые продукты упаковываются в зимогенные частицы при участии аппарата Гольджи (см. гл. 42). Цитоплазматические полисомы синтезируют белки, необходимые для выполнения внутриклеточных функций.
Процессинг белков
Некоторые вирусы животных, в особенности полиовирус (РНК-содержащий вирус), синтезируют длинные полицистройные белки, считываемые с одной протяженной цепи мРНК. Такие белковые молекулы расщепляются в определенных участках с образованием нескольких специфических вирусных белков. В клетках животных многие белки синтезируются по РНК-матрице в виде молекул-предшественников, которые затем для образования активных молекул должны быть модифицированы. В качестве примера такого белка можно привести инсулин — низкомолекулярный белок, состоящий из двух полипептидных цепей с внутрицепочечными и межцепочечными дисульфидными мостиками. Молекула инсулина синтезируется в виде одноцепочечного предшественника инсулина. Затем специфическая протеаза удаляет сегмент, соединяющий две цепи, обнаруживаемые в составе зрелого функционально активного инсулина (см. рис. 51.4 и 51.5).
Многие другие полипептиды синтезируются в виде пробелков, требующих дальнейшей модификации для приобретения биологической активности Посттрансляционная модификация часто включает стадию удаления N-концевых аминокислотных остатков специфическими аминопептидазами. Коллаген — основной белок межклеточного пространства у высших эукариот — синтезируется в виде проколлагена. Три полипептидных молекулы проколлагена (часто неидентичные по первичной структуре) выстраиваются в четвертичную структуру в зависимости от присутствия у них на N-конце определенных пептидов. Специализированные ферменты направляют гидроксилирование и окисление определенных аминокислотных остатков проколлагеновых цепей с целью образования стабилизирующих перекрестных сшивок. Далее происходит отщепление аминоконцевых пептидов и образуется конечный продукт — прочная нерастворимая молекула коллагена (см. гл. 56). Известны и многие другие посттрансляционные модификации белков. Например, широко распространены ковалентные модификации, такие, как ацетилирование, фосфорилирование и гликозилирование.
Ингибиторы синтеза белка
Рибосомы бактерий и митохондрий клеток высших эукариот отличаются от рибосом клеток млекопитающих, описанных в гл. 37. Бактериальные рибосомы меньше (70S вместо 80S) и содержат другой, несколько более простой набор РНК и белков. Это различие широко используется в клинической практике, поскольку многие эффективные антибиотики избирательно взаимодействуют с белками прокариотических рибосом и ингибируют бактериальный синтез белка. При этом бактерии либо гибнут, либо приостанавливается их развитие. Лучшие антибиотики этого класса не взаимодействуют со специфическими белками эукариотических рибосом и, таким образом, нетоксичны для эукариотических организмов. Некоторые из них в табл. 40.2, суммирующей данные по влиянию антибиотиков на синтез белка, выделены жирным шрифтом.
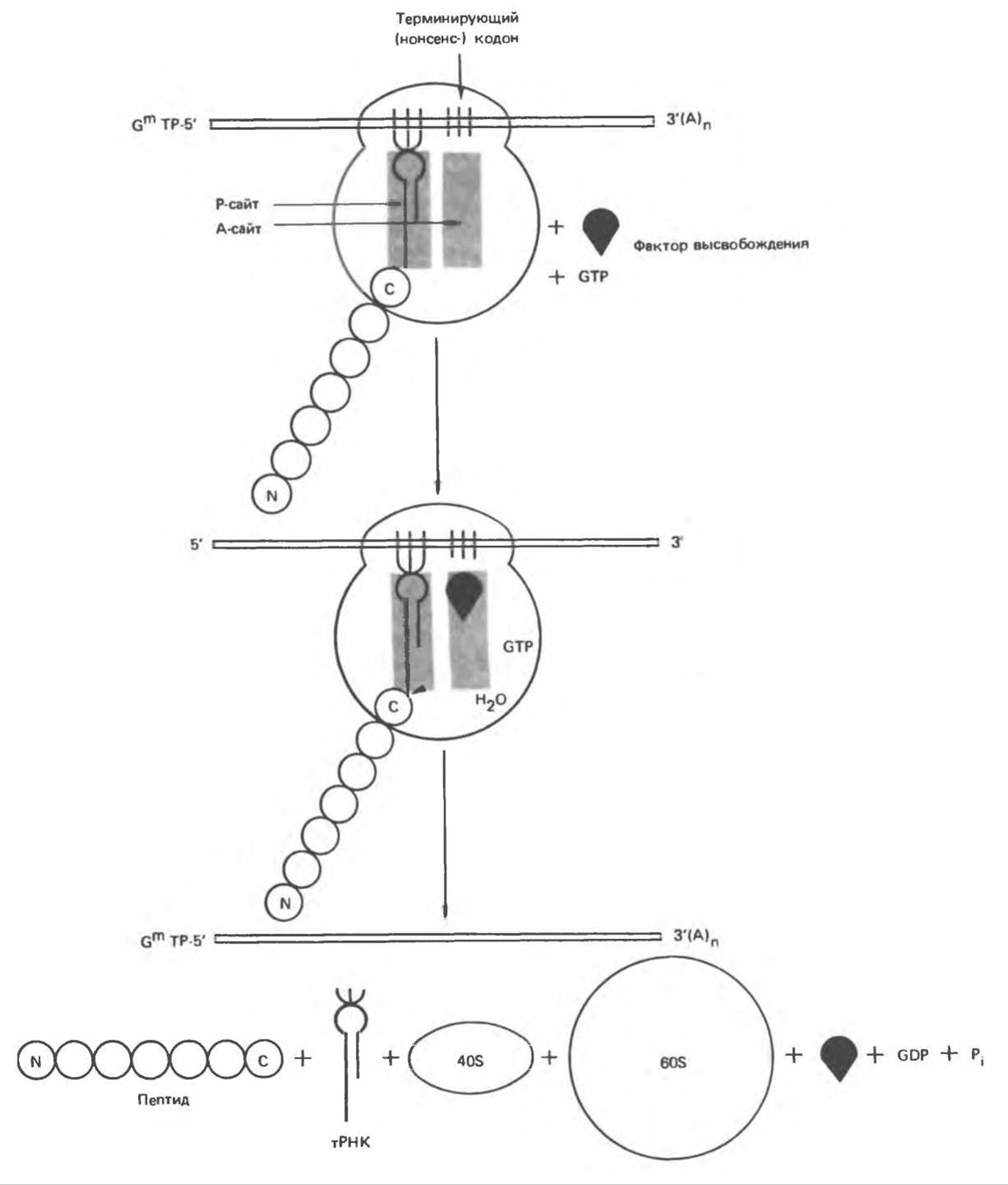
Рис. 40.9. Схема процесса терминации синтеза белка. Буквами Р и А обозначены участки связывания на рибосоме — пептидил-тРНК и аминоацил-тРНК соответственно. Гидролиз пептидил-тРНК-комплекса представлен в виде атаки молекулы Н2O. Для иллюстрации направленности процесса трансляции буквами N и С помечены N- и С-концевые аминокислоты.
Таблица 40.2. Антибиотики ингибиторы трансляции
|
Эукариоты (цитоплазма) |
Эукариоты (митохондрии) |
Прокариоты |
|
|
Инициация |
|||
|
Ауринтрикарбоксиловая кислота |
— |
— |
+ |
|
Элонгация |
|||
|
Амицетин |
? |
? |
+ |
|
Анизомицин |
— |
? |
+ |
|
Хлорамфеникол |
— |
+ |
+ |
|
Циклогeксимид |
+ |
— |
— |
|
Фузитовая кислота |
+ |
||
|
Линконин |
— |
? |
+ |
|
Пуромицин |
+ |
+ |
+ |
|
Спарсомицин |
+ |
+ |
+ |
|
Тетрациклины |
— |
+ |
+ |
|
Терминация |
|||
|
Анизомицин |
? |
? |
* |
|
Амицетин |
? |
? |
+ |
|
Хлорамфеникол |
— |
+ |
+ |
|
Эритромицин |
— |
+ |
+ |
|
Линкоцнн |
9 |
? |
+ |
|
Сиарсомицин |
+ |
+ |
+ |
|
С греигомицин |
+ |
± |
+ |
+ — ингибирование; - — нет ингибирования; * — стимуляция; ? — неизвестно
Существуют антибиотики, ингибирующие синтез белка или для всех типов рибосом (пуромицин). или только для эукариотических (циклогексимид). Пуромицин, структура которою представлена на рис. 40.10, представляет собой структурный аналог тирозил-тРНК. Пуромицин включается через участок А рибосомы в С-концевое положение растущей полипептидной цепи и вызывает ее преждевременную диссоциацию и соответственно терминацию синтеза белка. Пуромицин как аналог тирозил-тРНК эффективно ингибирует синтез белка как у прокариот, так и у эукариот.
Дифтерийный токсин — это экзотоксин, продуцируемый лизогенными по специфическому фату клетками Corynebacterium diphteriae. Этот токсин катализирует ADP-рибозилирование ФЭ-2 в клетках млекопитающих. Такая модификация инактивирует ФЭ-2 и, следовательно, ингибирует синтез белка. Многие животные (например, мышь) устойчивы к дифтерийному токсину. Эта устойчивость обусловлена неспособностью дифтерийного токсина проникать через клеточную мембрану, а не устойчивостью мышиного ФЭ-2 к катализируемому токсином ADP-рибозилированию.
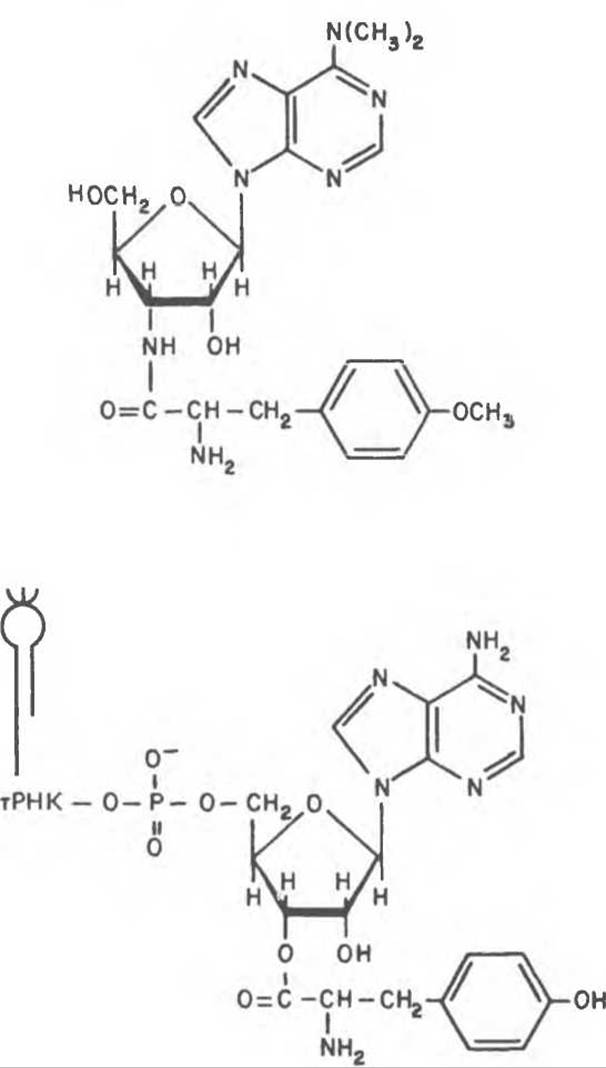
Рис. 40.10. Сравнение структур антибиотика пуромицина и 3'-концевого участка тирозил-тРНК.
Многие из вышеупомянутых соединений, например пуромицин и циклогексимид, не используются в клинической практике. Однако они оказались очень полезными в экспериментах по изучению роли синтеза белка в регуляции метаболических процессов, особенно индукции ферментов при действии гормонов.
Литература
Burrell В. G. et al. Different pattern of codon recognition by mammalian mitochondrial tRNAs, Proc. Natl. Acad. Sсi. USA, 1980, 77, 3164.
Caskey С. T. Peptide chein termination. Trends Biochem. Sсi., 1980. 5. 234.
Darnell J. et al. Molecular Cell Biology, Scientific American Books. 1986.
Drake J. W., Baltz R. H. The biochemistry of mutagenesis, Annu. Rev. Biochem, 1975, 45, 11.
Forget B. G. Molecular genetics of human hemoglobin synthesis, Ann. Intern. Med., 1979, 91, 605.
Heselkkorn R., Rothman-Denes L. B. Protein synthesis, Annu. Rev. Biochem., 1973, 42, 397.
Hunt T. DNA Makes RNA Makes Protein, Elsevier, 1983.
Levin В. Genes, 2nd ed., Wiley, 1985.
Roth J. R. Frameshift mutations, Annu. Rev. Genet, 1974, 8, 319.
Schafritz D. A. et al. Evidence for the role of M7G5'-phosphate group in recognition of eukaryotic mRNA by inhibition factor IF-M3, Nature, 1976, 261, 291.
Schlessinger D. Genetic and antibiotic modification of protein synthesis, Annu. Rev. Genet., 1974, 8, 135.
Shatkin A.J. mRNA cap binding proteins: Essential factors for initiating translation. Cell, 1985, 40, 223.
Weatherall D.J., Clegg J. B. Thalassemia revisited, Cell, 1982, 29, 7.
Weissbach G., Ochoa S. Soluble factors required for eukaryotic protein synthesis, Annu. Rev. Biochem., 1976, 45, 191.
Wool I. The structure and function of eukaryotic ribosomes, Annu. Rev. Biochem, 1979, 48, 719.