Биохимия человека Том 2 - Марри Р. 1993
Биохимия внутри- и межклеточных коммуникаций
Действие гормонов
Механизм действия гормонов II группы (пептидных гормонов) - сАМР как второй посредник
Большая часть гормонов нерастворимы, не имеют специальных транспортирующих их белков (и потому характеризуются коротким периодом полужизни в плазме крови) и запускают ответную реакцию посредством присоединения к рецепторам, локализованным на плазматической мембране (табл. 44.1 и 44.2). Механизм действия гормонов этой группы целесообразно обсуждать путем рассмотрения их внутриклеточных посредников.
сАМР (циклический АМР, 3', 5'-адениловая кислота) — повсеместно распространенный нуклеотид, образующийся из АТР при участии фермента аденилатциклазы, играет ключевую роль в механизме действия ряда гормонов. Различные гормоны увеличивают либо снижают внутриклеточный уровень сАМР (табл. 44.3), причем их эффект варьирует от ткани к ткани. Адреналин резко увеличивает концентрацию сАМР в мышцах, относительно мало влияет на этот параметр в печени. Прямо противоположное можно констатировать в отношении глюкагона. Ответ тканей на действие нескольких гормонов этой группы осуществляется через посредство уникальных для каждого гормона рецепторов, сопряженных с одним и тем же соединением — аденилатциклазой. Лучший пример тому — клетки жировой ткани, в которых адреналин, АКТГ, ТСГ, глюкагон, МСГ и вазопрессин стимулируют аденилатциклазу и повышают уровень сАМР. Комбинация максимально эффективных концентраций этих гормонов не дает аддитивность эффекта, а обработка клеток, вызывающая блокаду одного из рецепторов, не меняет клеточного ответа на другие гормоны.
Таблица 44.3. Субклассификация гормонов группы II. А
|
Гормоны, стимулирующие аденилатциклазу |
Гормоны, ингибирующие аденилатциклазу |
|
АКТГ (адренокортикотропный гормон) |
Ацетилхолин |
|
АДГ (антидиуретический гормон) |
а2-Адренергические гормоны |
|
ß-Адренергические гормоны |
Ангиотензин II |
|
Кальцитонин |
Опиоиды |
|
КРГ (кортиколиберин) |
Соматостатин |
|
ФСГ (фолликулостимулирующий гормон) |
|
|
Глюкагон |
|
|
ХГЧ (хориогонадотропин человека) |
|
|
ЛГ (лютеинизирующий гормон) |
|
|
Липотропин |
|
|
МСГ (меланоцит-стимулирующий гормон) |
|
|
ПТГ (паратиреоидный гормон) |
|
|
ТСГ (тиреоид-стимулирующий гормон) |
Аденилатциклазная система
Компоненты этой системы в клетках млекопитающих показаны на рис. 44.3. Взаимодействие гормона со своим рецептором приводит к активации либо инактивации аденилатциклазы. Этот процесс опосредуется по крайней мере двумя GTP-зависимыми регуляторными белками, обозначаемыми Gs- (стимулирующий) и Gі- (ингибирующий) белок (используют также обозначения Ns- и Ni-белок); каждый из этих белков состоит из трех субъединиц: а, β и у. Аденилатциклаза, локализованная на внутренней поверхности плазматической мембраны, катализирует образование сАМР из АТР в присутствии ионов магния (см. рис. 34.14).
То, что первоначально рассматривали как один белок с двумя функционально разными доменами, оказалось системой выдающейся сложности. Исследования, проведенные в течение последних 15 лет, выявили биохимическую универсальность рецепторов гормонов и обоих доменов аденилатциклазного комплекса (GTP-регуляторного и каталитического) и позволили создать модель их функционирования (рис. 44.3). Модель позволяет понять, каким образом пептидные гормоны стимулируют или ингибируют образование сАМР.
Две параллельные системы, стимулирующая (s) и ингибирующая (і), сопряжены с одной и той же каталитической молекулой (с). Каждая система состоит из рецептора — Ri или Rs — и регуляторного комплекса — Gs и Gі. Gs и Gi являются тримерами, состоящими из a-, ß- и у-субъединиц. По-видимому, субъединицы ß и у в обоих тримерах идентичны. Различающиеся а-субъединицы обозначают соответственно а, (мол. масса 45 000) и а, (мол. масса 41000). Связывание гормона с Rs или Ri приводит к опосредованной рецептором активации G-белка, что влечет за собой Mg2+-зависимое связывание GTP а-субъединицей с отделением от нее ß- и у-субъединиц.
![]()
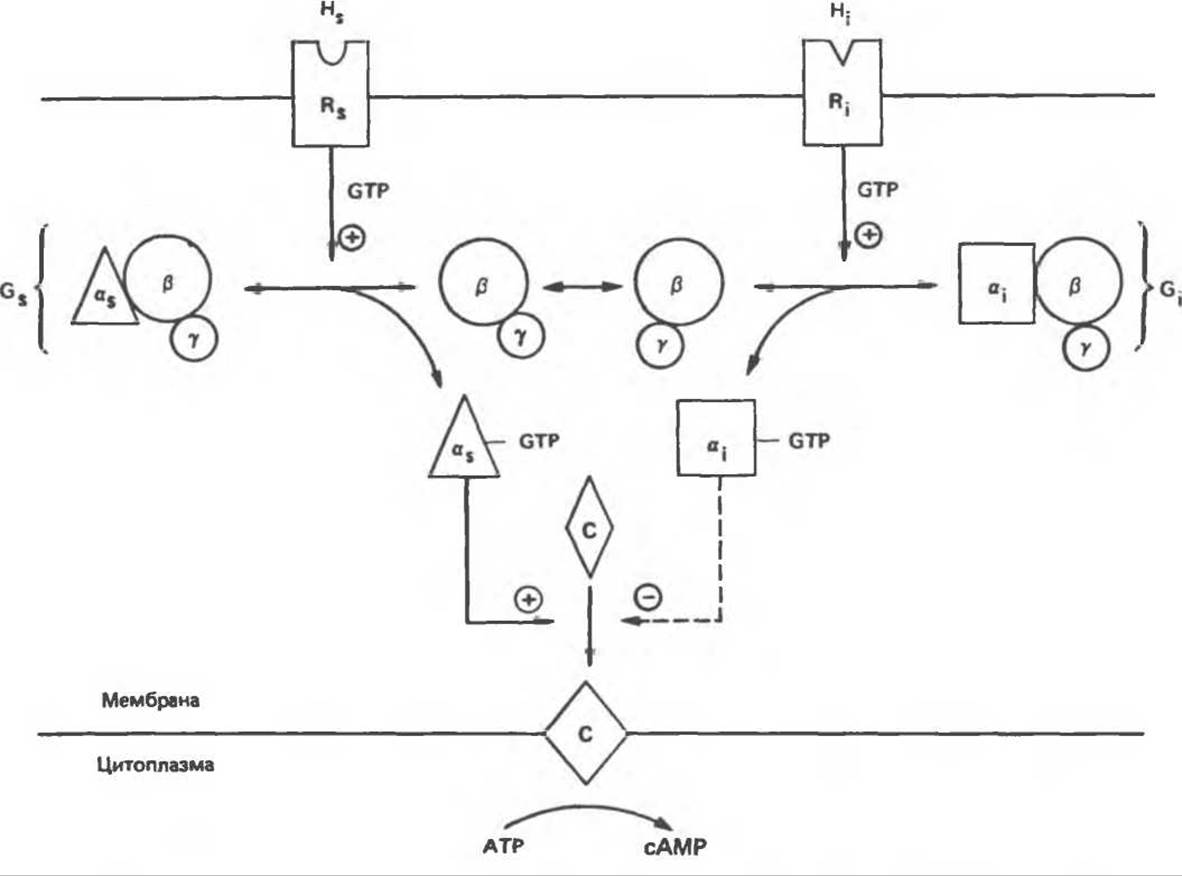
Рис. 44.3. Гормон-рецепторный сигнал (Н) передается через стимулирующий (s) и ингибирующий (і) регуляторный комплекс (Gs или Gi) и либо стимулирует, либо ингибирует активность аденилатциклазы (С). Аденилатциклаза катализирует образование сАМР из ATP. (Modified with permission from Gilman A. G. G-proteins and dual control of adenylate cyclase, Cell, 1984, 36, 577. Copyright the Massachusetts Institute of Technology.)
Субъединица as обладает вТРазной активностью; гидролиз GTP ведет к переходу ее активной формы as∙ GTP в неактивную и восстановлению тримерной структуры комплекса Gs. Действие холерного токсина — необратимого активатора аденилатциклазы — основано на том, что он вызывает ADP-рибозилирование аs-субъединицы и тем самым инактивацию GТРазы; иными словами, он фиксирует as-субъединицу в активной форме. Субъединица а, тоже является GTPaзoй; однако ее комплекс с GDP (аi ∙ GDP) плохо диссоциирует. Реактивация а, происходит путем обмена GTP на GDP. Коклюшный токсин необратимо активирует аденилатциклазу посредством ADP-рибозилирования а-субъединицы; при этом а, теряет способность активироваться. Другой необратимый активатор аденилатциклазы — NaF; судя по тому, что его эффект на белки Gs и Gi примерно одинаков, можно предположить, что он воздействует и на as-, и на аi-субъединицы.
Какова роль каждой из субъединиц — а, ß и у, — в точности пока не установлено. Можно высказать две гипотезы. Первая: as- и аi -субъединицы неконкурентно взаимодействуют с каталитическим доменом (С) аденилатциклазы, оказывая соответственно противоположные эффекты; конечный результат в этом случае зависит от соотношения активных аs и аi. Однако оказалось, что в изолированной системе активная аi-субъединица очень слабо ингибирует С. По-видимому, верна вторая гипотеза, согласно которой ß-субъединица G-белка ингибирует as; при этом субъединица аi, связывающая ß, выступает как антиингибитор аденилатциклазы, но сама по себе не обладает прямым эффектом.
Многие компоненты циклазной системы, в том числе каталитическую субъединицу, удалось получить в очищенном виде, и сейчас уже ясно, что существует целое семейство G-белков. Так, очень близки к G-белку аденилатциклазы трансдуцин (белок, участвующий в сопряжении света с фотоактивацией сетчатки глаза) и продукты ras-онкогенов; из ткани головного мозга выделен уникальный белок G0; другие, пока еще мало изученные белки этого ряда, по-видимому, участвуют в транспорте ионов кальция и калия или же метаболизме фосфоинозитидов.
Значение этих компонентов выявляется в таком «природном эксперименте» как псевдогипопаратиреоидизм. Этот синдром характеризуется гипокальциемией и гиперфосфатемией (биохимические признаки гипопаратиреоидизма) и рядом врожденных дефектов; при этом функция паратиреоидной железы не нарушена: биологически активный ПТГ секретируется в большом количестве. Однако органы-мишени этих больных резистентны к гормону из-за какого-то дефекта на пострецепторном уровне. Это может быть частичная недостаточность G-белка (вероятно, только аs-субъединицы), вследствие которой нарушено сопряжение между связыванием гормона и активацией аденилатциклазы; встречаются случаи, когда образование сАМР в ответ на действие ПТГ протекает нормальным образом, но отсутствует эффект сАМР на метаболические реакции. Не удивительно, что у больных с псевдогипопаратиреоидизмом часто наблюдается нарушение клеточного ответа и на другие гормоны, в том числе на ТСГ, глюкагон и ß-адренергические агенты.
Протеинкиназа
В прокариотических клетках сАМР связывается со специфическим белком, называемым катаболическим регуляторным белком (КРБ); этот белок связывается непосредственно с ДНК и воздействует на экспрессию генов. Аналогия между этим эффектом и описанным выше действием стероидных гормонов очевидна. В эукариотических клетках сАМР связывается с протеинкиназой — гетеротетрамерным белком, состоящим из двух регуляторных (R) и двух каталитических (С) субъединиц. Связывание сАМР протекает следующим образом:
![]()
Комплекс R2C2 лишен ферментативной активности, но при связывании сАМР с R-субъединицами происходит диссоциация R и С, и тем самым активируется С-субъединица (рис. 44.4). Последняя катализирует перенос концевой (у) фосфатной группы от ATP (Mg2+) на остаток серина или треонина в различных белках. Участками фосфорилирования обычно служат последовательности -Arg-Arg-X-Ser- и -Lys-Arg-X-X-Ser-, где X — любая аминокислота.
Первоначально были описаны две протеинкиназные активности: сАМР-завнсимая и сАМР-независимая. Однако, как видно из табл. 44.4, все оказалось значительно сложнее, поскольку фосфорилирование белков по современным представлениям — один из важнейших регуляторных механизмов. Все перечисленные в табл. 44.4 киназы представляют собой уникальные соединения, очень разнообразные по субъединичной структуре, молекулярной массе, способности к аутофосфорилированию, Км для АТР и субстратной специфичности.
Наиболее подробно изучены сАМР-зависимые протеинкиназы I и II. У этих ферментов общие С-субъединицы и разные R-субъединицы. Первоначально протеинкиназы разделили на два типа, основываясь на различии поверхностного заряда и соответственно условий элюции с ионобменной хроматографической колонки (протеинкиназа I — менее кислый белок и элюируется более слабым солевым раствором по сравнению с протеинкиназой II). В большинстве тканей присутствуют обе формы фермента, но существуют большие видовые и тканевые различия в распределении изоформы II. Как показали работы последних лет, протеинкиназы I и II по-разному отвечают на добавление определенных комбинаций аналогов сАМР; использование такого подхода позволяет определить, какая из изоформ опосредует специфический биологический ответ. Некоторые данные указывают также на то, что под действием гормонов происходит избирательная активация протеинкиназы типа I либо II.
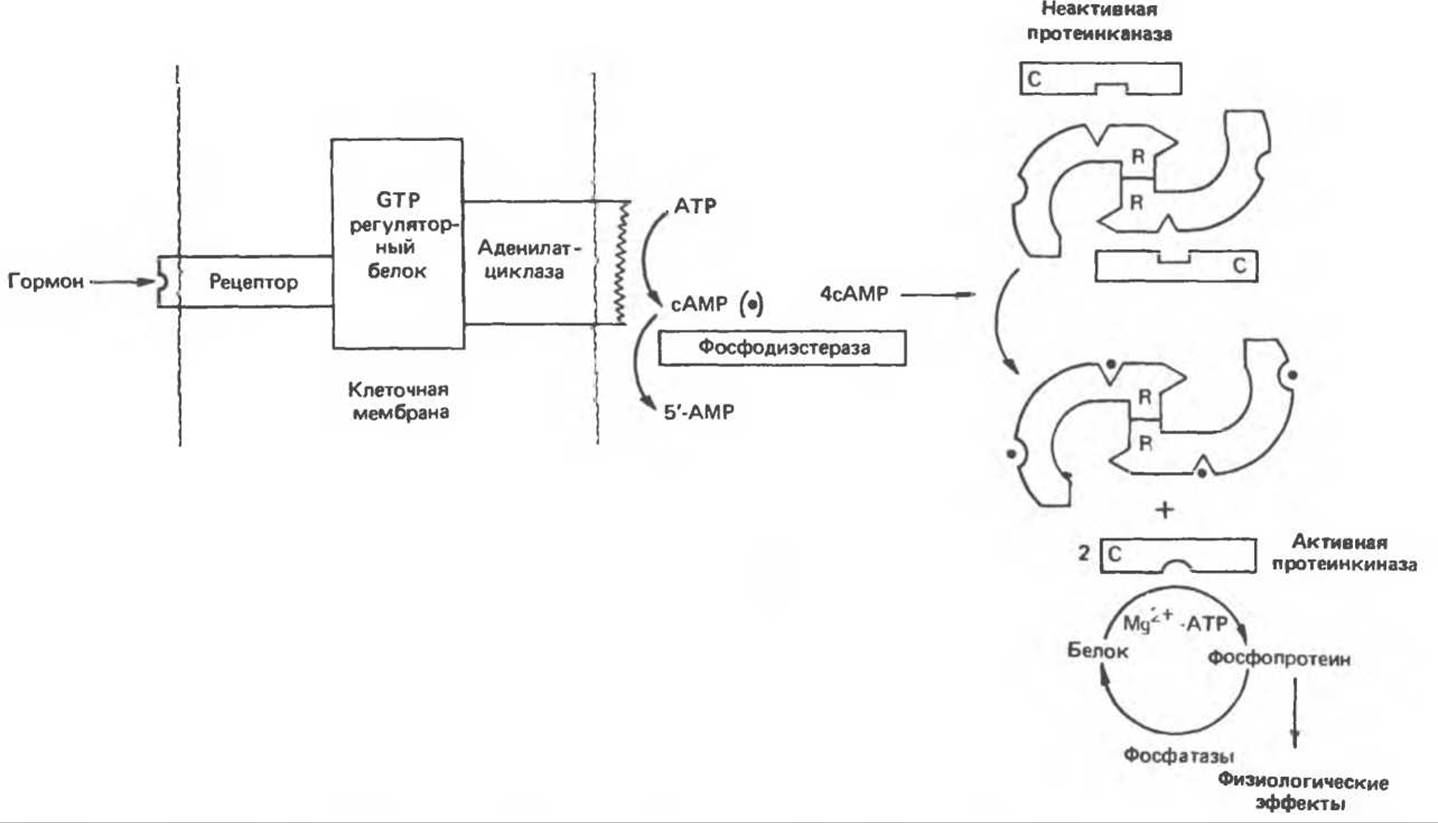
Рис. 44.4. Гормональная регуляция внутриклеточных процессов через сАМР-зависимые протеинкиназы. (Courtesy of J. Corbin.)
Таблица 44.4. Протеинкиназы, полученные в очищенном виде
|
Гормон-чувствительные Кальций/кальмодулин-зависимые киназы Кальций/фосфолипид-зависимые киназы сАМР-зависимая киназа I и II cGMP-зависимая киназа Тирозинкиназа, зависимая от фактора роста эпидермиса Киназа насекомых, зависимая от циклических нуклеотидов Инсулин-зависимая тирозинкиназа Киназа легких цепей миозина Киназа фосфорилазы Киназа пируватдегидрогеназы |
|
Гормон-чувствительность не обнаружена Киназа II казеина дц-РНК-зависимая киназа фактора элонгации 2 а Гемин-зависимая киназа фактора элонгации 2 а Киназа I, активируемая протеазой Киназа родопсина Вирусные тирозинкиназы I, II и III |
|
Предположительно гормон-чувствнтельные Киназа I казеина Киназа II, активируемая протеазой |
В действии гормонов участвуют еще несколько протеинкиназ. Роль некоторых из них показана на рис. 44.5 и в последующих разделах этой главы. Киназы, зависимые от эпидермального фактора роста и инсулина, уникальны тем, что эта ферментативная активность локализована в рецепторе гормона и проявляется при связывании лиганда с рецептором (см. гл. 51). Другая их особенность состоит в том. что они фосфорилируют преимущественно остатки тирозина, что редко встречается в клетках млекопитающих. Какую роль эти ассоциированные с рецептором киназы играют в механизме действия гормона, пока не ясно, но можно предположить, что гормон запускает каскад реакций фосфорилирования, причем один либо несколько продуктов этого каскада служат внутриклеточными посредниками.
Фосфопротеины
Все данные свидетельствуют о том, что эффект сАМР на эукариотические белки опосредован фосфорилированием — дефосфорилированием белков.
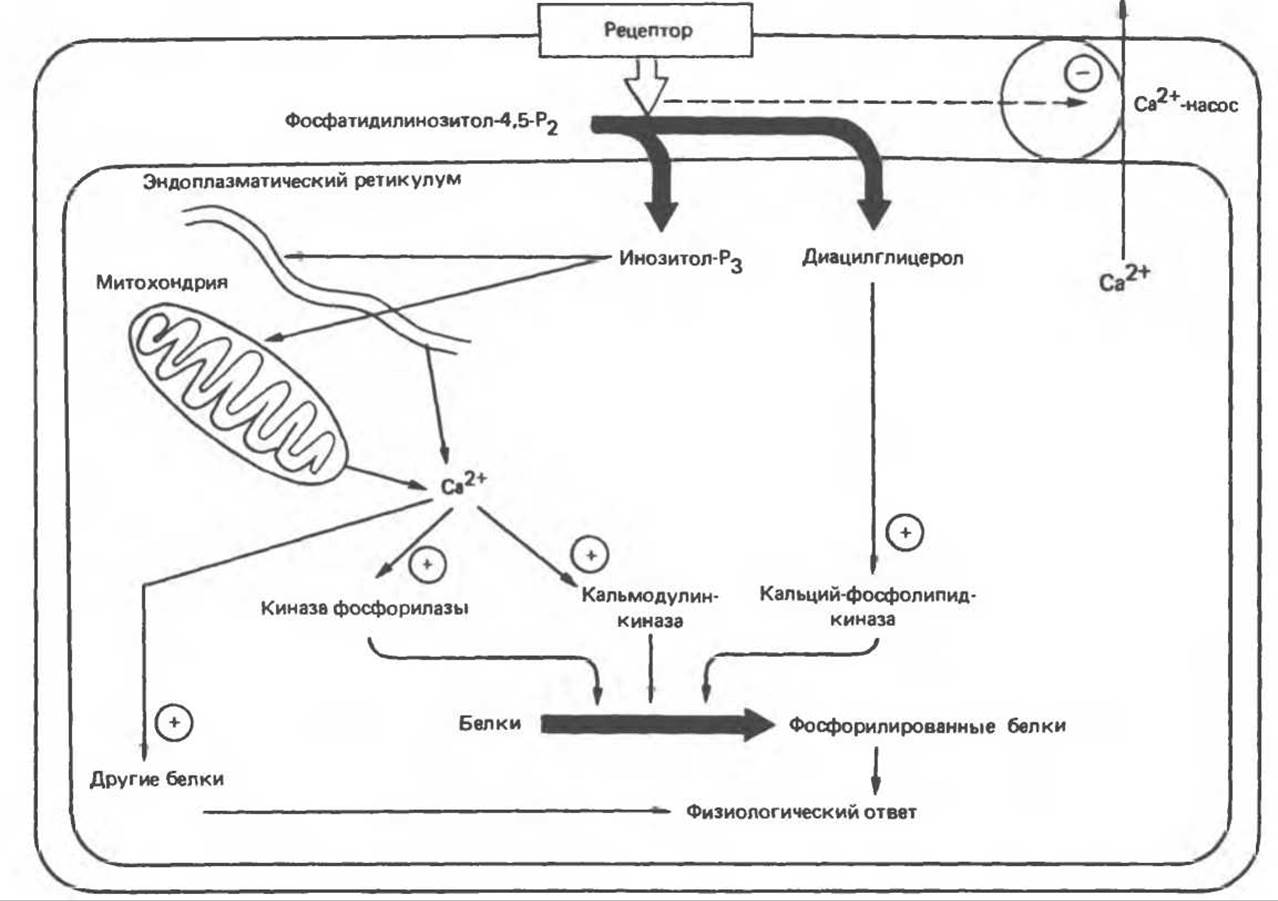
Рис. 44.5. Регуляция действия гормонов через Са2+. (Courtesy of J. Н. Exton.)
Любое воздействие с АМР, с том числе на такие разные процессы, как стероидогенез, секреция, транспорт ионов, метаболизм углеводов и жиров, индукция ферментов, регуляция генной транскрипции, рост и деление клеток, может регулироваться активностью специфической протеинкиназы или специфической фосфатазы, либо доступностью субстратов фосфорилирования. В некоторых случаях удалось идентифицировать фосфопротеины, участвующие в соответствующих метаболических последовательностях; однако для большинства перечисленных выше процессов такие фосфопротеины не обнаружены. Их определение могло бы быть полезным для выявления тканей-мишеней и было бы безусловно необходимым для количественной оценки метаболического ответа клеток. Многие белки, в том числе казеин, гистоны и протамин, могут подвергаться фосфорилированию; иногда это фосфорилирование может быть искусственным (т. е. протекающим лишь в условиях in vitro) феноменом, полезным, однако, для определения протеинкиназной активности. До последнего времени удавалось определить механизм только тех эффектов сАМР, которые имеют место вне клеточного ядра. Однако описано воздействие сАМР на транскрипцию ряда генов. Остается не ясным, связаны ли эти ядерные эффекты сАМР с фосфорилированием белков или же с участием белка типа КРБ.
Фосфодиэстеразы
Действие гормонов, опосредованное увеличением концентрации сАМР, может быть прекращено различными способами, в том числе путем гидролиза сАМР-фосфодиэстеразами. Наличие этих гидролитических ферментов обеспечивает быстрый оборот сигнального соединения (сАМР), а следовательно, и быстрое прекращение биологического процесса тотчас после удаления стимулирующего гормона. Фосфодиэстеразы сАМР существуют в двух формах: с высокой и низкой Км, и сами служат объектом регуляции со стороны гормонов, а также внутриклеточных посредников, таких как кальций, действующий, видимо, при участии кальмодулина. Ингибиторы фосфодиэстеразы, в первую очередь метилированные производные ксантина, например кофеин, увеличивают внутриклеточный уровень сАМР, тем самым воспроизводя и усиливая действие гормонов.
Фосфопротеинфосфатазы
Еще один способ контролирования эффекта — регуляция процесса дефосфорилирования белков. Фосфопротеинфосфатазы сами по себе служат объектом регуляции посредством как фосфорилирования-дефосфорилирования, так и воздействия различных веществ. Больше всего накоплено сведений о роли фосфатазы в регуляции обмена гликогена в мышцах. В этой ткани обнаружено два типа фосфопротеинфосфатаз. Тип I дефосфорилирует преимущественно ß-субъединицу киназы фосфорилазы, тогда как тип II — а-субъединицу. Активность фосфатазы I находится под контролем двух термостабильных белков-ингибиторов. Ингибитор 1 фосфорилируется сАМР-зависимой протеинкиназой; ингибитор 2, являющийся, по-видимому, субъединицей неактивной фосфатазы, также подвергается фосфорилированию — предположительно киназой-3 гликогенсинтазы. Фосфорилирование обоих ингибиторов ведет к активации фосфатазы. Действие ряда фосфатаз направлено на некоторые специфические остатки; так, существуют фосфатазы, отщепляющие фосфат от фосфорилированных остатков тирозина.
Внеклеточный сАМР
Некоторое количество сАМР выходит из клеток и может быть выявлено во внеклеточной жидкости. Так, при воздействии глюкагона на печень либо вазопрессина или ПТГ на почки повышается уровень сАМР соответственно в плазме крови и моче; на этом основано диагностическое определение чувствительности к гормону органа-мишени. У млекопитающих внеклеточный сАМР обладает слабой биологической активностью, а может быть, и вовсе лишен ее, но у прокариот и низших эукариот - это чрезвычайно важный внеклеточный посредник.
Гуанилатциклаза, cGMP, cGMP-зависимая протеинкиназа
Циклический GMP образуется из GTP под действием фермента гуанилатциклазы, которая существует в растворимой и мембраносвязанной формах. Каждый из этих изоферментов обладает собственной кинетикой, физико-химическими и антигенными свойствами. Одно время полагали, что действие cGMP функционально противоположно действию сАМР. Сейчас уже ясно, что cGMP играет специфическую роль в действии гормонов. Существует семейство пептидов, выделяемых тканью предсердий, — атриопептиды, которые вызывают выделение натрия с мочой, диурез, расширение сосудов, торможение секреции альдостерона. Эти пептиды (например, натрийуретический фактор предсердий) связываются с мембранной гуанилатциклазой и активируют ее. В результате происходит увеличение (в некоторых случаях 50-кратное) концентрации cGMP, что, по-видимому, и опосредует эти эффекты. Накоплены данные, указывающие на связь cGMP с расширением сосудов. Так, ряд соединений, в частности нитропруссид, нитроглицерин, нитрит натрия, азид натрия, вызывают расслабление гладких мышц и являются мощными сосудорасширяющими агентами; все они увеличивают содержание cGMP путем активации растворимой формы гуанилатциклазы; ингибиторы cGMP-фосфодиэстеразы усиливают и пролонгируют указанные физиологические эффекты. Повышение концентрации cGMP в клетках ведет к активации cGMP-зависимой протеинкиназы, которая в свою очередь фосфорилирует ряд белков гладкой мышцы, в частности легкую цепь миозина; в результате именно этого процесса, как считается, происходит расслабление гладких мышц и расширение сосудов.