Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Типы реакций, катализируемых ферментами
ß-Расщепление и конденсация
Присоединение енолят-иона к двуокиси углерода (реакция типа 5.В. и обратная ей реакция)
Присоединение енолят-аниона к СО2 с образованием ß-кетокислоты — один из самых распространенных способов введения СО2 в органические соединения. Обратная реакция, декарбоксилирование, представляет собой основной путь биохимического образования СО2. Константа равновесия обычно благоприятствует декарбоксилированию, однако в тех случаях, когда это необходимо (например, при фотосинтезе), реакция может протекать в сторону карбоксилирования в результате сопряжения с расщеплением АТР.
а. Спонтанное декарбоксилирование ß-кетокислот
Известно, что ß-кетокислоты, такие, как щавелевоуксусная и ацето-уксусная, неустойчивы. Их декарбоксилирование катализируется многими веществами, в том числе аминами и ионами металлов, например Zn2+, Cu2+ и Fe2+. Катализ аминами [159] отчасти связан с образованием шиффового основания. Ионы металла образуют хелат, в котором они облегчают отрыв электрона от лабильной связи С—С с образованием енолят-аниона [160]:
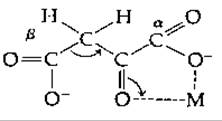
Можем ли мы применить, исходя из этой информации, полученной при исследовании неферментативного катализа, выводы о механизме для ферментативного катализа реакции декарбоксилирования? Некоторые декарбоксилазы действительно образуют шиффовы основания со своими субстратами, а важная группа декарбоксилаз (содержащих витамин биотин) содержит также связанные ионы Мn2+.
б. Ацетоацетатдекарбоксилаза
При брожении, осуществляемом Clostridium acetobutylicum и приводящем к образованию ацетона (гл. 9, разд. Е,4), необходимы большие количества фермента, катализирующего декарбоксилирование ацетоацетата:
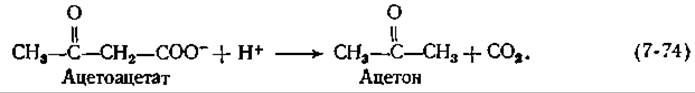
Этот фермент (с мол. весом ~ 340 000), построенный из 12 субъединиц, был получен в кристаллическом виде [161]. Он инактивируется боргидридом натрия в присутствии субстрата; при кислотном гидролизе инактивированного фермента образуется ε-N-изопропиллизин. Декарбоксилирование, вероятно, протекает через промежуточное образование шиффова основания по механизму, аналогичному механизму, предложенному для альдольного расщепления (рис. 7-10).
в. Сопряженное окисление и декарбоксилирование
Окисление β-оксикислот в ß-кетокислоти с последующим декарбоксилированием — широко распространенный метаболический путь. Обе стадии обычно катализируются одним и тем же ферментом. Образования свободных ß-кетокислот как промежуточных продуктов этих реакций не происходит, но связанные ß-кетокислоты, возможно, образуются. (Возможно также сочетанное протекание реакций декарбоксилирования и дегидрирования). Малатдегидрогеназа (декарбоксилирующая), или иначе «яблочный фермент», которая катализирует превращение L-Maлата в пируват, обнаружена в тканях многих организмов:
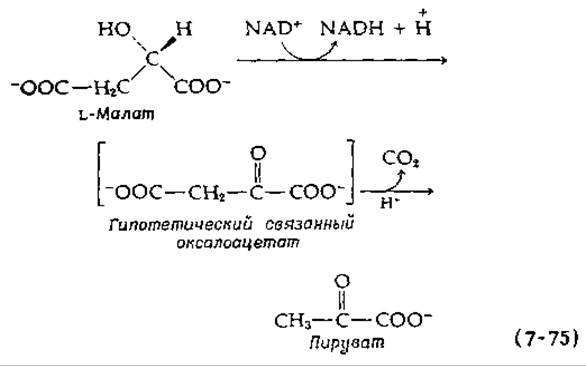
Начальная стадия дегидрирования включает перенос водорода к NAD+(рис. 8-10). Другие реакции этого типа — окисление изоцитрата в а-кетоглутарат в цикле трикарбоновых кислот (рис. 9-2, стадия б и в) и окисление 6-фосфоглюконата в рибулозо-5-фосфат [реакция (9-12)].
г. Фосфоенолпируват — ключевое промежуточное соединение
Эфир фосфорной кислоты енольной формы пирувата, обычно называемый просто фосфоенолпируватом (РЕР),
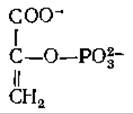
занимает центральное положение в метаболизме. Фосфоенолпируват образуется в результате дегидратации 2-фосфоглицерата [уравнение (7-46)] в гликолитическом пути или в результате декарбоксилйрования оксалоацетата. Это соединение используется во многих реакциях метаболизма, выступая в роли исходного енола, дающего начало реакционноспособному енолят-иону, участвующему в реакциях конденсации. Его место в метаболизме будет рассмотрено более полно в последующих главах, а в этой главе мы обсудим те превращения, которые приводят к образованию фосфоенолпирувата в результате декарбоксилирования оксалоацетата. Эта реакция, играющая в метаболизме животных, других высших организмов и бактерий первостепенную роль, катализируется фосфоенолпируват-карбоксикиназой. Молекула гуанозинтрифосфата или инозинтрифосфата захватывает и фосфорилирует енолят-анион, образующийся при декарбоксилировании:
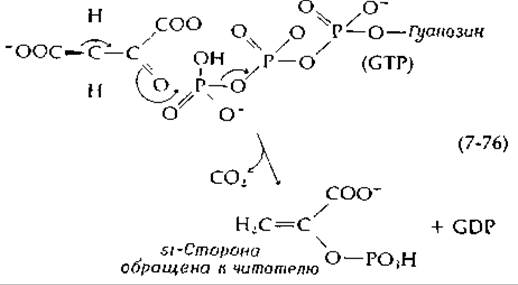
Стереохимия этой реакции такова, что СO2 отщепляется с si-стороны образующегося енола. Другой фермент, фосфоенолпируват-карбокси-трансфераза, катализирует следующую реакцию декарбоксилирования:
![]()
Этот фермент обнаружен только в клетках пропионовокислых бактерий и у Entamoeba. По-видимому, этот фермент обычно функционирует в обратном направлении, обеспечивая в этих организмах синтез оксалоацетата из фосфоенолпирувата. Гидролиз образующегося пирофосфата, очевидно, «тянет» реакцию в требуемом направлении [162].
Оксалоацетат может также подвергаться ферментативному декарбоксилированию в пируват [см. реакцию (9-8)], протекающему, вероятно, через образование енолят-аниона, но без стадии фосфорилирования, изображенной на схеме (7-76). Фермент пируваткиназа (гл. 9, разд. Д,1), который обычно катализирует образование пирувата в енольной форме, по-видимому, идентичен оксалоацетатдекарбоксилазе [162а].
д. Двуокись углерода или бикарбонат-ион?
При рассмотрении реакций карбоксилирования и декарбоксилирования возникает вполне уместный вопрос: является ли исходным реагентом (или продуктом) СO2 или НСО-3? Первую попытку ответить на этот вопрос сделали Кребс и Рафтон [163], показавшие, что равновесие между свободным СO2 и НСО3:
![]()
устанавливается не мгновенно, а на протяжении нескольких секунд. Если какой-либо фермент катализирует образование СO2 в качестве продукта реакции, то, следя за реакцией манометрически, можно увидеть, что давление нарастает, постоянно превышая равновесное значение соответственно количеству выделяющегося СO2. Однако позднее, когда весь субстрат будет израсходован и между СO2 и НСО-3 установится равновесие, давление вновь уменьшается. Этот «перехлест» можно устранить добавлением карбоангидразы, катализирующей реакцию (7- 78,а). Если бы первичным продуктом реакции декарбоксилирования был бикарбонат, то на кривых, описывающих кинетику накопления свободного СO2, должен был появиться лаг-период.
Второй подход к изучению обсуждаемой проблемы заключается в использовании 18O-бнкарбоната и регистрации включения 18O в карбоксилированный субстрат. Если первичным субстратом служит СO2, то в образующееся соединение войдут только два меченых атома кислорода, если же реакция начинается с НСО-3 — три атома кислорода [164]. Третий подход заключается в измерении скоростей включения СO2 и бикарбоната в продукт карбоксилирования. На протяжении короткого интервала времени (порядка 1 мин) кинетика включения СO2 и бикарбоната будет различной [165].
При помощи этих методов было установлено, что продуктом реакций (7-76) и (7-77) является СO2. Между тем другие ферменты карбоксилирования, рассматриваемые в следующем разделе, используют в качестве субстрата бикарбонат.
е. Включение бикарбоната в карбоксильные группы
Фосфоенолпируват-карбоксилаза, катализирующая реакцию является важным ферментом, выполняющим биосинтетические функции у многих бактерий и растений. Этот фермент фактически катализирует реакцию, обратную той, которая описывается уравнением (7-76), превращая трехуглеродную молекулу фосфоенолпирувата в содержащий четыре атома углерода оксалоацетат. Последний необходим для «запуска» цикла трикарбоновых кислот и для биосинтеза таких аминокислот, как аспартат и глутамат. О наличии именно такого механизма действия этого фермента свидетельствует тот факт, что мутант Salmonella, в котором образования этого фермента не происходит, не растет до тех пор, пока в среду не будет добавлен оксалоацетат либо другое промежуточное соединение цикла трикарбоновых кислот. Фермент из S. typhimurium представляет собой тетрамер с мол. весом ~400 000 и обладает сложными регуляторными свойствами. Соответствующий фермент из шпината состоит из 12 субъединиц и содержит 12 связанных ионов Мn2+. Этот фермент выполняет особые функции в так называемых C4-растениях, где он участвует в работе систем, концентрирующих двуокись углерода (гл. 13, разд. Д,9, в).
![]()
В том случае, когда роль субстрата выполняет 18О-бикарбонат, два меченых атома кислорода появляются в оксалоацетате, тогда как третий — в Рі. Возможный механизм реакции показан на следующей схеме (атомы 18O обозначены звездочками):
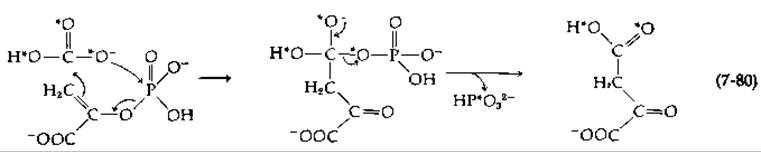
Карбоксильная группа присоединяется с si-стороны молекулы фосфоенолпирувата.
Фосфоенолпируват-карбоксилаза не встречается в тканях животных и в грибах. В этих объектах фосфоенолпируват превращается в пируват, который затем карбоксилируется с образованием оксалоацетата в реакции, сопряженной с расщеплением АТР. Фермент, катализирующий образование оксалоацетата, пируваткарбоксилаза, отличается не только тем, что использует в качестве субстрата бикарбонат, но и тем, что содержит в активном центре связанный витамин биотин (гл. 8, разд. В). Тем не менее существует сходство в механизме действия этого фермента и фосфоенолпируват-карбоксилазы [сравни уравнение (7-80) и (8-6)].
ж. Рибулозодифосфат-карбоксилаза
При поглощении хлоропластами СО2, меченного 14С, первым органическим соединением, в котором обнаруживается радиоактивная метка, оказывается 3-фосфоглицерат. Две молекулы этого соединения образуются под действием присутствующего в хлоропластах фермента рибулозо-1,5-дифосфат — карбоксилазы (в листьях шпината его содержание составляет 16% общего количества белка). Этот фермент содержится в зеленых растениях, а также в пурпурных и зеленых бактериях. Реакция, катализируемая данным ферментом, отличается от других реакций карбоксилирования тем, что продукт карбоксилирования расщепляется тем же самым ферментом. Структура субстрата, к которому фермент проявляет абсолютную специфичность, не допускает образования наблюдаемого продукта путем прямого ß-карбоксилирования. На основании косвенных доказательств было сделано предположение о реализации следующего механизма:
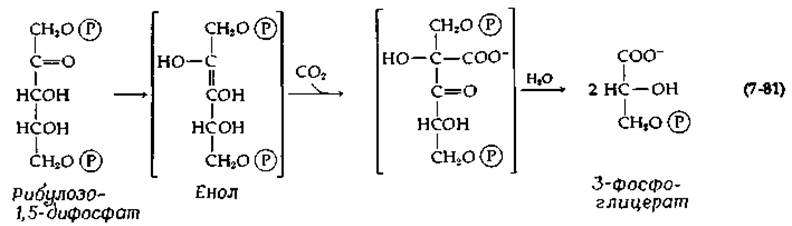
Рибулозодифосфат превращается в енол (или, возможно, в 3-кетосоединение). При отщеплении протона от 3-ОН-группы образуется енолят-анион, необходимый для осуществления стадии карбоксилирования. Первым продуктом карбоксилирования [второе промежуточное соединение, поставленное в уравнении (7-81) в скобки] является ß-кетокислота. Было показано [166], что она подвергается ферментативному гидролизу в соответствии с уравнением (7-61). В пользу этого механизма свидетельствует тот факт, что карбоновая кислота, имеющая следующее строение:
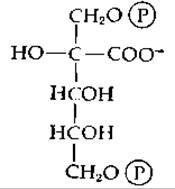
является сильным ингибитором рибулозо-1,5-дифосфат — карбоксилазы (возможно, аналогом переходного состояния) [167].
Рибулозодифосфат-карбоксилаза шпината имеет мол. вес ~ 560 000 и содержит восемь пар неидентичных субъединиц и восемь активных центров. Она требует присутствия двухвалентного металла, например Mg2+. КМ для суммарной концентрации СО2 ([СО2] + [НСО-3 ]) имеет очень высокое значение (11—30 мМ). Значение КМ для истинного субстрата (СО2) составляет только 0,45 мМ. В интактных хлоропластах сродство к субстрату значительно выше: КМ для суммарного содержания СО2 падает до ~0,6 мМ. По-видимому, в какой-то мере это различие является результатом аллостерической активации, осуществляемой в хлоропластах фруктозо-6-фосфатом и рибозо-5-фосфатом [168, 169].
Хорошо известно, что О2 ингибирует фотосинтез в большинстве растений. Частично это связано с тем, что О2 прямо конкурирует за СО2 в активном центре рибулозодифосфат-карбоксилазы [169, 170]. В присутствии ингибирующих количеств кислорода в хлоропластах в относительно больших концентрациях образуется гликолевая кислота [171]. Единственной реакцией, приводящей к ее возникновению, является, по-видимому, взаимодействие енолят-иона, образующегося из промежуточного соединения реакции (7-81), с О2:
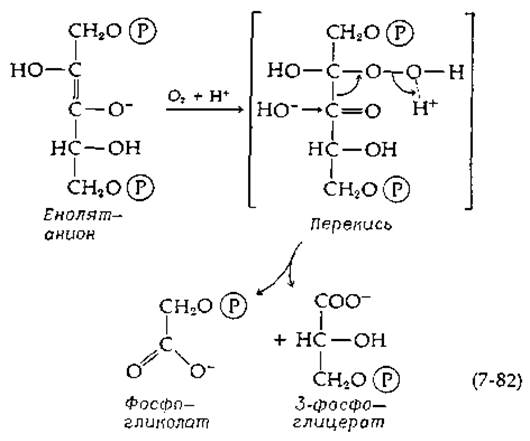
Образующаяся перекись расщепляется при гидролитическом действии фермента до фосфогликолата и 3-фосфоглицерата. Несмотря на то что это предположение является общепринятым, оно все же кажется неубедительным. Молекулярный кислород обычно не способен быстро реагировать с органическими субстратами (известны лишь Немногие исключения, например дигидрофлавины; гл. 8, разд. И, 7), если не считать тех случаев, когда в реакции участвуют ионы переходных металлов (гл. 10, разд. Б,3). Дальнейшее исследование необычной реакции, катализируемой рибулозодифосфат-карбоксилазой, несомненно, представит большой теоретический и практический интерес; последний связан с тем, что эта реакция имеет большое значение в снижении выхода фотосинтеза (гл. 13, разд. Д, 9).