Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
АТР и нуклеотидные «ручки»
Роль АТР в функционировании биосинтетических реакций рассматривалась в гл. 7 (разд. Е); при этом внимание было сосредоточено целиком на полифосфатной группе, которая подвергается расщеплению.
Что же можно сказать об аденозиновом фрагменте? Здесь налицо изящная структура, заимствованная у нуклеиновых кислот. Какова ее функция в АТР как переносчика фосфатных групп молекулы АТР? По крайней мере частично ответ заключается, по-видимому, в том, что аденозинмонофосфатный фрагмент (АМР) молекулы является «ручкой», за которую могут «ухватиться» белки — катализаторы:
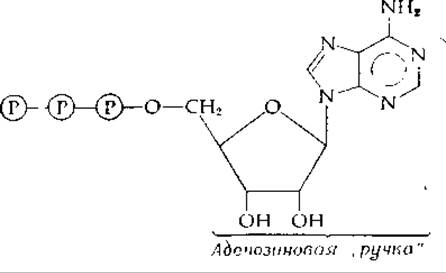
В случае ацетат-тиокиназы [уравнение (7-30)] «ручка» играет важную роль, удерживая промежуточно образующийся ациладенилат в прочно связанном с белком состоянии. Это вряд ли было бы возможно без участия большой аденозиновой группы.
АМР является только одной из «ручек», к которым природа прикрепляет фосфатные группы, образуя ди- и трифосфатные производные. Подобно АМР, другие «ручки» также являются нуклеотидами, мономерными единицами нуклеиновых кислот. Таким образом, один фермент, нуждающийся в полифосфате как источнике энергии, избирает АТР, а другой — СТР или GTP. Следует добавить, что нуклеотидные «ручки» несут не только фосфатные группы, а представлены и в других коферментах, например в СоА, NAD+, NADP+ и FAD. К тому же они часто являются переносчиками различных небольших органических молекул. В этом случае последние становятся активными метаболитами, такими, как уридиндифосфатглюкоза (UDP-глюкоза или UDPG), участвующая в метаболизме сахаров (гл. 11, разд. Д, 1,6), и цитидиндифосфатхолин, промежуточное соединение в синтезе фосфолипидов [уравнение (11-26)].
Если вспомнить, что ацетиладенилат (ацетил-АМР) образуется как промежуточное соединение при синтезе ацетил-СоА, и сравнить между собой биосинтез сахаров, фосфолипидов и ацетил-СоА, то увидим, что в каждом случае фермент, принимающий участие в биосинтезе, проявляет специфичность к определенной нуклеотидной «ручке». Последняя обеспечивает способы узнавания, посредством которых фермент может отбирать нужное количество «сырья» в окружающем его море молекул. Конечно, наличие «ручки» не единственное условие, предъявляемое к молекуле, которая отбирается ферментом, так как соответствовать структуре фермента должна вся молекула субстрата в целом, а не только его «ручка».
На рис. 2-21 показана структура четырех пуриновых и пиримидиновых оснований, образующих большинство обычных нуклеотидных «ручек». Контуры представляют поверхности контакта, задаваемые вандерваальсовыми радиусами, а стрелки показывают некоторые из направлений, в которых могут образовываться водородные связи с соседними группами. Отличительные особенности четырех оснований как с точки зрения геометрической формы, так и сточки зрения возможного расположения водородных связей сразу становятся очевидными. При связывании с белками группы пуриновых и пиримидиновых оснований, участвующие в образовании водородных связей, могут взаимодействовать с группами белковой молекулы, занимающими строго определенное положение. Рибозное или дезоксирибозное кольцо содержит дополнительные группы, способные к образованию водородных связей с белком, а отрицательно заряженные кислородные атомы 5'-фосфата могут взаимодействовать с положительно заряженными боковыми группами белковой молекулы.
Являются ли нуклеотидные «ручки» инертными группами с неизменяющейся формой или они могут активно участвовать в каких-либо химических процессах? Биохимики редко задают себе этот вопрос. Возможно, это объясняется тем, что пока у нас нет данных, свидетельствующих о непосредственном участии «ручки» в катализе. Однако в биохимии мы всегда должны быть готовы к сюрпризам, и может оказаться, что «ручки» участвуют в катализе так же, как и традиционные «рабочие» фрагменты коферментов.