Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Пиридиннуклеотидные коферменты и дегидрогеназы
Алкогольдегидрогеназы
Многие дегидрогеназы представляют собой димеры или тетрамеры, построенные из субъединиц с мол. весом 20 000—40 000, но некоторые из них имеют большие размеры. Для нескольких дегидрогеназ проведено полное определение структуры методом рентгенодифрактометрии. Структура лактатдегидрогеназы акулы известна с разрешением до 0,2 нм [72, 73]. Фермент является тетрамером с мол. весом 140 000. Кофермент охватывает один из концов белковой цепи, принимая конформацию, подобную букве С, причем никотинамидное кольцо располагается во впадине (рис. 8-12). Время жизни фермент-субстратного комплекса очень мало, что исключает возможность его прямого наблюдения. Однако определенное заключение о его структуре можно сделать, исходя из данных, полученных при изучении структуры комплексов фермента с различными ингибиторами, например аддукта дегидрогеназы с NAD+ и пируватом [реакция (8-47) [73]. Таким путем была установлена структура активного центра лактатдегидрогеназы (рис. 8-12). На этом рисунке L-лактат изображен в ориентации, благоприятной для переноса гидрид-иона со стороны А никотинамидного кольца. Ионизированная карбоксильная группа лактата удерживается и нейтрализуется гуанидиниевой группой остатка Arg-171, а положение His-195 обеспечивает выполнение им функции общего основного катализатора, отнимающего протон от гидроксильной группы субстрата.
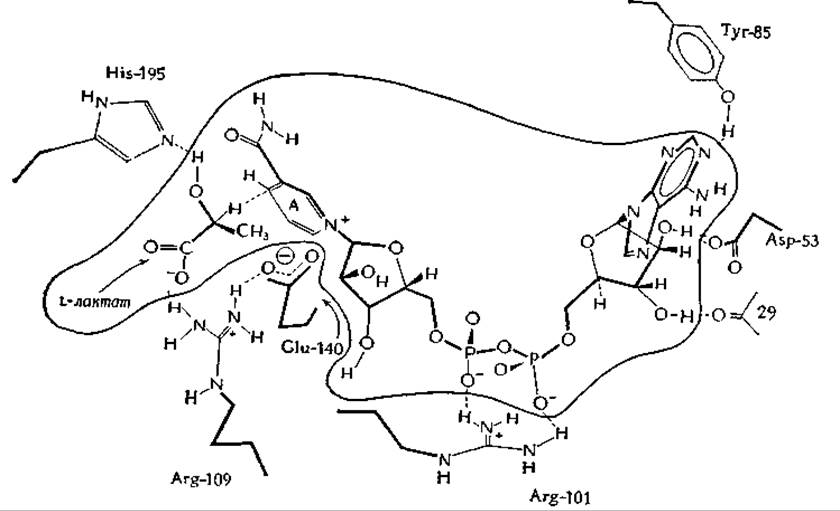
РИС. 8-12. Схематическая диаграмма связывания NAD и L-лактата в активном центре лактатдегидрогеназы. Согласно Адамсу и др. [73, 74].
По-видимому, происходит ряд любопытных взаимодействий с боковыми цепями белка. Так, например, отрицательно заряженная боковая цепь глутамата-140 нейтрализует положительный заряд NAD+. На основании исследования модельной реакции предполагается, что это взаимодействие важно для функционирования фермента. Восстановление N-метилакридиний-иона производным дигидроникотинамида следующего строения:
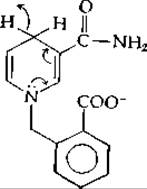
в растворе акрилонитрила протекает значительно быстрее, чем восстановление аналогичным соединением, не содержащим карбоксилат-иона [74].
Даже до того, как стала известна структура кристаллической лактатдегидрогеназы, отсутствие pH-зависимости связывания кофермента в интервале pH от 5 до 10 наряду с наблюдавшейся инактивацией фермента бутандионом позволило предположить, что пирофосфатная группа NAD+ связывается с гуанидиниевой группой бокового радикала аргинина [75]. Рентгеноструктурные исследования показывают, что эту функцию осуществляет Arg-101 (рис. 8-12). Несколько неожиданным оказалось то, что аминогруппа аденина не образует водородной связи с белком. Аденин скорее всего заключен в гидрофобной щели, а его аминогруппа контактирует с растворителем.
К числу дегидрогеназ, структура которых в настоящее время уже установлена, относятся малатдегидрогеназа [76], неспецифическая алкогольдегидрогеназа печени [77] и глицеральдегид-3-фосфат—дегидрогеназа (разд. 3,5). Следует отметить, что во всех этих трех дегидрогеназах и в лактатдегидрогеназе имеется примерно одинаковый структурный фрагмент, состоящий из шести плотно упакованных параллельных ß-цепей и нескольких а-спиральных участков [77, 78, 78а] (рис. 2-10А). Эта структура, связывающая кофермент, возможно, специально приспособлена к взаимодействию с NAD; в несколько измененной форме она представлена в ряде других ферментов [78а]. Алкогольдегидрогеназа печени [77] и некоторые другие дегидрогеназы содержат существенный атом Zn2+, способный, вероятно, координационно связывать гидроксильную группу спиртового субстрата или карбонильную группу альдегидного субстрата [786].