Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Флавиновые коферменты
Флавинадениидинуклеотид (FAD) и рибофлавии-5'-фосфат (FMN, рис. 8-14), возможно, самые универсальные среди всех окислительных коферментов. Термин флавинадениидинуклеотид в сущности не совсем правомерен, поскольку D-рибитильная группа не образует с рибофлавином гликозидной связи; следовательно, данная молекула не является динуклеотидом. Однако этот термин прочно вошел в обиход. Флавинмононуклеотид (FMN) — еще менее подходящее обозначение рибофлавин-5-фосфата.
Роль рибофлавина в биологическом окислении была установлена в результате большого интереса биохимиков к процессам дыхания клетки. В 20-х годах Варбург обнаружил, что кислород реагирует с каким-то железосодержащим катализатором дыхания. Позже было показано, что краситель метиленовый синий часто может замещать кислород в качестве окислителя. Окисление в эритроцитах глюкозо-6-фосфата метиленовым синим требовало присутствия как «фермента», так и «кофермента», позднее идентифицированного как NADP+. Было установлено, что выделенный из дрожжей желтый белок обладает примечательным свойством обесцвечиваться под действием восстановительной системы, содержащей глюкозо-6-фосфат, белок и «кофермент» из эритроцитов.
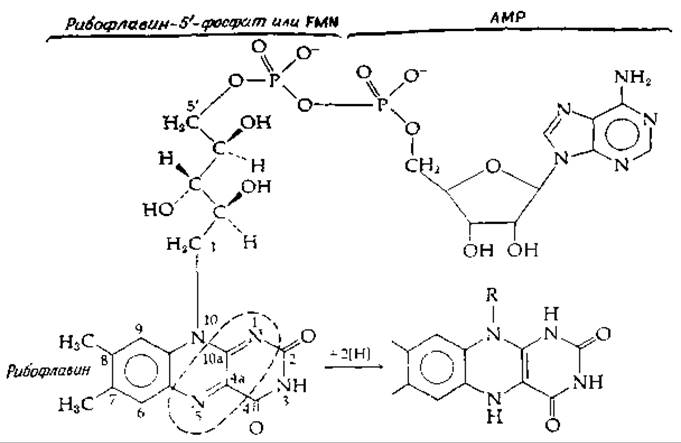
РИС. 8-14. Флавиновые коферменты FAD и рибофлавин-5'-фосфат. Пунктиром обозначен участок, структура которого изменяется при восстановлении Отметим, что ранее в литературе использовалась другая нумерация изоаллоксазинового кольца Ныне рибофлавин именуют 7,8-диметил-10-(1'-D-рибитил)-изоаллоксазином; старое наименование 6,7-диметил-9-(1'-D-рибитил)-изоаллоксазин. Положение 5 ранее имело номер 10.
Варбург и Кристиан показали, что желтая окраска этого так называемого «старого желтого фермента» обусловлена пигментом флавинового типа, и предположили, что его циклическое восстановление и реокисление играют важную роль в клеточном окислении. После того как NADP+ был выделен, это представление было расширено и вылилось в концепцию дыхательной цепи. Согласно этой концепции, два переносчика водорода, NADP+ и флавин, функционируют последовательно, подключая дегидрирование глюкозы к железосодержащему катализатору, который взаимодействует с кислородом. Сейчас показано, что «старый желтый фермент» был одной из форм дигидролипоилдегидрогеназы (разд. К, 2), которая на самом деле не принимает электронов от NADPH; тем не менее концепция о дыхательной цепи была правильна.
Теорелл в Стокгольме показал, что «старый желтый фермент» содержит рибофлавин-5'-фосфат. К 1938 г. было установлено, что FAD является коферментом еще одного желтого белка, оксидазы D-аминокислот из тканей почки. Подобно пиридин-нуклеотидам, новые флавиновые коферменты восстанавливались дитионитом практически в бесцветную дигидроформу (рис. 8-14 и 8-15). Таким образом, химическая основа функционирования их в качестве переносчиков водорода была очевидной.
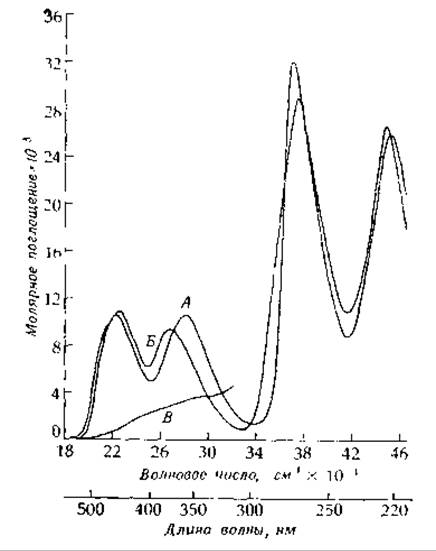
РИС. 8-15. Спектры поглощения рибофлавина (А), рнбофлавинаниона (Б) и дигидроформы (В), полученные восстановлением под действием света в присутствии ЭДТА 1,1∙10-4 М раствор рибофлавина, содержащий 0,01 М ЭДТА, освещали лампой накаливания мощностью 40 вт, расположенной на расстоянии 11,5 см от раствора, в течение 30 мин.
Три факта объясняют потребность клетки как во флавиновых, так и в пиридиннуклеотидных коферментах. Во-первых, обычно флавины являются более сильными окислителями, чем NAD+. Это делает их пригодными для функционирования в цепи переноса электронов в митохондриях, где требуется последовательность все более и более сильных окислителей, и делает их идеальными окислителями при различных других реакциях дегидрирования. Во-вторых, флавины можно восстанавливать как в одно-, так и в двухэлектронных процессах. Это позволяет им участвовать в окислительных реакциях со свободными радикалами и в реакциях с ионами металлов. В-третьих, восстановленные флавины доступны быстрому прямому реокислению молекулярным О2 (т. е. аутооксидабельны) — свойство, присущее лишь относительно немногим другим органическим соединениям. Например, NADH и NADPH самопроизвольно не окисляются кислородом. «Самоокисляемость» позволяет флавинам некоторых ферментов переносить электроны непосредственно к О2, а также создает основу для функционирования флавинов в реакциях гидроксилирования.
Дополнение 8-И
Рибофлавин
Внимание химиков сначала привлекли интенсивная оранжево-желтая окраска и яркая зеленоватая флуоресценция рибофлавина. Блайт в 1879 г. выделил витамин из молочной сыворотки, а затем другие ученые получили это же флуоресцирующее желтое соединение из куриных яиц, мышцы и мочи. В конце концов была установлена идентичность всех этих соединений, которые из-за своего желтого цвета были названы флавинами.
Структуру рибофлавина установили в 1933 г. Кун и его сотрудники, выделившие 30 мг чистого вещества из 30 кг сухого яичного белка (10 000 яиц). Высокая флуоресцирующая способность рибофлавина была использована при проведении последних стадий очистки. Этот витамин был синтезирован в 1935 г. Каррерам.
Рибофлавин — желтое твердое вещество, плохо растворяется (— 100 мг/л при 25°С). Известны три кристаллические формы рибофлавина. Одна из них («легко растворимая форма») растворяется в 10 раз лучше, чем другие формы, и ее можно использовать для приготовления метастабильных растворов с более высокой концентрацией. Одна из форм кристаллизуется в виде пластинок и встречается в природе в тапетуме (см. дополнение 7-Е) ночного лемура.
Суточная потребность: около 2 мг в день. Вследствие широкого распространения рибофлавина в продуктах питания у людей редко наблюдается его недостаточность, при которой в первую очередь поражаются глаза и кожа. В промышленности большие количества рибофлавина получают при помощи грибов (таких, как Eremothecium ashbyi), которые, по-видимому, из-за каких-то нарушений метаболизма, вырабатывают витамин в таком изобилии, что он кристаллизуется в культуральной среде.
Рибофлавин тремостабилен, но чрезвычайно чувствителен к действию света — обстоятельство, важное для правильной организации питания. Не оставляйте молоко на ярком солнечном освещении (см. рис. 2-34)!