Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Флавиновые коферменты
Типичные реакции дегидрирования, катализируемые флавопротеидами
Функции флавопротеидов столь многочисленны (в сводке 1970 г. перечислены 45 различных флавопротеидов [98]) и столь разнообразны, что о них написаны целые книги [99]. Здесь мы можем рассмотреть лишь несколько таких ферментов. Флавинсодержащие ферменты катализируют окисление полуацеталей в лактоны (реакция а в табл. 8-4), спиртов в альдегиды (реакция б) и аминов в имины (реакция в). Они окисляют карбонильные соединения или карбоновые кислоты в а,β-ненасыщенные карбонильные соединения (реакция г), а в цепях переноса электронов флавопротеиды окисляют NADH и NADPH (реакция д). Ряд флавопротеидов окисляет дитиолы в дисульфиды (реакция е).
Первые три из этих реакций могли бы с таким же успехом катализироваться дегидрогеназами, зависимыми от пиридиннуклеотидов. Вспомним, что D-глюкозо-б-фосфат — дегидрогеназа использует в качестве окислителя NADP [реакция (8-42)]. Первым продуктом является лактон, который гидролизуется до 6-фосфоглюконовой кислоты. Аналогичная реакция со свободной глюкозой (реакция а в табл. 8-4) катализируется глюкозооксидазой — флавопротеидом с мол. весом — 154 000, который содержит две молекулы FAD и синтезируется Penicillium nоtatum и другими грибами. Растительный фермент, гликолатоксидаза (димер, содержащий рибофлавин-5'-фосфат), катализирует реакцию б (табл. 8-4). Хорошо известны две оксидазы аминокислот (реакция в). Одна из них, специфичная к D-амииокислотам и выделенная из почек, была тем источником, из которого Варбург впервые выделил FAD; ее мол. вес составляет ~ 38 000 [100]. Яды многих змей содержат очень активную оксидазу L-аминокислот с мол. весом 140 000, которая содержит две молекулы FAD. Аминоксидазы катализируют родственную реакцию, в которой азот замещен и присутствия в субстрате карбоксильной группы не требуется. Во всех этих случаях образующийся восстановленный флавин вновь окисляется молекулярным кислородом, и одним из продуктов реакции является перекись водорода. Природа здесь обошлась без использования цепи переноса электронов, отказавшись от возможности приобретать АТР в пользу простой прямой реакции с кислородом. В некоторых случаях образование Н2О2 может иметь для организма особое значение.
Таблица 8-4 Некоторые типичные реакции дегидрирования катализируемые флавопротеидами
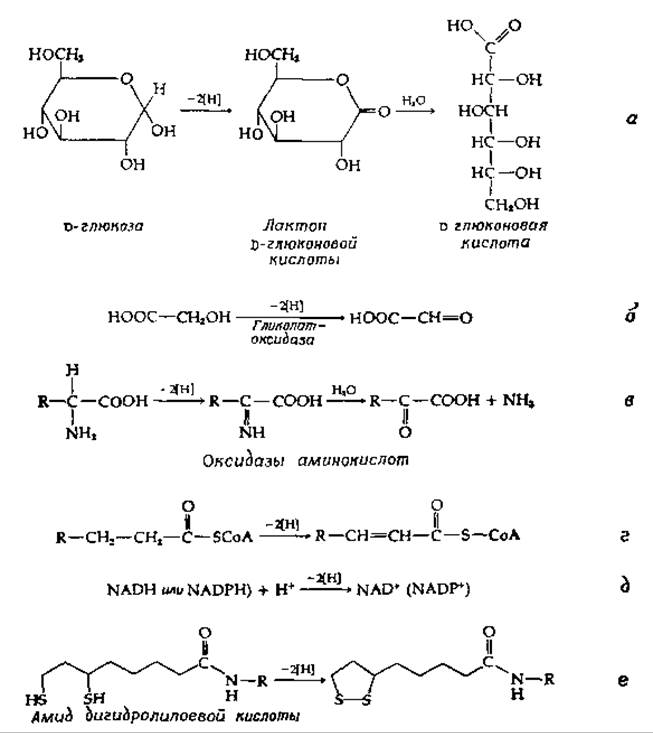
Реакция г в табл. 8-4, напротив, не может быть осуществлена системой пиридиннуклеотидов вследствие неподходящего восстановительного потенциала. Необходима более сильная окисляющая система флавинов. (Однако обратная реакция, гидрирование связи С = С, часто протекает в биологических системах с участием восстановленного пиридиннуклеотида.) Реакции типа г имеют важное значение в энергетическом метаболизме аэробных клеток. Так, например, первой окислительной стадией при ß-окислении жирных кислот (гл. 9, разд. А, 1) является а,β-дегидрирование ацил-СоА-производных жирных кислот. Аналогичной реакцией, протекающей в цикле трикарбоновых кислот, является дегидрирование сукцината в фумарат:
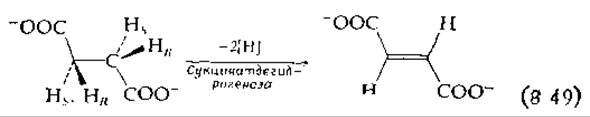
Дегидрирование происходит путем транс-удаления одного из пpo-S-водородов и одного из про-R-водородов [101]. Ни сукцинатдегидрогеназа, ни дегидрогеназы ацил-СоА-производных жирных кислот не реагируют с O2. Восстановленные флавины передают свои электроны в цепь переноса электронов в митохондриях.
NADH- и NADPH-дегидрогеназы митохондрий (реакция д в табл. 8-4) также связаны с кислородом, но опосредованно — через ряд железосодержащих катализаторов, рассматриваемых в гл. 10.
Три фермента, к которым относятся дигидролипоилдегидрогеназа (липоамид-дегидрогеназа), глутатионредуктаза и тиоредоксинредук- таза, составляют особый подкласс флавопротеидов. Реакция, катализируемая первым из этих ферментов, представлена в табл. 8-4 (реакция е). Два других фермента катализируют обратную реакцию — восстановление дисульфида до двух —SH-групп при помощи NADPH:

Глутатионредуктаза расщепляет дисульфид надвое, а при восстановлении небольшого белка тиоредоксина (мол. вес. 12000) происходит просто раскрытие дисульфидной «петли» полипептидной цепи, как и при восстановлении липоевой кислоты. Во всех этих трех флавопротеидах имеется дисульфидная группа, которая, по-видимому, находится в непосредственной близости к флавину и также принимает участие в химических реакциях [102, 102а]. Заманчиво полагать, что если дигидролипоевая кислота входит в контакт с дегидрогеназой, то она окисляется до дисульфида внутримолекулярной дисульфидной группой фермента, которая вследствие этого разрывается с образованием двух SH-групп. Общеизвестно, что дисульфиды и тиолы вступают в реакцию дисульфидного замещения и без участия ферментов. На поверхности фермента подобные реакции могут протекать чрезвычайно быстро. Флавиновый кофермент может затем вновь окислять—SH-группы фермента до внутримолекулярного дисульфида, причем восстановленный флавин реокисляется внешним NAD+. Имеются данные о промежуточном образовании полувосстановленного флавина, которое может сопровождаться появлением неспаренного электрона на атоме серы.