Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Коферментные формы витамина В12
Ферментативные функции В12 коферментов
Существуют два типа реакций, нуждающихся в алкилкорриновых коферментах. Реакции первого типа зависят от 5'-дезоксиаденозилкобаламина и могут быть формально изображены следующим образом:
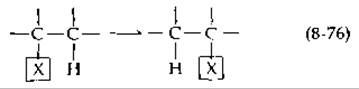
Некая группа X, которая может быть присоединена связью С—С, С—О или С—N, переносится к соседнему атому углерода, несущему атом водорода. В то же время этот атом водорода переносится к углероду, с которым первоначально была соединена группа X. Только в одном случае (для фермента рибонуклеотидредуктазы, табл. 8-6) перенос водорода протекает межмолекулярно. Вторая группа реакций включает перенос метильных групп с участием метилкобаламина и некоторые родственные реакции [163].
Теперь уже получено убедительное доказательство того, что в реакциях первого типа водород переносится через В12-кофермент. Ни в одном из случаев, за исключением рибонуклеотидредуктазы, не происходит никакого обмена со средой. Поскольку X может быть электроотрицательной группой, например ОН-группой, эти реакции в общем можно рассматривать формально как перенос гидрид-иона. Однако более вероятно, что они протекают путем гемолитического расщепления с промежуточным образованием радикалов.
Эйбелес и сотрудники показали, что при катализе диолдегидратазой (табл. 8-6) превращения 1,2-[1-3Н]-пропандиола в пропиональдегид тритий появляется и в коферменте, и в конечном продукте. Если 3Н-содержащий кофермент инкубируют с немеченым пропандиолом, то продукт также содержит 3Н. Химическая деградация меченого кофермента показала, что вся радиоактивность локализована при атоме С-5'. Кроме того, если получить синтетически 5'-дезоксиаденозилкофермент, содержащий 3Н в 5'-положении, то он также передает 3Н продукту. Особенно важно то, что при использовании смеси пропандиола и этиленгликоля внутримолекулярный перенос был ничтожным, т. е. 3Н переносится на ацетальдегид, продукт дегидратации этиленгликоля.
Другой важный эксперимент [171] показал, что 18O из 2-18O-пропан-диола переходит в положение 1 без обмена с растворителем. Кроме того, 18O из 5-1-18O-пропандиола сохраняется в продукте, в то время как в случае R-изомера он не удерживается.
Таким образом, очевидно, что фермент стереоспецифично дегидратирует конечное промежуточное соединение. На основании этих и других экспериментов был предложен частичный механизм, представленный в уравнении (8-77).
На стадии а водород, помеченный звездочкой, переносится на кофермент с расщеплением кобальт-5'-дезоксиаденозильной связи. Теперь 5'-дезоксиаденозин содержит водородный атом субстрата, и этот водород становится эквивалентным двум другим водородным атомам кофермента. Природа субстратного производного, образующегося при этом переносе водорода, не установлена, однако есть основание думать, что удаленный водород замещается кобальтом. Это субстрат-кобаламиновое соединение должно затем подвергнуться реакции изомеризации, что в случае диолдегидратазы приводит к внутримолекулярному переносу ОН-группы [стадия б в уравнении (8-77)]. На стадии в атом водорода вновь переносится от 5'-дезоксиаденозина в новое положение продукта, а на стадии г полученный гем-диол дегидратируется с образованием альдегидного продукта.
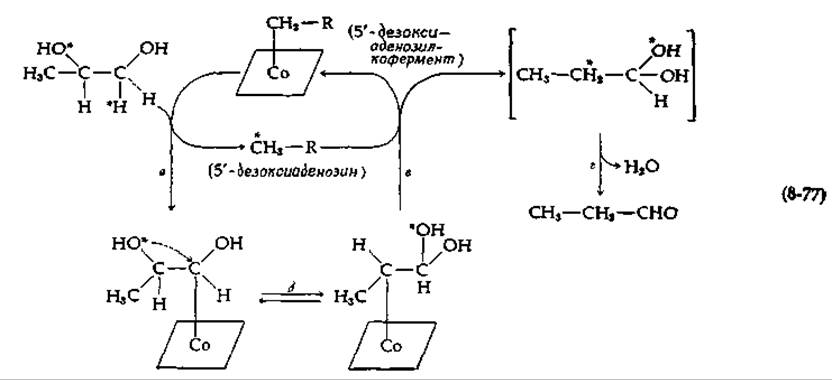
Согласно уравнению (8-77), 5'-дезоксиаденозин освобождается из связи с кобальтом в процессе ферментативного действия. Почему же дезоксиаденозин не отделяется полностью от кофермента, что привело бы его к инактивации? Индуцируемая субстратом инактивация обычно не типична для реакций, зависимых от В12-кофермента, однако она обнаружена у некоторых ферментов при использовании псевдосубстратов. Например, гликолевый альдегид вызывает превращение кофермента диолдегидратазы в 5'-дезоксиаденозин; аналогичная картина наблюдается в случае этаноламиндезаминазы в присутствии этиленгликоля. Если 5'-дезоксиаденозин в нормальном коферменте диолдегидратазы заменить на 5'-дезоксиинозин (гл. 2, разд. Г, 1), то последний количественно освобождается под действием субстрата. Это указывает, по-видимому, на то, что в нормальном холоферменте белок может удерживать адениновую группу 5'-дезоксиаденозина при помощи водородной связи с аминогруппой. Поскольку ОН-группа инозина таутомеризуется в С = О, инозин не может удерживаться столь же прочно.
Доводом в пользу того, что механизм действия этаноламин—аммиаклиазы аналогичен приведенному в уравнении (8-77), является перенос 3Н от 5'-3Н-дезоксиаденозилкобаламина как на субстрат L-2-аминопропанол, так и на продукт реакции с кинетически уловимыми скоростями [172, 173]. Факт переноса 2Н из положения 1 дейтерированного 2-аминопропанола на метальную группу 5,5-ди-2Н-аденозилкобаламина с образованием 5'-дезоксиаденозина, содержащего группу С2Н3, служит еще одним доводом в пользу этого механизма [173а].
Несмотря на существующие доказательства, предположение о том, что 5'-дезоксиаденозин является промежуточным соединением в витамин В12-зависимых реакциях изомеризации, воспринимается с некоторым недоверием. Трудно поверить, чтобы метальная группа могла так быстро обменивать свои атомы водорода. Протонирование кислорода рибозного кольца, согласно уравнению (8-75), могло бы облегчить диссоциацию атома водорода. Однако при замене кольцевого кислорода группой СН2 в синтетическом аналоге коферментная активность не исчезает [163]. Другая возможность заключается в том, что метильная группа приобретает необычную реакционную способность при восстановлении кобальта до Со(II) (см. следующий раздел).