Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Ферменты: белковые катализаторы клеток
Ингибирование и активация ферментов
Агонисты и антагонисты
Ингибирование ферментов лежит в основе действия антибиотиков и других химиотерапевтических препаратов (см., например, дополнение 6-А). Однако многие лекарственные препараты взаимодействуют с рецепторами, расположенными на клеточной поверхности, которые не являются ферментами в обычном смысле этого слова. Согласно теории рецепторов, разработанной примерно в 1937 г., близкие по структуре лекарственные препараты часто оказывают аналогичное действие, поскольку связываются с одним и тем же рецептором. В нормальных условиях рецептор может связывать гормон, нейромедиатор или какой-либо метаболит, структурно близкий лекарственному препарату. Связывание с соответствующим рецептором препаратов одного класса, называемых в фармакологической литературе агонистами, вызывает в клетке ту же реакцию, что и связывание гормона. В то же время соединения с родственной структурой могут действовать и как антагонисты: связывание их с рецептором не вызывает должного ответа. Взаимоотношения агониста и антагониста часто носят конкурентный характер, подобный конкурентному ингибированию ферментов.
Дополнение 6-А
Сульфаниламидные препараты как антиметаболиты
Толчком к синтезу сульфамидных препаратора-в, производных сульфаниламида, послужили исследования П. Эрлиха по окрашиванию паразитических одноклеточных синтетическими красителями. В 1932 г. было обнаружено, что красный краситель 2,4-диаминоазобензол-4'-сульфонамид (пронтозил).
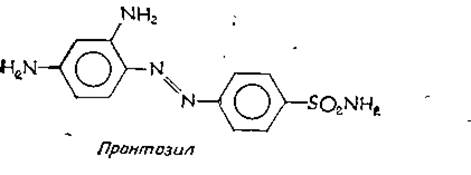
является эффективным средством против инфекций, вызываемых грамположительными бактериями. Дальнейшие исследования показали, что бактерии превращают азокраситель в сульфаниламид — соединение, обладающее четко выраженной бактериостатической активностью (т. е. подавляет pocт бактерий, не вызывая их гибели). Несмотря на то что сульфат ниламид использовался с 1908, г. в больших количествах как промежуточный продукт в синтезе красителей, его антибактериальные свойства оставались неизвестными.
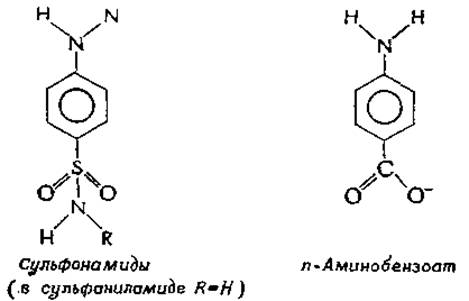
В 1935 г. Д. Вудс (D. Woods) обнаружил, что подавление роста бактерий сульфаниламидом снимается дрожжевым экстрактом. Из этого источника в 1940 г. он выделил n-аминобензойную кислотуг и показал, что ингибирующий эффект, вызываемый 3∙10-4 М сульфаниламидом, исчезает в присутствии 6∙10-8 М n-аминобензоата. Взаимоотношения между двумя соединениями носят строго конкурентный характер: если концентрацию сульфаниламида повысить в два раза, то для снятия ингибирования потребуется вдвое большая концентрация n-аминобензоата. На основании этих данных Вудс и Филдсг,д сформулировали теорию антиметаболитов. Было высказано предположение, что бактерии нуждаются в n-аминобензоате и что сульфаниламид блокирует центр связывания n-аминобензоата. Как теперь известно, это предположение оказалось правильным: фермент, за который происходит конкуренция двух веществ, катализирует синтез дигидроптероевой кислоты (рис. 14-34) —предшественника фолиевой кислоты.
Поскольку сам сульфаниламид оказался токсичным, было синтезировано множество менее токсичных родственных ему соединений. Свыше 10 000 таких препаратов прошли испытание на антибактериальную активность.
а Gale Е. F., Cundliffe Е., Reynolds Р. Е., Richmond М. Н., Waring М. J. (1972). The molecular basis of antibiotic action, Wiley, New York.
б Bardos T. J. (1974). Top Curr. Chem., 52.
в Shepherd R. G. (1970). In: Medicinal Chemistry, 3rd ed. (A. Burger, ed.), pp 255—304. Wiley (Intersciencc), New York
г Woods D D. (1940). Brit J Exp. Pathol, 21, 74—90.
д Fildes P. (1940) Lancet, 1, 955—957.