Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Организация метаболизма: катаболические пути
Цикл трикарбоновых кислот
Эффективный путь расщепления прочной связи
Для завершения окисления жирных кислот ацетильные остатки молекулы ацетил-СоА, образовавшиеся в результате реакций ß-окисления, должны быть окислены до двуокиси углерода и воды [14]. Цикл трикарбоновых кислот, в ходе которого осуществляется это окисление, является жизненно важной частью метаболизма почти всех аэробных организмов. Центральное место этого цикла в метаболизме обусловлено еще и тем, что ацетил-СоА образуется также в процессах катаболизма углеводов и некоторых аминокислот.
Окисление химически устойчивой двухуглеродной ацетильной группы представляет собой весьма трудную химическую задачу. Как мы уже знаем, разрыв связи С—С чаще всего происходит между атомами, занимающими а- и ß-положения относительно карбонильной группы. Такое ß-расщепление (гл. 7, разд. И) в случае ацетильной группы, естественно, невозможно. Единственный способ, который обычно реализуется, — это тиаминзависимое расщепление связи С—С по соседству с карбонильной группой (а-расщепление, гл. 8, разд. Г). Однако а-расщепление требует предварительного окисления (гидроксилирования) метальной группы ацетата. Хотя известно много примеров биологических реакций гидроксилирования (гл. 10, разд. Ж), эти реакции весьма редко используются в основных катаболических процессах1).
Для эффективного окисления ацетильных групп существует другое, весьма распространенное в природе решение: каталитический цикл. Хотя прямой распад невозможен, зато вполне возможна альдольная конденсация двухуглеродной ацетильной группы ацетил-СоА с другим карбонильным соединением. Продукт конденсации содержит уже больше двух атомов углерода, так что становится возможно ß-расщепление с освобождением СО2. Поскольку цикл служит для окисления ацетильных групп, мы будем рассматривать ацетил-СоА как его первичный субстрат. Второе карбонильное соединение, участвующее в конденсации, может быть названо регенерирующимся субстратом. Чтобы завершить каталитический цикл, требуется отщепить два углерода от соединения, образовавшегося в результате конденсации обоих субстратов, и перевести оставшуюся часть молекулы в исходную форму регенерирующегося субстрата. Быть может, читателю будет интересно попробовать самому поискать такую циклическую последовательность реакций окисления ацетильных групп, в которой был бы использован возможно более простой регенерирующийся субстрат. Спросим себя, однако, могла ли природа найти для этой цели что-либо проще, чем оксало-ацетат — соединение, которое действительно используется в цикле трикарбоновых кислот.
1) Мы могли бы здесь сослаться на то, что гидроксилирование является реакцией метаболически «трудной», слишком медленной для основных путей катаболизма. С другой стороны, не видно причин, по которым эти процессы не могли бы идти с участием быстрых и эффективных гидроксилаз. Вероятно, гидроксилирование не используется потому, что оно в конечном итоге дает меньший выход энергии по сравнению с реакциями дегидрирования и последующими процессами в цепи переноса электронов.
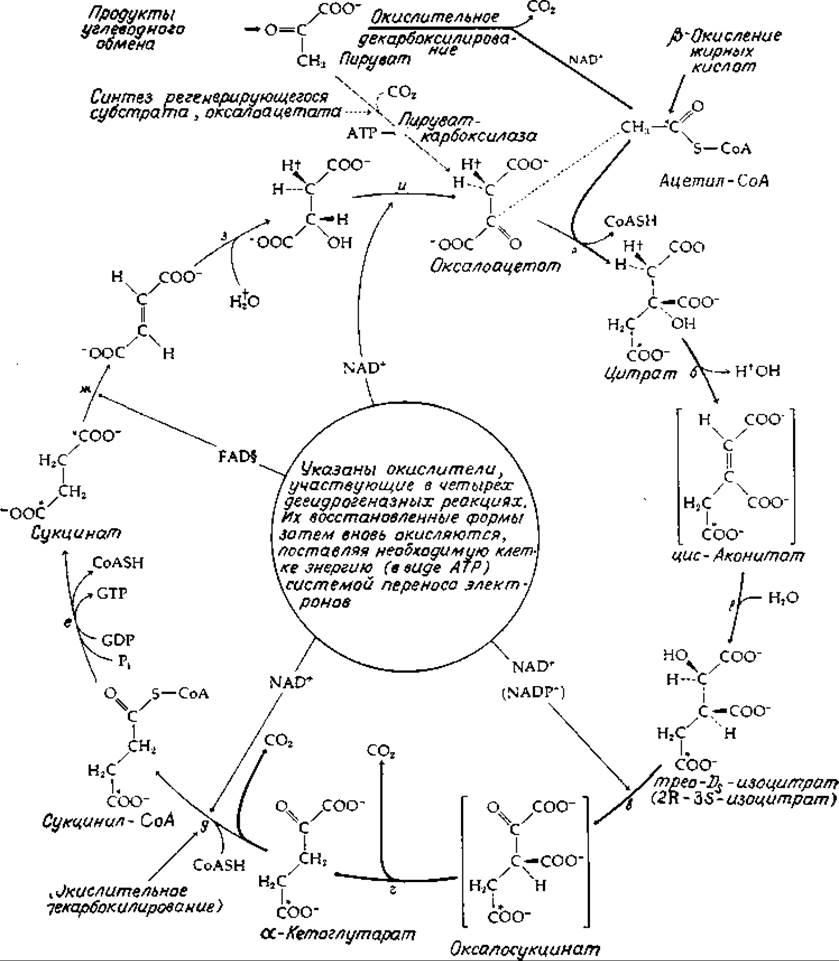
РИС. 9-2. Реакции цикла трикарбоновых кислот. Звездочками указано положение метки, введенной в цикл в ацетате, меченном по карбоксильной группе. Заметим, что два атома углерода, уходящие из цикла в виде СО2, происходят не из вступившей в цикл молекулы ацетил-СоА, а из оксалоацетата. Лишь после нескольких оборотов цикла атомы углерода ацетил-СоА полностью освобождаются в виде СО2. Тем не менее цикл может вполне правомерно рассматриваться как механизм окисления ацетильных групп в СО2. Значком + отмечено положение 2H, включающегося в малат из среды, содержащей 2Н+. FAD — обозначение ковалентносвязанного 8-гистидил-FAD (гл. 8, разд. И, 3).
Реакции цикла трикарбоновых кислот приведены на рис. 9-2. Первой стадией (а) служит конденсация ацетил-СоА с оксалоацетатом. Заметим, что фермент цитратсинтетаза, являющийся катализатором конденсации, путем гидролиза удаляет также молекулу СоА, уже выполнившую свою функцию активатора метального водорода (уравнение 7-67). Однако, прежде чем цитрат, образовавшийся в результате конденсации, может быть подвергнут ß-расщеплению, необходимо перевести третичную гидроксильную группу на соседний углерод, где она в качестве вторичной спиртовой группы могла бы быть окислена в карбонильную группу. Это достигается в ходе стадий бив, которые катализируются ферментом аконитазой [уравнение (7-47)]. Изоцитрат окисляется в ß-кетокислоту, оксалосукцинат, а последний, не покидая поверхности фермента, легко декарбоксилируется [стадии в и г; см. также уравнение (7-75)].
Второй углерод, отщепляемый от цитрата, также уходит в форме СО2 в результате окислительного декарбоксилирования а-кетокислоты, кетоглутарата (а-оксоглутарат, гл. 8, разд. К, 2). Чтобы завершить цикл, остается перевести четырехуглеродную сукцинильную группу сукцинил-СоА снова в оксалоацетат. Это осуществляется в результате двух стадий окисления. Сначала происходит превращение сукцинил-СоА в свободный сукцинат (стадия е), а затем проходят реакции ß-окисления (стадии ж — и на рис. 9-2, см. также рис. 9-1). На стадиях д и е происходит субстратное фосфорилирование (последовательность реакции S7B, рис. 8-19) [15]. Сукцинил-СоА представляет собой «высокоэнергетический» неустойчивый тиоэфир; если бы стадия е сводилась к простому гидролизу тиоэфира, это означало бы бесполезную потерю энергии. Поэтому расщепление тиоэфира идет сопряженно с синтезом АТР (у Е coli и высших растений) или GTP (у млекопитающих). Некоторое количество сукцинил-СоА, образовавшегося в митохондриях, используется иным путем, например так, как показано в уравнении (9-8).
Дополнение 9-В
Открытие цикла трикарбоновых кислот
Одним из первых, кто изучал окисление органических соединений в животных тканях, был Гунберг, который в период между 1911 и 1920 гг. открыл около 40 органических соединений, способных окисляться в животных тканях. Быстрее всего окислялись сукцинат, фумарат, малат и цитрат. Будучи хорошо знаком с теорией ß-окисления Кноопа, Тунберг предложил циклический механизм окисления ацетата. Предполагалось, что две молекулы этого двухуглеродного соединения конденсируются (с восстановлением) в сукцинат, который затем окисляется в оксалоацетат по той же схеме, что и в цикле трикарбоновых кислот. Оксалоацетат далее декарбоксилируется в пируват, а последний в результате окислительного декарбоксилирования превращается в ацетат, чем и завершается цикл. Лишь одну из реакций этого цикла не удалось подтвердить экспериментально (пусть читатель самостоятельно решит, о какой реакции идет речь).
В 1935 г. Сент-Дьёрдьи установил, что все те карбоновые кислоты, о которых теперь известно, что они принимают участие в цикле трикарбоновых кислот, способны стимулировать процессы дыхания в животных тканях в условиях, когда в этих тканях одновременно идет окисление другого субстрата, например глюкозы. Учитывая все эти данные, Кребс1) и Джонсон в 1937 г. предложили цикл трикарбоновых кислот. В 1940 г. Кребс получил дальнейшее подтверждение предложенной схемы: он показал, что малонат, близкий структурный аналог сукцината и конкурентный ингибитор его превращений, даже при столь низких концентрациях, как 0,01 М, блокирует дыхание тканей, препятствуя окислению сукцината в фумарат.
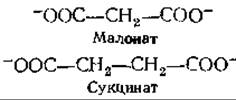
В мышцах дыхание ингибировалось на 90%, и при этом наблюдалось накопление сукцината — еще одно серьезное доказательство важной роли цикла трикарбоновых кислот в процессах дыхания животных тканей.
Дополнение 9-Г
Яды: фторацетат и «летальный синтез»
Среди простых соединений самым «смертельным» ядом является фторацетат натрия. LD50 (доза, летальная для 50% получивших ее животных) для крыс составляет всего лишь 0,2 мг/кг — почти в 10 раз меньше летальной дозы нервного яда диизопропилфторфосфата (гл. 7, разд. Г, 1а,б). Широко употребляемый (хотя и отзывы о его действии противоречивы) как яд для грызунов «1080», фторацетат был также обнаружен в листьях некоторых ядовитых растений, встречающихся в Африке, Австралии и Южной Америке. Примечательно, что дифторацетат HCF2—СОО- вообще нетоксичен.
Биохимическими исследованиями установлено, что сам фторацетат не оказывает на клетки токсического действия. Токсичность проявляется лишь после метаболического превращения фторацетата в фтороцитрат, являющийся высокоспецифичным ингибитором аконитазы (гл. 7, разд. 3,6б,в). Этот факт весьма примечателен, поскольку изомерный фтор-цитрат, образующийся в реакции фтороксалоацетата с ацетил-СоА, оказывает на тот же фермент лишь слабое ингибирующее действие, хотя как раз у этого изомера атом фтора находится на том участке, который атакуется аконитазой.
Атом фтора имеет небольшой вандерваальсов радиус (0,135 нм), сравнимый с вандерваальсовым радиусом водорода (0,12 нм); на это обстоятельство часто ссылаются, когда говорят о способности фторсодержащих соединений «обманывать» ферменты. Однако более вероятно, что высокая электроотрицательность фтора и его способность к участию в водородных связях делают его в метаболическом отношении более сравнимым с —ОН-группой. В случае с фторцитратом предполагают, что ингибирующий изомер связывается с аконитазой «неправильным способом», при котором атом фтора оказывается координационно связанным с атомом железа в активном центре аконитазыв.
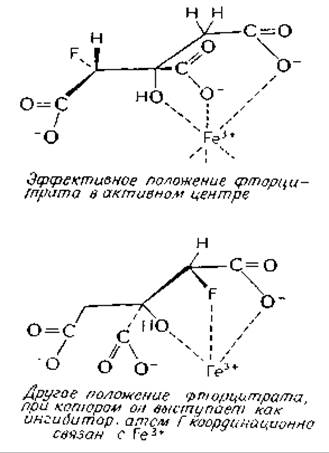
Известно довольно много природных фторсодержащих соединенийв. Биохимические свойства этих соединений и фторсодержащих лекарственных препаратов требуют дальнейшего изучения.
1) Лауреат Нобелевской премии за 1953 г.
а Gibble G. W., J. Chem. Educ., 50, 460-462 (1973).
б Elliot К., Birch I. eds., Ciba Foundation, Carbon-Fluorine Compounds, Elsevier, Amsterdam, 1972.
в Glusker J. P. In: The Enzymes (P. D. Boyer, ed.), 3rd ed., Vol. 5, pp. 413—439, Academic Press, New York, 1971.