Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Организация метаболизма: катаболические пути
Катаболизм пропионилкофермента А и пропионата
При ß-окислении жирных кислот с нечетным числом атомов углерода происходит образование не только ацетил-СоА, но и пропионил-СоА. Трехуглеродная пропионильная группа образуется также при расщеплении изопреноидных соединений, изолейцина, треонина и метионина.
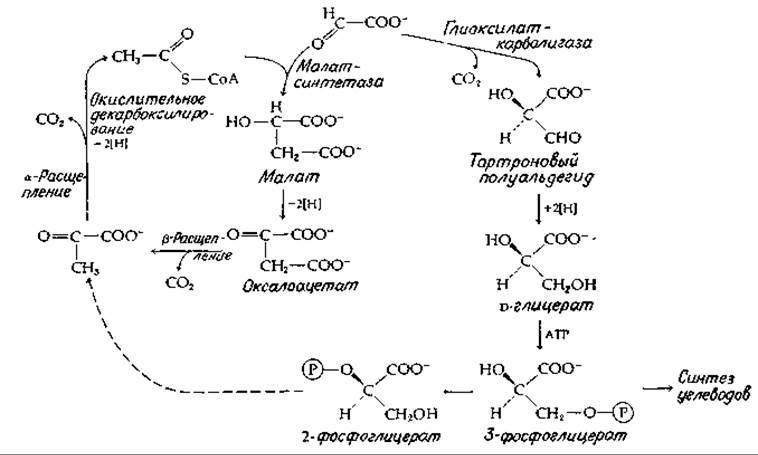
РИС. 9-5. Цикл дикарбоновых кислот, в котором происходит окисление глиоксилата до двуокиси углерода.
Человек потребляет небольшие количества пропионовой кислоты, которую, в частности, содержит швейцарский сыр (при его изготовлении используются бактерии, продуцирующие пропионовую кислоту); пропионат добавляют также в хлеб для предотвращения развития плесени. Для жвачных животных, в частности для коров1), пропионат служит одним из основных источников энергии.
1) У крупного рогатого скота, овец и других жвачных животных перевариваемая пища весьма интенсивно сбраживается в рубце — крупном пищеварительном органе, в котором имеются разрушающие целлюлозу бактерии и некоторые простейшие. Основными продуктами происходящего в рубце брожения являются ацетат, пропионат и бутират.
Дополнение 9-Е
Селен: смертельный яд и обязательный компонент пищи
Шварц и его сотрудники в 1957 г. обнаружили удивительный факт: крайне токсичный элемент селен оказался существенным компонентом пищи, отсутствие которого приводило к гибели клеток печени крысыа. Для предотвращения некроза печени достаточно было присутствие в диете всего лишь 0,1 миллионной доли селена. Примерно такие же количества селена, как выяснилось, предотвращают развитие мышечной дистрофии («побеления мышц») у крупного рогатого скота и овец, пасущихся на местности с недостаточным количеством селена. Селенит натрия и другие неорганические соединения селена оказались в этом отношении более эффективны, чем органические соединения, в которых S была заменена на Se.
Недавно было найдено четыре белка, содержащих селенб,в. Используя радиоактивный 75Se, удалось выделить небольшие количества этих селенопротеидов в чистом виде. Селен, вероятно, ковалентно присоединен к белку, возможно к ароматической или гетероциклической простетической группе.
Один из селенопротеидов, функция которого еще не установлена, выделен из мышц. У животных с мышечной дистрофией он не обнаружен. Это небольшой белок с мол. весом ~ 10 000; в качестве простетической группы он содержит гем.
Другим селенсодержащим белком является глутатионпероксидаза, катализирующая реакцию окисления глутатиона (GSH, дополнение 7-Ж) перекисью водородав,г:
![]()
В отличие от большинства пероксидаз этот фермент не является гемопротеидом, но содержит один атом селена, связанный с пептидной цепью с мол. весом ~ 22 000. Нативный фермент представляет собой тетрамер, состоящий из четырех таких цепей. Глутатионпероксидаза является главным средством защиты от накопления в клетках Н2О2 и органических перекисей (дополнение 10-А).
Третий селенопротеид, формиатдегидрогеназа (описанный в основном тексте), содержит как селен, так и молибден.
Функция четвертого селенопротеида, выделенного из Clostridium sticklandii, связана с восстановительным дезаминированием глицина.
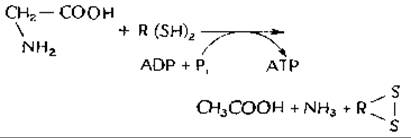
Механизм этого примечательного восстановления аминокислоты дитиоловым соединением остается загадкой, но среди трех или четырех белков этой редутазной системы имеется термостабильный кислый белок с мол. весом ~ 12 000, содержащий один атом селена на молекулуб.
Рассматривались и другие возможные биологические функции селена. Селенопротеид может служить посредником при передаче электронов от восстановленного глутатиона на систему цитохромовд. Имеется сообщение о способности селена защищать животных от токсического действия ртути — этот факт можно связать с той легкостью, с какой селен подвергается метилированию (гл. 8, разд. М, 7). Многочисленные данные свидетельствуют о наличии взаимосвязи между пищевой потребностью в селене и витамине Е. Отсутствие любого из них вызывает у многих животных дистрофию мышц, а у кур — сильный отек («эксудативный диатез»). Поскольку крысы с недостаточностью витамина Е имеют также низкое содержание селенида (Se2-), было высказано предположение, что витамин Е предохраняет восстановленный селен от окисленияе. На основании этих наблюдений было сделано также предположение о существовании белков с Fe—Se-центром, аналогичных уже известным Fe—S-белкам (формиагдегидрогеназа из Clostridium thermoaceticum содержит как негемовое железоб, так и селен).
Относительно метаболизма селена известно сравнительно немногоб. Используя 75Se в качестве изотопной метки, удалось показать, что печень крысы в норме содержит Se2-, SeO2-3и селен в более окисленном состоянииб. Существует предположение, что восстановление селенита в селенид происходит с участием глутатионаж. Неферментативное восстановление селенита глутатионом приводит к образованию селенотрисульфида
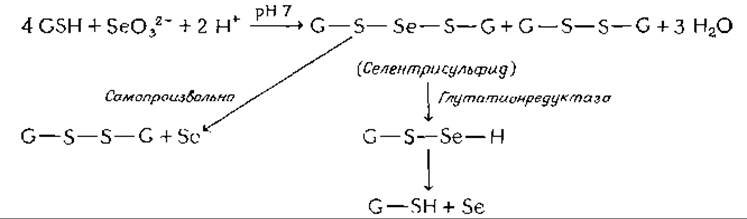
Последнее соединение распадается самопроизвольно на окисленный глутатион и элементарный селен или в присутствии глутатионредуктазы на глутатион и селен. Весьма вероятно, что селен может внедряться в органические группы из селено-персульфидных промежуточных соединений типа постулируемого в последней реакции.
а Frieden Е., Sсi. Am., 227, 52—60 (Jul 1072).
б Stadtman T. C., Science, 183, 915—922 (1974),
в Ganther H. E. In: Selenium (R. A. Zingaro and W. C. Cooper, eds.), pp. 546—614, Van Nostrand-Reinhold, Princeton, New Jersey, 1974.
г Rotruck I. T., Pope A. L., Ganther H. E., Swanson D., Hafeman G., Hoekstra W. G., Science, 179, 588—590 (1973).
д Levander О. A., Morris V. C., Higgs D. I., Fed. Proc., Fed. Am. Soc. Exp. Biol., 32, 886 (abstr.) (1973).
е Diplock A. T., Lucy I. A., FEBS Lett., 29, 205—210 (1973).
ж Sandholm M., Sipponen P., ABB, 155, 120—124 (1973).