Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Ферменты: белковые катализаторы клеток
Ингибирование и активация ферментов
Аллостерические эффекторы и изменения конформации ферментов
В основе многих явлений регуляции, по-видимому, лежит связывание эффектора с аллостерическим центром, вызывающее изменение конформации молекулы фермента. Эффект действия аллостерических ингибиторов и активаторов на олигомерные ферменты -обычно называют аллостерией (или аллостеризмом)1). Однако аллостерическая регуляция может иметь место и в случае мономерных ферментов, поэтому мы начнем наше рассмотрение с мономера, который содержит связывающие центры для субстрата, ингибитора и активатора и может находиться в двух конформациях — А и В (рис. 6-10). Допустим, что [см. уравнение (4-42)] конформер В связывает одинаково хорошо и субстрат, и активатор, однако плохо связывает ингибитор или не связывает его совсем. В то же время конформер А хорошо связывает ингибитор, но обладает низким сродством к субстрату и активатору. Подвижное равновесие между двумя конформерами, которые обладают различающимися связывающими способностями, обеспечивает «включение» или «выключение» фермента в зависимости от условий.
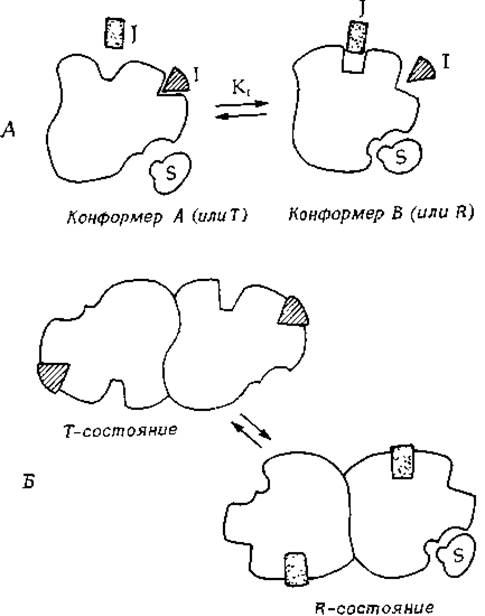
РИС. 6-10. А. Мономерный фермент, имеющий связывающие центры для ингибитора I и активатора J. Конформер А прочно связывает ингибитор I, однако обладает низким сродством к активатору J или к субстрату S. Конформер В связывает субстрат S и катализирует его превращение. Конформер В связывает также активатор J, присутствие которого стабилизирует это конформационное состояние. В широко известной модели Моно и др. [35] конформеры А и В обозначаются через Т и R. 5. Стабилизированные ингибитором или активатором состояния димерного фермента (состояния Т и R соответственно). В состоянии R обе субъединицы находятся в конформации, благоприятствующей связыванию субстрата.
1) Для более детального ознакомления с молекулярными основами аллостерической Регуляции читателю можно рекомендовать вышедшую недавно книгу: Курганов Б. И. Аллостерические ферменты. — М.: Наука, 1978.—Прим. перев.
Находящийся в клетке ингибитор связывается с конформером А и при достаточно высокой концентрации переводит весь фермент в неактивную форму А. Фермент оказывается «выключенным» или по крайней мере обладает очень низкой активностью. При высоких же концентрациях активатора фермент будет «включен» за счет стабилизации конформации В. Доля молекул фермента, находящихся в активной форме В, определяется концентрацией ингибитора, активатора и субстрата в клетке в данный момент времени. Подобное соотношение между ингибированием и активацией лежит в основе многих явлений регуляции клеточного метаболизма (гл. 1, разд. Е).
Действие ингибиторов и активаторов на мономерный фермент, представленный двумя взаимопревращающимися формами А и В (рис. 6-10), можно описать уравнениями типа (6-48) и (6-49) [схема (6-47)], отдельные члены которых соответствуют ингибированию и активации. Равновесие между двумя конформерами может быть охарактеризовано также при помощи уравнения (4-44). Для мономерных ферментов обычно нецелесообразно разделять константы Кt и КВХ [см. уравнение (4-44)], характеризующие соответственно конформационное изменение и связывание субстрата или активатора.
Большинство внутриклеточных ферментов обладает олигомерной структурой, и поэтому связывание аллостерических эффекторов приводит к весьма интересным явлениям. Для получения соответствующих математических выражений необходимо ввести по паре констант связывания для ингибитора и активатора, характеризующих сродство к конформерам А и В. Поскольку при составлении уравнений материального баланса необходимо учесть все возможные комплексы, получающиеся выражения весьма сложны. Функции насыщения в модели Моно — Уаймена — Шанжё (гл. 4, разд. Д) имеют довольно простой вид. В соответствии с уравнением (4-53) степень насыщения ![]() для этой модели
для этой модели
определяется следующим выражением:
![]()
Здесь L — аллостерическая константа, смысл которой в случае димера ясен из уравнения (4-50). Через с обозначено отношение констант диссоциации КBS и KAS, характеризующих сродство субстрата к конформерам В и А соответственно1)
c = KBS/KAS (6-52)
Наконец, а представляет собой «нормированную» концентрацию субстрата2):
а = [S]/KBS. (6-53)
Обратите внимание на то, что в этой главе используются константы диссоциации комплексов ES, в то время как в гл. 4, включая уравнение (4-53), — константы ассоциации.
2) В обозначениях, принятых в гл 4, a = [S]/KBS.
Чтобы учесть влияние ингибитора (I) и активатора (J), вводят отношения констант диссоциации комплексов ВІ и AI и комплексов BJ и AJ:
![]()
и нормированные концентрации ингибитора и активатора
![]()
Функция насыщения в присутствии ингибитора и активатора, концентрации которых равны ß и у соответственно, по-прежнему описывается
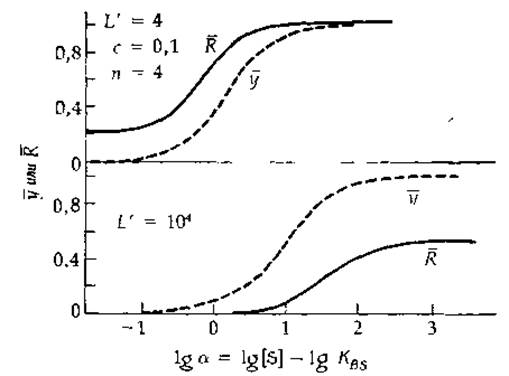
РИС 6-11 Зависимости степени насыщения ![]() и доли фермента, находящегося в конформации R
и доли фермента, находящегося в конформации R ![]() от логарифма «нормированной» концентрации субстрата (а=[S]/KBS) для гипотетического тетрамерного фермента (n = 4), механизм действия которого следует модели Моно, Уаймена и Шанже [39] Кривые рассчитаны при с = 0,1 и двух значеннях кажущейся аллостерической константы L' = 4 и L' = 104.
от логарифма «нормированной» концентрации субстрата (а=[S]/KBS) для гипотетического тетрамерного фермента (n = 4), механизм действия которого следует модели Моно, Уаймена и Шанже [39] Кривые рассчитаны при с = 0,1 и двух значеннях кажущейся аллостерической константы L' = 4 и L' = 104.
уравнением (6-51), однако аллостерическая константа L должна быть заменена кажущейся аллостерической константой L' [39]:
![]()
На рис. 6-11 представлены зависимости у от lga для тетрэмера при двух разных значениях L' и определенном значении с В обоих случаях ![]() с ростом lga приближается к J. Однако, поскольку при высоких значениях U ингибирование носит неконкурентный характер, значительная Доля фермента в насыщающих условиях находится в конформации Т или, иначе, А).
с ростом lga приближается к J. Однако, поскольку при высоких значениях U ингибирование носит неконкурентный характер, значительная Доля фермента в насыщающих условиях находится в конформации Т или, иначе, А).
Как мы видели ранее, неконкурентное ингибирование не снимается полностью при очень высоких концентрациях субстрата Моно и др. ввели функцию состояния ![]() которая определяется как доля фермента, находящегося в конформации R (В).
которая определяется как доля фермента, находящегося в конформации R (В).
![]()
В К-системе (см. разд. Б, 2) скорость ферментативной реакции определяется именно величиной ![]() На рис. 6-11 представлен график зависимости
На рис. 6-11 представлен график зависимости ![]() от lg a. Заметим, что, когда величина U мала, функция состояния
от lg a. Заметим, что, когда величина U мала, функция состояния ![]() не стремится к нулю, даже если [S]→0. Иными словами, фермент никогда полностью не «выключается». Точно так же при высоких значениях U фермент никогда не работает на полную мощность.
не стремится к нулю, даже если [S]→0. Иными словами, фермент никогда полностью не «выключается». Точно так же при высоких значениях U фермент никогда не работает на полную мощность.
Рис. 6-11 можно сопоставить с рис. 6-7, на котором приведены аналогичные кривые для случая неконкурентного ингибирования мономерного фермента. Отметим, что насыщение олигомерного фермента происходит в более узком интервале концентраций лиганда, чем для мономерного фермента, т. е. насыщение олигомерного фермента субстратом (особенно в присутствии ингибитора) происходит кооперативно. Это имеет место лишь в том случае, когда в отсутствие субстрата фермент находится преимущественно в состоянии Т (А).
В модели Моно и др. [35] аллостерические взаимодействия между двумя идентичными молекулами (будь то молекулы субстрата или эффектора) называются гомотропными. Подобные взаимодействия приводят к кооперативному или антикооперативному характеру связывания. Аллостерические взаимодействия между неидентичными молекулами (например, между субстратом и активатором) называются гетеротропными.
Для многих ферментов модель Моно и др. оказывается слишком упрощенной, и для анализа равновесного связывания необходимо применять более общий подход (гл. 4). Следует, однако, иметь в виду, что наряду с К-системами существуют V-системы, в которых аллостерический эффектор вызывает изменение максимальной скорости [см. схему (6-47)], а иногда и обоих кинетических параметров одновременно (максимальной скорости и сродства к субстрату).
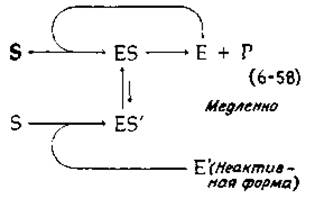
Тот факт, что экспериментальные данные удовлетворительно описываются тем или иным уравнением, нельзя рассматривать как доказательство адекватности предлагаемой математической модели. Например, Рабин [40] дал иное простое объяснение сигмоидного характера кривой зависимости скорости ферментативной реакции от концентрации субстрата1). Кооперативными свойствами может обладать даже мономерный фермент с единственным центром связывания. Фермент в активной конформации (Е) взаимодействует с субстратом, и образующийся комплекс ES быстро распадается с образованием продукта [верхняя петля на схеме (6-58)]. Однако не исключена возможность медленного конформационного перехода Е—>Е' (где Е' — малоактивная форма, обладающая значительно меньшим сродством к субстрату). Комплекс же E'S (если он образуется) может находиться в равновесии с ES, что вызывает изменение конформационного состояния белка. При низких концентрациях субстрата будет преобладать форма Е', и поэтому ферментативная активность будет низкой. При высоких концентрациях субстрата фермент будет оставаться в форме Е достаточно долго, чтобы связать еще одну молекулу субстрата и сохранить, таким образом, активную конформацию. Детали этой и других кинетических моделей, из которых следует, что кривые зависимости скорости от концентрации субстрата должны иметь сигмоидный характер, обсуждаются Ньюсхолмом и Стартом [41].
1) Рабин [40] ограничился лишь качественными рассуждениями Количественно вопрос рассмотрен в работе Ainshe G. R., Jr, Shill J. P., Neet К E. (1972) J. Biol. Chem., 247, 7088—7096. — Прим. пepeв.
Кооперативный характер связывания ферментов с субстратами имеет, пожалуй, такое же большое физиологическое значение, как и кооперативное связывание гемоглобина с кислородом, которое обеспечивает более эффективное высвобождение связанного кислорода в тканях (гл. 4, разд. Д, 5). Кооперативность связывания субстрата отсутствует в том случае, когда благодаря избытку активатора фермент переходит в состояние R (В), при котором связывающие центры ведут себя независимо. В то же время связывание активатора должно характеризоваться сильно выраженной кооперативностью, т. е. скорость реакции должна изменяться при изменении концентрации активатора сильнее, чем в случае гиперболической активации. Аналогичным образом кооперативное связывание ингибитора обеспечивает более быстрое «выключение» фермента при увеличении концентрации ингибитора. По-видимому, эволюция олигомерных ферментов (по крайней мере отчасти) обусловлена большей эффективностью механизмов регуляции, в основе которых лежит кооперативное связывание эффекторов.