Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
О том, как электроны встречаются с кислородом, как при этом образуется ATR и о некоторых родственных явлениях
Цепь переноса электронов и окислительное фосфорилирование
Последовательность функционирования переносчиков электронов
В какой последовательности действуют переносчики, через которые проходит поток электронов? При обсуждении этого вопроса мы возьмем за основу схему, приведенную на рис. 10-11, хотя некоторые детали пока еще неизвестны. В основе приведенной схемы лежат результаты, полученные при использовании нескольких разных подходов. Во- первых, есть основания думать, что переносчики располагаются в порядке возрастания восстановительного потенциала — на рис. 10-11 слева направо. Впрочем, это положение не обязательно должно строго соблюдаться, особенно если учесть, что восстановительные потенциалы переносчиков в митохондриях могут оказаться иными, чем у изолированных ферментов.
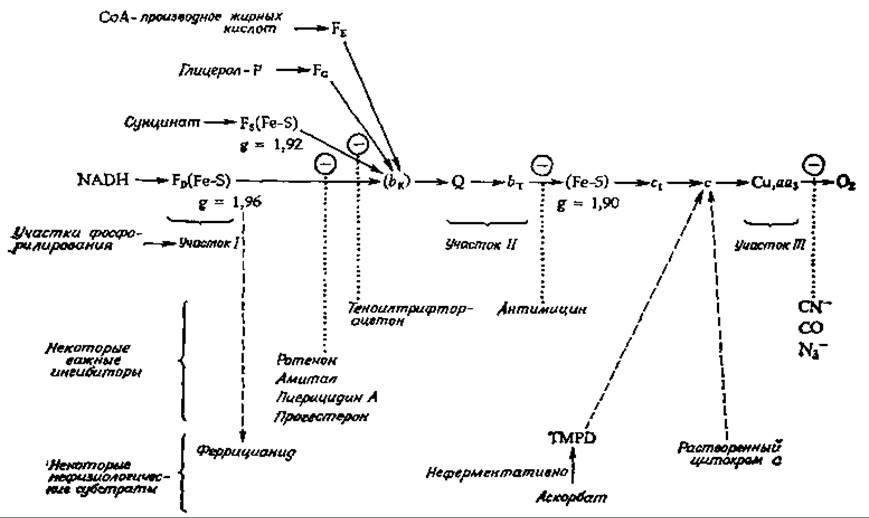
РИС. 10-11. Схема, иллюстрирующая современные представления о цепи переноса электронов в митохондриях.
Некоторые известные ингибиторы дыханияа
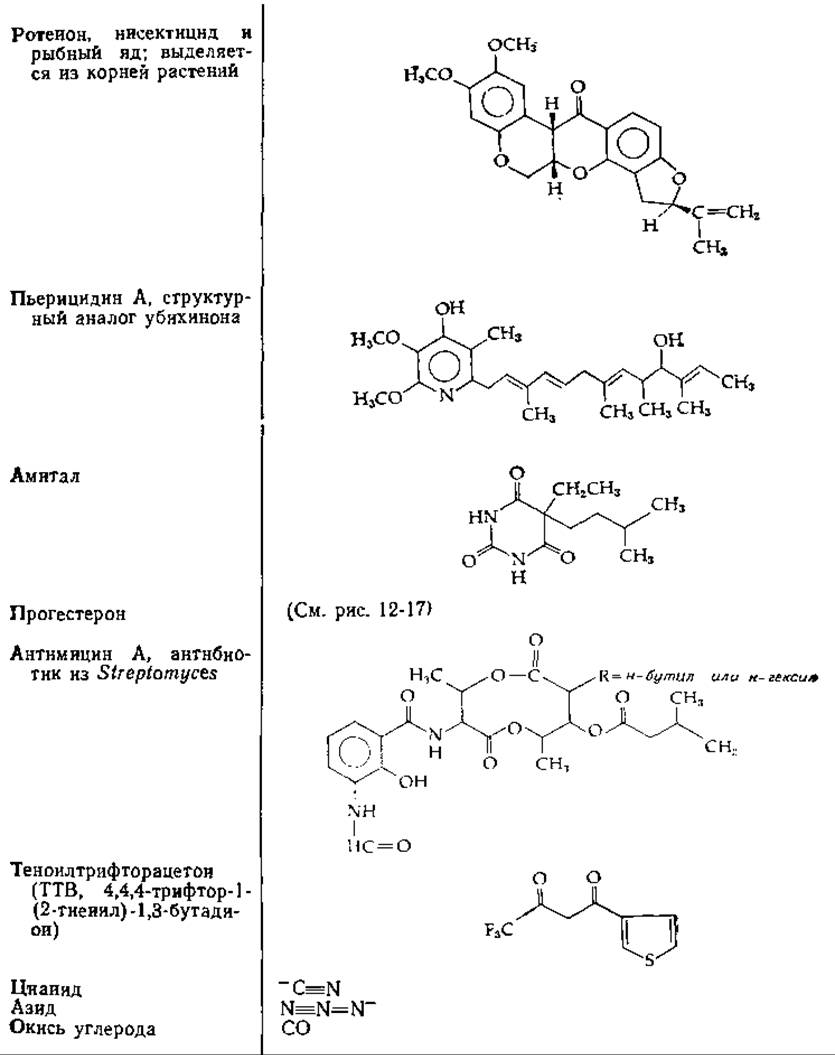
а Места ингибирования см. на рис. 10-11.
Сконструированный Чансом двухволновой спектрофотометр позволяет легко наблюдать состояние окисления или восстановления данного переносчика в митохондриях [68]. Этот метод в сочетании с использованием специфических ингибиторов (некоторые из них указаны на рис. 10-11 и в табл. 10-2) содействовал установлению некоторых последовательностей в цепи переноса электронов. Например, блокирование ротеноном или амиталом препятствует восстановлению системы цитохромов за счет NADH, но не нарушает восстановления сукцинатом или другими субстратами, имеющими свои собственные флавопротеидные посредники. Другой подход к выяснению последовательности переносчиков связан с использованием искусственных электронных акцепторов; некоторые из них приведены ч табл. 10-3. Они обеспечивают обход различных участков цепи, как показано на рис. 10-11.
Важным методом изучения цепи переноса электронов является разделение митохондриальных мембран на фрагменты, сохраняющие способность катализировать отдельные реакции цепи. Существует много методов, используемых для получения субмитохондриальных частиц. Широкоизвестный препарат Кейлина—Хартри из сердечной мышцы получают гомогенизацией митохондрий и осаждением фракций при низких значениях pH. Хотя получаемые в результате частицы имеют низкое содержание цитохрома с и не способны к окислительному фосфорилированию, они активно «дышат». С помощью ультразвука был получен другой тип переносчиков электронов. Под электронным микроскопом такие частицы выглядят как маленькие образованные мембранами пузырьки, напоминающие митохондриальные кристы.
Хотя многие детергенты оказывают на белки сильное денатурирующее действие, некоторые детергенты разрушают митохондриальные мембраны с сохранением ферментативной активности. Наиболее предпочтительным среди них является дигитонин (рис. 12-18), вызывающий разрушение наружной мембраны. Остающиеся фрагменты внутренней мембраны сохраняют способность к окислительному фосфорилированию. Последующее фракционирование субмитохондриальных частиц, проводится с помощью химической обработки. Одна из таких процедур дает набор «комплексов», катализирующих реакции четырех разных, частей цепи переноса электронов [69]. Реакции, катализируемые комплексами I, II, III и IV, указаны в уравнении (10-10).
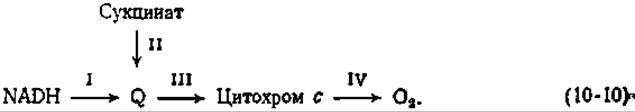
В результате химического анализа комплексов было установлено расположение некоторых компонентов в интактной цепи. Например, в комплексах I и II обнаружено высокое содержание железа, а в комплексе IV найдена медь.
Пришло время сказать и о той особой роли, которую в цепи переноса электронов играет убихинон. Многие данные указывают, что он является истинным и существенным переносчиком электронов. Например, мутанты Е. coli, неспособные синтезировать убихинон, могут расти, сбраживая глюкозу, но не выживают на средах с такими субстратами, как сукцинат, для использования энергии которых необходимы процессы окисления [70]. Растворимый в липидах убихинон присутствует в бактериальных и митохондриальных мембранах в относительно больших количествах (табл. 10-1) по сравнению с другими переносчиками электронов. По-видимому, он функционирует на стыке NADH- и сукцинатной ветвей цепи и обычно рассматривается как «растворимый» переносчик в отличие от «фиксированных» переносчиков, таких, как флавопротеиды и цитохромы. В этом отношении убихинон играет роль, сходную с ролью NAD+, который переносит электроны от различных растворимых дегидрогеназ, находящихся в водном растворе матрикса, к мембранному флавопротеиду, NADH-дегидрогеназе. Третий митохондриальный компонент, который может функционировать подобным образом, — это цитохром с. В отличие от других цитохромов он растворим в воде и легко вымывается из митохондриальных мембран. Тем не менее его содержание относительно фиксированных цитохромов обычно составляет 1:1. Маловероятно, чтобы он так же свободно диффундировал, как убихинон и NAD+.